
Abstrak
Suntikan cabotegravir 200 mg/mL (CAB200) kerja lama (LA) disetujui untuk pencegahan HIV-1 dan sebagai rejimen pengobatan HIV-1 LA lengkap dengan rilpivirine. Formulasi suspensi konsentrasi tinggi, cabotegravir 400 mg/mL (CAB400-D), dikembangkan untuk memungkinkan pemberian dosis yang lebih jarang dan pemberian sendiri. Studi fase 1, double-blind, acak (NCT04484337) ini mengevaluasi suntikan intramuskular (IM) gluteal, subkutan (SC) abdomen, dan IM paha CAB400-D (200-800 mg [0,5-2,0 mL]) pada orang dewasa tanpa HIV, menggunakan suntikan CAB200 sebagai kontrol aktif. Pemberian bersama dengan hialuronidase manusia rekombinan (rHuPH20), obat antiinflamasi nonsteroid topikal, atau steroid topikal dievaluasi untuk beberapa suntikan SC. Farmakokinetik, efek samping (AE), dan hasil yang dilaporkan peserta dinilai. Secara keseluruhan, 138 peserta didaftarkan. Penyerapan lebih cepat dengan CAB400-D dibandingkan dengan CAB200. Dalam waktu 4 minggu, paparan plasma CAB400-D serupa di seluruh rute pemberian dan lebih tinggi daripada CAB200. Pemberian bersamaan dengan rHuPH20 meningkatkan laju penyerapan spontan CAB400-D tetapi tidak dengan CAB200. Tidak ada kematian atau AE serius terkait obat yang diamati. Lima (4%) peserta menghentikan pengobatan karena AE (reaksi di tempat suntikan [ISR], n = 3 penghentian). Sebagian besar (99%) peserta mengalami ≥ 1 ISR. Peserta melaporkan penerimaan suntikan yang baik. Meskipun suntikan CAB400-D menunjukkan keamanan/toleransi yang dapat diterima, penyerapan yang lebih cepat daripada CAB200 membatasi interval pemberian dosis potensial menjadi dosis bulanan. Formulasi cabotegravir alternatif dengan interval dosis yang lebih panjang sedang dalam evaluasi klinis.
Kemajuan dalam terapi antiretroviral (ART) telah meningkatkan kualitas hidup orang dengan HIV dan mengubah HIV menjadi kondisi kronis yang dapat diobati. 1 – 3 Namun, persyaratan untuk pengobatan oral harian seumur hidup bagi orang dengan HIV menghadirkan tantangan, termasuk kesulitan dengan kepatuhan harian, pengingat harian tentang status HIV, kekhawatiran stigmatisasi, dan beban pil atau kelelahan. 3 – 6 Selain itu, beberapa tantangan ini meluas ke orang yang menggunakan antiretroviral sebagai profilaksis prapajanan HIV (PrEP). 7 , 8 Pengembangan ART kerja lama (LA) yang dapat disuntikkan menawarkan potensi untuk meringankan beberapa tantangan ini. 4 , 9
Cabotegravir (CAB) kerja panjang, inhibitor transfer untai integrase, digunakan untuk pencegahan HIV-1 dan, bila diberikan bersamaan dengan inhibitor transkriptase balik non-nukleosida LA rilpivirine (RPV), untuk mempertahankan supresi virologi HIV-1. Dalam studi fase 2b/3 pada wanita cisgender, pria cisgender yang berhubungan seks dengan pria, dan wanita transgender tanpa HIV (studi HPTN 083 dan HPTN 084), CAB 600 mg (3 mL) yang diberikan setiap 2 bulan sebagai PrEP secara keseluruhan ditoleransi dengan baik dan lebih unggul daripada tenofovir disoproxil fumarate 300 mg oral harian yang diformulasikan bersama plus emtricitabine 200 mg dalam mencegah penularan HIV. 10 , 11 Dalam studi klinis fase 3/3b pada orang dengan HIV-1 yang mengalami supresi virologi, CAB 400 mg (2 mL) + RPV 600 mg (2 mL) yang diberikan tiap bulan sama efektifnya dengan regimen oral harian dengan profil keamanan yang baik dan akseptabilitas suntikan yang tinggi (studi FLAIR dan ATLAS); lebih lagi, CAB 600 mg (3 mL) + RPV 900 mg (3 mL) yang diberikan tiap 2 bulan sama efektifnya dengan CAB 400 mg (2 mL) + RPV 600 mg (2 mL) yang diberikan tiap bulan dan pada regimen oral harian (masing-masing ATLAS-2 M dan SOLAR). 12 – 15 Peserta melaporkan kepuasan pengobatan yang tinggi dengan CAB + RPV dan lebih memilih suntikan daripada terapi oral harian. 13 , 15 , 16
Formulasi CAB dari penelitian ini, CAB 200 mg/mL (CAB200), telah disetujui dan diberikan setiap bulan atau setiap 2 bulan melalui suntikan gluteal intramuskular (IM). Dalam penelitian fase 2/3/3b pada orang dengan dan tanpa HIV-1, waktu paruh terminal rata-rata geometris (T 1/2 ) setelah suntikan gluteal IM CAB200 adalah 25-60 hari, yang secara substansial lebih lama daripada T 1/2 35 hingga 42 jam dari dosis CAB oral. 12 – 14 , 17 – 21 Ini menunjukkan laju penyerapan yang lebih lambat daripada laju eliminasi dengan suntikan IM (yaitu, penyerapan terbatas atau kinetika “flip-flop”), yang dapat terjadi pada obat LA dengan pemberian ekstravaskular. 22
Formulasi suspensi yang lebih pekat, CAB 400 mg/mL (CAB400-D), dapat menawarkan lebih banyak keuntungan dibandingkan dengan formulasi CAB200 saat ini, termasuk dosis CAB yang lebih tinggi per injeksi, interval pemberian dosis yang lebih panjang antara injeksi, pemberian di tempat injeksi yang berbeda, dan pemberian sendiri, yang dapat memberikan kemudahan lebih besar karena kunjungan klinik yang lebih sedikit dan meningkatkan kepatuhan, hasil klinis, kepuasan, dan penerimaan. Dosis dan interval pemberian dosis dapat ditingkatkan lebih lanjut dengan injeksi subkutan (SC) CAB400-D atau CAB200 dengan hialuronidase manusia rekombinan (rHuPH20), bentuk enzim hialuronidase manusia yang terjadi secara alami dan sangat murni yang memungkinkan volume injeksi SC yang lebih besar dengan meningkatkan dispersi obat yang disuntikkan bersamaan. 23 Selain itu, penggunaan steroid topikal atau obat antiinflamasi nonsteroid (NSAID) dapat meminimalkan tingkat keparahan atau durasi reaksi di tempat injeksi (ISR) yang terkait dengan pemberian SC.
Studi fase 1 ini mengevaluasi farmakokinetik (PK), keamanan, dan tolerabilitas suntikan CAB400-D yang diberikan melalui rute IM gluteus medius (IM gluteal), SC abdominal, dan IM vastus lateralis (IM paha), serta suntikan SC CAB400-D atau CAB200 yang diberikan bersamaan dengan rHuPH20, steroid topikal, atau NSAID topikal, pada orang dewasa tanpa HIV.
Metode
Desain Studi
Studi fase 1, double-blind (sponsor unblind), active-controlled, randomized ini menilai PK, keamanan, dan tolerabilitas CAB400-D yang diberikan oleh tenaga kesehatan melalui suntikan gluteal IM, SC abdomen, atau IM paha pada orang dewasa tanpa HIV. Peserta yang diacak ke kontrol aktif menerima CAB200 pada rute pemberian dan volume atau dosis yang sesuai. Data kontrol aktif di semua kelompok (kecuali Kelompok 4b dan 4h, yang tidak memiliki kontrol aktif) digunakan untuk perbandingan keamanan dan tolerabilitas saja.
Studi ini terdiri dari periode penyaringan selama 30 hari; periode oral lead-in (OLI) selama 28 hari untuk menilai tolerabilitas sebelum injeksi LA, di mana semua peserta menerima CAB 30 mg sekali sehari (dengan pengambilan sampel PK yang jarang hingga hari ke-29); periode washout selama 7 hingga 14 hari (dimulai pada hari ke-29); dan fase injeksi, di mana injeksi gluteal IM, SC abdomen, dan IM paha dinilai. Fase injeksi diikuti oleh periode tindak lanjut selama 52 minggu untuk semua kelompok, termasuk peserta yang hanya menerima injeksi pertama. Penyelesaian studi didefinisikan sebagai penyelesaian kunjungan studi terjadwal selama fase tindak lanjut selama 52 minggu setelah injeksi terakhir atau hingga konsentrasi plasma CAB turun di bawah tingkat kuantifikasi sebelum minggu ke-52.
Untuk fase injeksi, peserta diacak ke dalam 8 kohort menggunakan teknologi respons interaktif (Randomization and Medication Ordering System Next Generation) (Tabel 1 dan Gambar 1 ). Secara singkat, dalam Kohort 1 hingga 4, peserta diacak 9:1 untuk menerima 2 injeksi IM atau SC CAB400-D yang diberikan dengan jarak 4 minggu (injeksi 1, CAB400-D 400 mg [1 mL] atau 600 mg [1,5 mL]; injeksi 2, CAB400-D 200 mg [0,5 mL] atau 400 mg [1 mL]) atau kontrol aktif (CAB200 yang disesuaikan untuk rute dan volume [injeksi SC] atau dosis [injeksi IM]). Ukuran sampel memungkinkan presisi statistik saat memperkirakan konsentrasi PK melalui menggunakan rata-rata geometrik.
Tabel 1. Rincian Kelompok yang Menerima Suntikan Obat yang Diselidiki
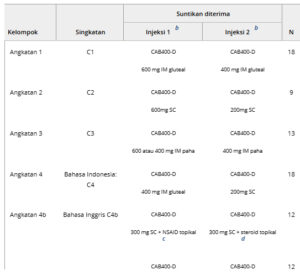
CAB200, cabotegravir 200 mg/mL; CAB400-D, cabotegravir 400 mg/mL; IM, intramuskular; NA, tidak berlaku; NSAID, obat antiinflamasi nonsteroid; rHuPH20, hialuronidase manusia rekombinan; SC, subkutan (abdomen).
a Peserta yang menerima kontrol aktif (CAB200) tidak disertakan.
b Suntikan 1 dan 2 diberikan dengan jarak 4 minggu.
c Diklofenak topikal 1% (2 g) atau diklofenak dietilamonium (23,2 mg/g) dua kali sehari.
d Betametason valerat 0,1% (1 g) sekali sehari.
e Kohort 5 dihentikan sebelum injeksi 2.
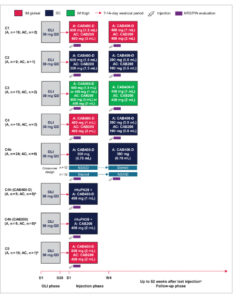
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Desain studi. A, aktif; AC, kontrol aktif; C, kohort; CAB, cabotegravir; CAB200, CAB 200 mg/mL; CAB400-D, CAB 400 mg/mL; D, hari; IM, intramuskular; NRS, skala penilaian numerik; OLI, oral lead-in; PIN, persepsi injeksi; PK, farmakokinetik; QD, sekali sehari; rHuPH20, hialuronidase manusia rekombinan; SC, subkutan (abdomen); W, minggu. a Untuk Kohort 4 jam, 1 injeksi SC dengan rHuPH20 5000 U diikuti oleh CAB400-D 400 mg (1 mL) atau CAB200 400 mg (2 mL). b Kohort 5 dihentikan sebelum injeksi 2. c Atau hingga CAB tidak lagi dapat diukur (jika ini terjadi sebelum minggu ke-52).
Pada Kelompok 4b, untuk mengevaluasi efek obat topikal pada ISR dan hasil kesehatan, peserta diacak dalam desain cross-over 2 × 2 untuk menerima 2 suntikan SC CAB400-D 300 mg (0,75 mL) yang diberikan dengan jarak 4 minggu dengan NSAID topikal dua kali sehari (2 g diklofenak topikal 1% atau diklofenak dietilamonium 23,2 mg/g) atau steroid topikal sekali sehari (1 g betametason valerat 0,1%). Kedua obat topikal diberikan mulai 1 hari sebelum hingga 5 hari setelah setiap suntikan, dengan plasebo yang sesuai berupa steroid topikal atau NSAID.
Pada Kohort 4h, peserta diacak 1:1 untuk menerima 5000 U rHuPH20 dengan 1 suntikan SC CAB400-D 400 mg (1 mL) atau CAB200 400 mg (2 mL); rHuPH20 dan CAB diberikan secara berurutan.
Pada Kohort 5, peserta diacak 20:2 untuk menerima 2 suntikan IM CAB400-D dengan jarak 12 minggu (suntikan 1, 800 mg [2 mL]; suntikan 2, hingga 1200 mg [3 mL]) atau kontrol aktif (CAB200 yang disesuaikan untuk rute dan volume).
Asetaminofen (≤2 g/hari) diizinkan kapan saja. Analgesik non-opioid, termasuk NSAID, dapat digunakan untuk profilaksis hingga 24 jam sebelum injeksi atau untuk mengobati ISR. Namun, pada Kelompok 4b, penggunaan NSAID oral harus dihindari. Obat pereda nyeri lainnya (misalnya, opioid dengan potensi rendah, seperti hidrokodon atau tramadol) didiskusikan oleh peneliti dan pemantau medis berdasarkan kasus per kasus.
Ini adalah studi multisenter yang dilakukan di 5 lokasi investigasi (PPD Development, Hassman Research Institute, dan Auckland Clinical Studies Ltd) di Amerika Serikat (Orlando, FL; Las Vegas, NV; Berlin, NJ; Austin, TX) dan Auckland, Selandia Baru, antara 31 Juli 2020 dan 5 Mei 2023. Studi ini ditinjau dan disetujui oleh komite etik independen/dewan peninjau kelembagaan Advarra (Columbia, MD) dan dilakukan sesuai dengan pedoman dan prinsip International Conference on Harmonisation Good Clinical Practice yang diuraikan dalam Deklarasi Helsinki. Persetujuan tertulis diperoleh dari semua partisipan sebelum dimulainya prosedur khusus studi. Uji klinis ini terdaftar sebagai NCT04484337 di ClinicalTrials.gov.
Peserta
Peserta yang memenuhi syarat adalah orang dewasa tanpa HIV, berusia 18-50 tahun, yang secara terbuka sehat sebagaimana ditentukan oleh evaluasi medis, dengan berat badan ≥40 kg dan indeks massa tubuh 18-32 kg/m 2 . Orang yang sedang hamil atau menyusui tidak dimasukkan dalam penelitian, dan peserta yang berpotensi melahirkan diharuskan untuk menggunakan metode kontrasepsi yang sangat efektif (tingkat kegagalan <1%). Peserta diharuskan untuk memiliki 2 tes negatif berturut-turut untuk SARS-CoV-2, yang dilakukan pada saat skrining dan dalam waktu 5 hari setelah memulai fase OLI. Kriteria eksklusi utama mencakup adanya atau riwayat gangguan kardiovaskular, pernapasan, hati, ginjal, gastrointestinal, endokrin, hematologi, atau neurologis. Orang dengan tekanan darah abnormal, alanine transaminase (ALT) atau kadar bilirubin >1,5 kali batas atas normal (ULN), atau gejala COVID-19 dalam waktu 14 hari setelah memulai fase OLI juga tidak dimasukkan dalam penelitian.
Titik Akhir dan Penilaian
Sampel plasma dianalisis untuk konsentrasi CAB menggunakan metode analitis tervalidasi berdasarkan presipitasi protein, diikuti oleh analisis menggunakan kromatografi cair kinerja tinggi–spektrometri massa tandem dengan rentang linier 1000 kali lipat dan batas bawah dan atas kuantifikasi masing-masing 0,025 dan 25 µg/mL. 19 , 24 , 25 Titik akhir farmakokinetik mencakup konsentrasi plasma maksimum yang teramati (Cmax ) , waktu hingga Cmax ( Tmax ) , area di bawah kurva konsentrasi-waktu (AUC) dari waktu nol hingga titik waktu terakhir yang dapat diukur (AUC 0-t ), AUC dari waktu nol hingga 4 minggu pascainjeksi (AUC 0-4 minggu ), konsentrasi plasma pada 4 minggu pascainjeksi (C wk4 ), dan waktu paruh fase terminal (T 1/2 ). Semua parameter PK dihitung untuk setiap injeksi kecuali T 1/2 , yang dihitung untuk injeksi akhir saja. Untuk membandingkan paparan di seluruh rute pemberian, rasio rata-rata geometrik (GMR) C minggu ke-4 , C maks , dan AUC 0-4 minggu dihitung antara suntikan dan kelompok dengan dosis yang sama. Untuk membandingkan paparan antara suntikan CAB400-D dan CAB200, GMR C minggu ke-4 untuk Kelompok 1 hingga 5 dibandingkan dengan data historis CAB200 dihitung.
Tingkat keparahan AE dinilai menggunakan tabel penilaian Divisi AIDS (versi 2.1 yang telah dikoreksi). Titik akhir keamanan meliputi penilaian tanda vital, uji laboratorium klinis, pemantauan kejadian buruk (AE) (termasuk ISR), dan kelainan biokimia hati.
Sampel PK fase injeksi dikumpulkan pada hari ke-1 (prainjeksi; 1, 2, dan 8 jam pascainjeksi), hari ke-2 (24 jam pascainjeksi), dan hari ke-3, 5 hingga 8, 10, 14, 17, dan 22 untuk injeksi 1 dan 2. Penilaian farmakokinetik dan keamanan dilakukan pada minggu ke-4, 8, 12, 20, 28, 36, 44, dan 52 setelah injeksi IM atau SC terakhir atau hingga konsentrasi plasma CAB berada di bawah level kuantifikasi.
Titik akhir yang dilaporkan peserta mencakup penilaian nyeri pascainjeksi dari waktu ke waktu, tingkat keparahan dan penerimaan nyeri dan ISR segera setelah injeksi, dan preferensi antara injeksi menggunakan obat topikal yang berbeda. Nyeri pascainjeksi dievaluasi menggunakan skala penilaian numerik (NRS) yang memberi peringkat nyeri dari 0 (tidak nyeri) hingga 10 (nyeri ekstrem). Tiga item dari kuesioner Persepsi Injeksi (PIN) digunakan untuk menilai gangguan karena nyeri selama injeksi dan penerimaan reaksi lokal dan nyeri. 26 Skala untuk item pada gangguan karena nyeri berkisar dari 1 (tidak sama sekali) hingga 5 (sangat), dan skala untuk 2 item pada penerimaan reaksi lokal dan nyeri berkisar dari 1 (sangat dapat diterima) hingga 5 (sama sekali tidak dapat diterima). Kuesioner digunakan untuk menilai preferensi injeksi peserta mengenai obat topikal dalam Kelompok 4b.
Analisis Statistik
Data diringkas menurut formulasi, kelompok, dan suntikan. Selain itu, data AE ISR diringkas menurut kelompok dosis gabungan, menggabungkan data dari suntikan dengan dosis dan rute yang sama. Parameter PK plasma diestimasikan melalui analisis nonkompartemen. Untuk analisis silang dalam Kelompok 4b yang mengevaluasi efek pengobatan topikal pada ISR, regresi logistik kondisional yang tepat digunakan untuk menganalisis hasil biner, menghasilkan rasio peluang yang disesuaikan dengan efek periode, dengan interval kepercayaan (CI) 95% dan nilai P yang tepat untuk efek pengobatan. Uji Mantel–Haenszel yang diperluas digunakan untuk menghasilkan nilai P yang tepat untuk uji preferensi yang dilaporkan peserta untuk suntikan dengan NSAID topikal versus steroid topikal, berdasarkan kuesioner preferensi. Tidak ada penyesuaian nilai P multiplisitas yang digunakan. Satu set analisis kasus lengkap digunakan untuk semua analisis silang, di mana peserta dengan nilai titik akhir yang hilang untuk suntikan 1 dan/atau suntikan 2 dikecualikan. Diasumsikan bahwa tidak ada interaksi langsung berdasarkan periode atau efek bawaan diferensial.
Populasi PK mencakup semua peserta dari populasi keamanan yang memiliki ≥1 penilaian PK yang tidak hilang (termasuk penilaian dengan nilai yang tidak dapat diukur). Populasi keamanan mencakup semua peserta yang menerima ≥1 dosis pengobatan studi (injeksi).
Pendaftaran dan Demografi Dasar
Di antara 281 peserta yang disaring, 138 orang terdaftar dan diberi dosis CAB oral 30 mg, 117 di antaranya menerima ≥1 suntikan. Di antara semua 138 peserta, usia rata-rata (SD) adalah 34,7 (9,4) tahun, indeks massa tubuh rata-rata (SD) adalah 26,2 (3,5) kg/m 2 , 59% (81/138) adalah laki-laki, 29% (40/138) adalah orang kulit hitam atau Afrika-Amerika, dan 43% (59/138) adalah orang kulit putih (Tabel S1 ). Etnis Hispanik atau Latin dilaporkan pada 27% (37/138) peserta. Karakteristik demografi tidak jauh berbeda antara kelompok dosis.
Hasil
Disposisi Peserta
Secara keseluruhan, 75% (103/138) peserta menyelesaikan pengobatan studi. Penarikan diri oleh peserta merupakan alasan paling umum untuk penarikan diri studi (21% [29/138]) dan penghentian pengobatan studi (17% [24/138]). Tidak ada peserta yang menarik diri dari studi karena AE, dan 4% (5/138) peserta menghentikan pengobatan karena AE. Tidak ada penghentian pengobatan studi yang terjadi di antara 8 peserta yang menerima kontrol aktif (yaitu, CAB200 pada rute pemberian dan volume atau dosis yang sesuai).
Meskipun 24 peserta terdaftar dalam Kelompok 5 dan menyelesaikan fase OLI, hanya 11 peserta yang menerima 1 suntikan gluteal IM baik CAB400-D 800 mg (2 mL) atau CAB200 400 mg (2 mL). Seperti yang ditetapkan oleh protokol, analisis awal data PK dan keamanan dilakukan setelah 50% peserta menerima suntikan pertama mereka. Data PK CAB400-D dari Kelompok 1 hingga 5 menunjukkan penyerapan yang lebih cepat dan waktu paruh yang lebih pendek dibandingkan dengan CAB200, yang menunjukkan bahwa dosis CAB400-D yang akan dibutuhkan setiap 3 bulan untuk menyamai paparan plasma CAB yang diamati dalam studi fase 3 CAB200 akan terlalu besar untuk dapat dipraktikkan. 12 – 14 Oleh karena itu, Kelompok 5 dihentikan. Peserta yang telah menerima suntikan pertama memasuki fase tindak lanjut tanpa menerima suntikan kedua.
Farmakokinetik
Konsentrasi Plasma CAB dari Waktu ke Waktu
Untuk CAB400-D, profil konsentrasi plasma rata-rata yang dinormalisasi dosis setelah injeksi 1 (Gambar 2A ) dan kemiringan terminal setelah injeksi akhir (Gambar 2B ) serupa di seluruh rute pemberian dan dosis. Profil farmakokinetik berbeda antara kelompok dengan dan tanpa rHuPH20 yang diberikan bersamaan (Gambar 2C ). Injeksi SC CAB400-D dengan rHuPH20 pada Kelompok 4h memiliki Cmax yang lebih tinggi dan penurunan konsentrasi yang lebih cepat dibandingkan dengan injeksi SC CAB400-D tanpa rHuPH20 pada Kelompok 2 dan 4b dan injeksi SC CAB200 dengan rHuPH20 pada Kelompok 4h. Gambar S1 dan S2 menunjukkan profil konsentrasi plasma CAB rata-rata–waktu menurut kelompok.

Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Profil konsentrasi plasma rata-rata–waktu setelah (A) injeksi pertama CAB400-D, (B) injeksi akhir CAB400-D, dan (C) injeksi pertama SC CAB200 dan CAB400-D dengan dan tanpa rHuPH20 yang diberikan bersamaan. Garis putus-putus menunjukkan LLQ sebesar 0,025 µg/mL. Konsentrasi di bawah LLQ diperhitungkan sebagai 0 untuk menghitung statistik ringkasan. Injeksi akhir setara dengan injeksi 2 untuk semua kelompok kecuali C5, yang hanya memiliki 1 injeksi. C, kelompok; CAB, cabotegravir; CAB200, CAB 200 mg/mL; CAB400-D, CAB 400 mg/mL; IM, intramuskular; LLQ, batas bawah kuantifikasi; PK, farmakokinetik; rHuPH20, hialuronidase manusia rekombinan; SC, subkutan (abdomen).
Parameter PK Plasma yang Diturunkan
Nilai Cmax 1 injeksi yang dinormalkan dosis , AUC 0-4 minggu , dan C wk4 serupa setelah injeksi gluteal IM, SC (tanpa rHuPH20), dan paha IM CAB400-D (semua kelompok kecuali Kelompok 4 jam), meskipun C wk4 yang dinormalkan dosis setelah injeksi paha IM sedikit lebih rendah daripada injeksi gluteal IM dan SC (Tabel 2 ). Dibandingkan dengan injeksi SC CAB400-D saja, pemberian CAB400-D bersamaan dengan rHuPH20 menghasilkan Cmax , AUC 0-t , dan AUC 0-4 minggu yang dinormalkan dosis yang lebih tinggi ; T 1/2 yang lebih pendek; dan C wk4 yang dinormalkan dosis yang serupa . Koefisien variasi geometrik (%CVb) Cmax , AUC 0-t , dan AUC 0-4 minggu setelah injeksi SC CAB400-D lebih rendah dengan rHuPH20 (Kohort 4 jam) dibandingkan tanpa rHuPH20 (Kohort 2 dan 4b).
Tabel 2. Ringkasan Parameter PK Plasma yang Diperoleh Berdasarkan Kelompok: Suntikan 1 (Populasi PK)
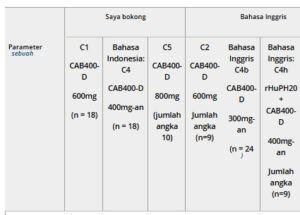
AUC, area di bawah kurva konsentrasi-waktu; AUC 0-4 minggu , AUC dari waktu nol hingga 4 minggu pascainjeksi; AUC 0-t , AUC dari waktu nol hingga titik waktu terakhir yang dapat diukur; C, kohort; CAB200, cabotegravir 200 mg/mL; CAB400-D, cabotegravir 400 mg/mL; Cmax , konsentrasi plasma maksimum yang teramati; %CVb, koefisien variasi geometrik; C wk4 , konsentrasi plasma pada 4 minggu pascainjeksi; D, dosis; IM, intramuskular; LA, kerja lama; n, jumlah partisipan dengan data yang dapat dievaluasi; NSAID, obat antiinflamasi nonsteroid; PK, farmakokinetik; rHuPH20, hialuronidase manusia rekombinan; SC, subkutan (abdomen); SD, deviasi standar; T 1/2 , waktu paruh fase terminal; Tmax , waktu hingga Cmax .
a Semua nilai ditampilkan sebagai rata-rata geometrik (%CVb) [rata-rata aritmatika (SD)] kecuali untuk T maks . Untuk semua nilai yang dinormalisasi dosis, %CVb tidak ditampilkan karena identik dengan %CVb dari nilai asli sebelum normalisasi dosis.
b Kohort 4b mencakup data gabungan dari peserta yang diberikan CAB400-D dengan penggunaan NSAID topikal atau steroid.
c Termasuk parameter PK plasma meningkat sebesar 50% untuk 2 peserta yang menerima CAB400-D 400 mg untuk injeksi 1.
Di seluruh kelompok tanpa rHuPH20, nilai rata-rata geometrik T 1/2 berkisar antara 14 hingga 26 hari (Tabel 2 dan 3 ). Rata-rata geometrik T 1/2 adalah 22 hari untuk SC (n = 46 dari Kelompok 2, 4, dan 4b), 19 hari untuk gluteal IM (n = 25 dari Kelompok 1 dan 5), dan 16 hari untuk suntikan paha IM (n = 10, hanya Kelompok 3). Untuk suntikan SC CAB400-D, T 1/2 adalah 61% lebih pendek dengan daripada tanpa rHuPH20. Rata-rata geometrik T 1/2 untuk SC CAB200 dengan rHuPH20 (51 hari) serupa dengan nilai dalam studi gluteal IM CAB200 historis tanpa rHuPH20 (25-60 hari). 17 , 19 , 21
Tabel 3. Ringkasan Parameter PK Plasma yang Diperoleh Berdasarkan Kelompok: Suntikan 2 (Populasi PK)
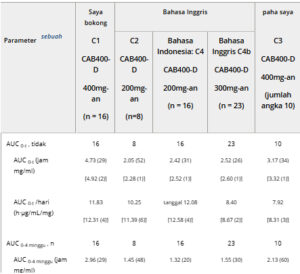
AUC, area di bawah kurva konsentrasi-waktu; AUC 0-4 minggu , AUC dari waktu nol hingga 4 minggu pascainjeksi; AUC 0-t , AUC dari waktu nol hingga titik waktu terakhir yang dapat diukur; C, kohort; CAB200, cabotegravir 200 mg/mL; CAB400-D, cabotegravir 400 mg/mL; Cmax , konsentrasi plasma maksimum yang teramati; %CVb, koefisien variasi geometrik; C wk4 , konsentrasi plasma pada 4 minggu pascainjeksi; D, dosis; IM, intramuskular; LA, kerja lama; n, jumlah partisipan dengan data yang dapat dievaluasi; PK, farmakokinetik; SC, subkutan (abdomen); SD, deviasi standar; T 1/2 , waktu paruh fase terminal; Tmax , waktu hingga Cmax .
a Semua nilai ditampilkan sebagai rata-rata geometrik (%CVb) [rata-rata aritmatika (SD)] kecuali untuk T maks . Untuk semua nilai yang dinormalisasi dosis, %CVb tidak ditampilkan karena identik dengan %CVb dari nilai asli sebelum normalisasi dosis.
Perbandingan Paparan CAB pada Berbagai Rute Pemberian
Secara keseluruhan, paparan CAB dalam 4 minggu setelah injeksi 1 CAB400-D tanpa rHuPH20 secara umum sebanding di seluruh rute menggunakan dosis yang sama (Tabel 4 ). Sebagian besar GMR mendekati 1, dengan nilai 90% CI inklusif kesatuan. Pengecualian dengan GMR <1 adalah C wk4 SC versus IM gluteal dan IM paha versus IM gluteal, yang konsisten dengan C wk4 dosis-normal yang lebih rendah yang diamati untuk IM paha versus IM gluteal dan SC (Tabel 2 ). Setelah injeksi 2 CAB400-D 400 mg, AUC 0-4 minggu dan C max secara umum sebanding antara injeksi IM paha dan gluteal; C wk4 lebih rendah untuk injeksi IM paha dibandingkan gluteal, konsisten dengan GMR dari CAB400-D 600-mg IM paha dibandingkan gluteal pertama dan C wk4 dosis-normal yang lebih rendah yang diamati selama injeksi 2 untuk injeksi IM paha dibandingkan gluteal (Tabel 3 ). Paparan setelah injeksi SC 2 tidak dapat dibandingkan dengan injeksi IM gluteal atau paha karena normalisasi dosis tidak dapat diterapkan pada injeksi kedua saja. Setelah injeksi CAB400-D 400-mg SC 1 yang diberikan bersamaan dengan rHuPH20, AUC 0-4 minggu dan C max lebih tinggi dibandingkan injeksi CAB400-D 400-mg IM gluteal 1 (Tabel 4 ).
Tabel 4. Perbandingan Paparan CAB Setelah Suntikan CAB400-D di Berbagai Rute Pemberian
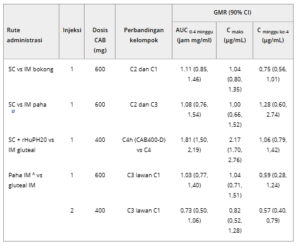
AUC, area di bawah kurva konsentrasi-waktu; AUC 0-4 minggu , AUC dari waktu nol hingga 4 minggu pascainjeksi; C, kohort; CAB, cabotegravir; CAB400-D, CAB 400 mg/mL; CI, interval kepercayaan; Cmax , konsentrasi plasma maksimum yang teramati; Cwk4 , konsentrasi plasma pada 4 minggu pascainjeksi; GMR, rasio rata-rata kuadrat terkecil geometris; IM, intramuskular; PK, farmakokinetik; rHuPH20, hialuronidase manusia rekombinan; SC, subkutan (abdomen).
Analisis varians dengan perlakuan sebagai efek tetap dan dengan mempertimbangkan varians yang tidak sama untuk setiap kelompok perlakuan dilakukan pada parameter alami yang ditransformasikan ln AUC 0-4 minggu , C max , dan C wk4 .
a Termasuk parameter PK plasma meningkat sebesar 50% untuk 2 peserta yang menerima CAB400-D 400 mg untuk injeksi 1.
Perbandingan Data Historis C wk4 versus CAB200
Data historis untuk CAB200 didasarkan pada hasil dari studi gabungan ATLAS/FLAIR dari suntikan gluteal IM bulanan (suntikan 1, CAB200 600 mg; suntikan 2, CAB200 400 mg). 27 Secara keseluruhan, suntikan gluteal IM CAB400-D 1 dan 2, dan suntikan SC 1 dengan atau tanpa rHuPH20, memiliki C wk4 yang lebih tinggi daripada suntikan gluteal IM CAB200 yang dosisnya disesuaikan (atau dosisnya dinormalisasi) dalam studi historis (Tabel 5 ). Untuk suntikan paha IM CAB400-D 1 dan 2 dan suntikan CAB200 SC dengan rHuPH20, C wk4 sebanding dengan C wk4 yang diamati dengan suntikan gluteal IM CAB200 (Tabel 5 ).
Tabel 5. Perbandingan C wk4 Setelah Suntikan 1 dan 2 versus Data Historis CAB200 a
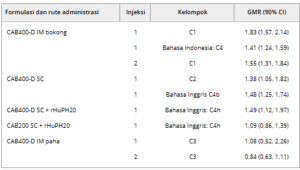
C, kohort; CAB200, cabotegravir 200 mg/mL; CAB400-D, cabotegravir 400 mg/mL; CI, interval kepercayaan; C wk4 , konsentrasi plasma 4 minggu pascainjeksi; GMR, rasio rata-rata kuadrat terkecil geometris; IM, intramuskular; rHuPH20, hialuronidase manusia rekombinan; SC, subkutan (abdomen).
Analisis varians dengan perlakuan sebagai efek tetap dan dengan penyisihan varians yang tidak sama untuk setiap kelompok perlakuan dilakukan pada C wk4 alami yang ditransformasikan menjadi ln .
Suntikan 1 sebanyak 600 mg (n = 501) dan suntikan 2 sebanyak 400 mg (n = 495), keduanya merupakan suntikan gluteal IM CAB200 dari ATLAS/FLAIR dan dosisnya dinormalisasi agar sesuai dengan dosis di setiap kelompok.
Proporsionalitas Dosis Setelah Injeksi 1 CAB400-D
Di seluruh kelompok yang dinilai untuk gluteal IM (400-800 mg) dan SC tanpa rHuPH20 (300-600 mg), AUC 0-4 minggu , Cmax , dan Cwk4 yang diamati umumnya meningkat secara proporsional dengan dosis (Tabel S2 ). Kemiringan yang diperkirakan dari regresi linier paparan-dosis yang ditransformasikan secara logaritma umumnya mendekati 1.
Keamanan
Kejadian Tidak Diinginkan pada Populasi Keamanan yang Menerima ≥1 Suntikan (n = 117)
AE terkait obat dilaporkan untuk hampir semua peserta (116/117; termasuk peserta CAB200 yang digabungkan). AE non-ISR terkait obat yang paling umum adalah sakit kepala (15% [n = 26 kejadian]), pireksia (9% [n = 16 kejadian]), dan mialgia (5% [n = 8 kejadian]) di semua kelompok CAB400-D (n = 101 peserta; n = 174 suntikan). Secara keseluruhan, 4% (5/117) peserta menghentikan pengobatan studi karena ≥1 AE, termasuk 1 penghentian karena nyeri orofaringeal; 1 karena peningkatan enzim hati, yang tidak memenuhi kriteria penghentian hati yang ditentukan protokol (yaitu, ALT ≥3 kali ULN); dan 3 karena ISR (eritema di tempat suntikan [n = 1]; eritema dan pengerasan di tempat suntikan [n = 1]; nyeri di tempat suntikan, eritema, dan pembengkakan [n = 1]). Tidak ada kematian yang diamati dan 3% (3/117) peserta mengalami AE serius, yang semuanya terjadi pada periode tindak lanjut dan tidak ada yang terkait dengan obat.
Satu peserta masing-masing dari Kelompok 3 dan Kelompok 4h memenuhi kriteria penghentian hati yang ditentukan protokol selama fase tindak lanjut. Peserta dari Kelompok 3 (CAB400-D IM paha), yang memiliki riwayat perlemakan hati dan indeks massa tubuh tinggi, mengalami peningkatan enzim hati (tingkat 1; ALT dan aspartat aminotransferase [AST] >2 kali ULN) yang tercatat 4 minggu setelah injeksi 2, yang kemudian mencapai tingkat 2 (ALT 3,1 kali ULN) pada 51 hari setelah injeksi 2. Meskipun kriteria internasional untuk cedera hati akibat obat (DILI) 28 tidak terpenuhi dan tidak ada cedera hepatoseluler yang dilaporkan, peran kausal CAB tidak dapat dikesampingkan. Oleh karena itu, kejadian tersebut diputuskan oleh komite keputusan hati sebagai kemungkinan DILI. Pemeriksaan hati menyeluruh, termasuk uji serologis untuk hepatitis virus akut, dilakukan, tanpa etiologi definitif yang diidentifikasi. Meskipun ALT kemudian menurun, baik ALT maupun AST tetap meningkat (tingkat 1) pada kunjungan studi terakhir. Partisipan dari Kohort 4h (CAB400-D SC + rHuPH20) mengalami cedera hepatoseluler (ALT 7,3 kali ULN [tingkat 3]; AST 4 kali ULN [tingkat 2]) pada fase tindak lanjut, 85 hari setelah injeksi tunggal. Peneliti menganggap hal ini tidak terkait dengan pengobatan studi dan kejadian tersebut teratasi dalam 58 hari. Secara keseluruhan, tidak ada perubahan relevan lainnya dari awal dalam evaluasi laboratorium klinis atau tanda-tanda vital yang diamati dalam studi ini.
AE yang paling sering dilaporkan secara keseluruhan adalah ISR, dengan 99% (116/117) peserta mengalami ≥1 ISR. Sebagian besar ISR adalah tingkat ≤2 (Tabel S3 dan S4 ). Hanya 9% (17/197) suntikan yang mengakibatkan ISR tingkat 3; sebagian besar adalah kemerahan/eritema di tempat suntikan (8% [15/197]) dan/atau pembengkakan/indurasi di tempat suntikan (1% [2/197]; Gambar S3 ) dan tidak ada yang dilaporkan dalam kelompok kontrol aktif. Di seluruh kelompok, median durasi ISR berkisar antara 7 hingga 13 hari, dan median waktu hingga timbulnya berkisar antara 1 hingga 4 hari. Tidak ada ISR yang serius atau tingkat 4. Secara umum, lebih banyak pembengkakan/indurasi di tempat suntikan, kemerahan/eritema, dan ISR nodul yang diamati setelah suntikan CAB400-D SC dibandingkan suntikan IM (Gambar S3 ). Pada Kelompok 4b, tidak ditemukan perbedaan bermakna secara statistik antara pemberian bersamaan dengan steroid topikal dibandingkan dengan NSAID topikal dalam kejadian kejadian ISR tingkat ≥1 atau ≥2, dengan durasi >7 hari, atau dengan durasi tingkat ≥2 selama >7 hari (Tabel S5 ).
Hasil yang Dilaporkan Peserta
Skala Penilaian Numerik
Skor NRS median umumnya mencapai puncaknya pada hari ke-5 pascainjeksi di seluruh kelompok dan tidak melebihi 5 pada hari studi mana pun. Skor NRS median yang lebih tinggi diamati dengan suntikan IM di paha dibandingkan dengan rute/lokasi pemberian lainnya (Gambar S4 ).
Persepsi Injeksi
Sebagian besar peserta di semua kelompok sama sekali tidak atau sedikit terganggu oleh rasa sakit selama penyuntikan (kisaran, 60%-100%; Gambar S5 ). Di semua kelompok, tidak ada pola khusus yang diamati untuk persentase peserta yang menganggap reaksi lokal dapat diterima sepenuhnya atau sangat dapat diterima (kisaran, 22%-100%) atau rasa sakit dapat diterima sepenuhnya atau sangat dapat diterima (kisaran 20%-81%; Gambar S5 ).
Dari partisipan dalam Kelompok 4b yang menjawab preferensi keseluruhan untuk injeksi SC dengan pemberian bersamaan steroid topikal atau NSAID terkait nyeri dan pembengkakan yang mengganggu (selama dan setelah injeksi), preferensinya sebanding ( P = 1,00), dengan 50% (11/22) lebih memilih injeksi dengan NSAID topikal, 41% (9/22) lebih memilih injeksi dengan steroid topikal, dan 9% (2/22) tidak memiliki preferensi.
Diskusi
Formulasi suspensi CAB konsentrasi tinggi (CAB400-D) dikembangkan untuk memungkinkan pemberian dosis yang lebih jarang dibandingkan dengan formulasi CAB200 saat ini dan untuk mendukung pemberian sendiri melalui suntikan SC abdomen atau IM paha. Secara keseluruhan, penyerapan CAB400-D lebih cepat daripada penyerapan CAB200. Paparan plasma CAB dalam waktu 4 minggu setelah suntikan CAB400-D serupa di seluruh rute pemberian dan lebih tinggi daripada suntikan CAB200. Penyerapan SC CAB400-D lebih cepat dengan versus tanpa rHuPH20, sedangkan penyerapan SC CAB200 secara umum serupa dengan atau tanpa rHuPH20. Profil keamanan suntikan CAB400-D secara umum sebanding dengan formulasi CAB200 yang disetujui, dengan nyeri yang dilaporkan peserta yang dapat diterima dengan suntikan. 12 – 14 , 18 , 19 Namun, data PK tidak mendukung potensi interval pemberian dosis yang lebih lama dengan CAB400-D versus CAB200. Oleh karena itu, formulasi CAB alternatif telah dikembangkan dan saat ini sedang dalam evaluasi klinis untuk menyediakan interval dosis yang lebih lama. 29
Studi ini menunjukkan bahwa penyerapan CAB400-D lebih cepat daripada penyerapan CAB200, dengan T 1/2 yang lebih pendek dengan suntikan gluteal IM CAB400-D (19 hari) dibandingkan dengan CAB200 (25-60 hari) karena kinetika penyerapan yang terbatas. 17 , 19 , 21 Akibatnya, dosis CAB400-D yang tidak praktis secara klinis yang diberikan setidaknya setiap 3 bulan akan diperlukan untuk menyamai paparan plasma CAB yang diamati dalam studi fase 3 CAB200. Namun, untuk interval pemberian dosis 1 bulan, penyerapan CAB400-D yang lebih cepat menyebabkan konsentrasi palung (C wk4 ) yang lebih tinggi atau mirip dengan C wk4 yang diamati setelah suntikan gluteal IM CAB200 1 dalam studi ATLAS/FLAIR historis (Tabel 5 ), 27 menunjukkan potensi penggunaan CAB400-D untuk pemberian sendiri setiap bulan. CAB400-D yang diberikan sendiri dapat memberikan individu kontrol yang lebih besar atas pengobatan dan pencegahan HIV-1, yang berpotensi memberikan kemudahan yang lebih besar dan kepatuhan yang lebih baik, hasil klinis, kepuasan, dan penerimaan. Mekanisme untuk penyerapan CAB400-D yang lebih cepat tidak jelas tetapi mungkin melibatkan konsentrasi CAB yang berbeda (400 vs 200 mg/mL) dan eksipien dalam formulasi.
Penyerapan CAB400-D setelah injeksi SC lebih cepat dengan rHuPH20, seperti yang ditunjukkan oleh Cmax yang lebih tinggi , AUC 0-4 minggu yang lebih tinggi , dan T 1/2 yang lebih pendek . Oleh karena itu, meskipun volume injeksi yang lebih tinggi diizinkan oleh pemberian bersama dengan rHuPH20, volume injeksi CAB400-D yang diprediksi diperlukan untuk mencapai interval pemberian dosis yang lebih panjang masih belum dapat dicapai. Variabilitas antar individu (IIV) dalam PK CAB setelah injeksi SC tampak lebih kecil dengan rHuPH20 (%CVb berkisar antara 15%-18%) dibandingkan tanpa (%CVb berkisar antara 30%-40%). Laju penyerapan yang dipercepat dan IIV yang berkurang oleh pemberian bersama dengan rHuPH20 telah diamati dalam penelitian obat lain 30 , 31 ; namun, mekanismenya tidak jelas, dan sebagian besar obat yang dipelajari dengan rHuPH20 adalah antibodi monoklonal, sedangkan CAB adalah molekul kecil.
Penyerapan CAB dengan rHuPH20 tampak berbeda untuk CAB200. Untuk injeksi CAB200 SC, hanya penyerapan obat awal (sebelum memasuki fase terminal) yang lebih cepat dengan dibandingkan tanpa rHuPH20, karena Cmax 2,5 µg/mL setelah injeksi SC CAB200 400 mg (Kohort 4 jam) lebih tinggi daripada Cmax yang diamati dalam studi CAB200 historis setelah normalisasi dosis. Namun, fase terminal serupa dengan dan tanpa rHuPH20 (masing-masing T 1/2 , 51 dan 25-60 hari). 17 , 19 , 21
Meskipun terdapat kesamaan paparan plasma CAB dalam waktu 4 minggu setelah injeksi CAB400-D di berbagai rute pemberian, rerata geometrik T 1/2 berdasarkan data gabungan adalah 22 hari untuk SC, 19 hari untuk gluteal IM, dan 16 hari untuk injeksi paha IM, yang menunjukkan bahwa analisis kuantitatif lebih lanjut seperti analisis PK populasi mungkin diperlukan untuk meningkatkan perbandingan sifat PK secara keseluruhan di seluruh rute pemberian. Hasil ini konsisten dengan studi PK populasi yang mengamati tingkat penyerapan LA yang lebih cepat dari CAB200 dengan injeksi paha IM versus gluteal IM. 32 Satu hipotesis untuk temuan ini adalah bahwa vaskularitas yang lebih tinggi dapat menyebabkan penyerapan yang lebih cepat. Otot paha memiliki vaskularitas tertinggi dari 3 tempat, diikuti oleh otot gluteal, kemudian lemak SC; oleh karena itu, vaskularitas otot paha yang lebih tinggi mungkin dapat menyebabkan penyerapan CAB400-D menjadi lebih cepat dengan injeksi paha IM versus gluteal IM. 33 Selain itu, suntikan yang dimaksudkan untuk diberikan secara intramuskular sering kali diberikan sebagian secara subkutan atau bocor ke lemak SC dari depot otot, yang memperlambat penyerapan. 34 – 39 Karena paha memiliki lapisan lemak SC yang lebih tipis daripada bokong, porsi yang lebih kecil dari suntikan paha IM diharapkan secara tidak sengaja diberikan secara subkutan dibandingkan dengan suntikan gluteal IM, yang dapat berkontribusi pada tingkat penyerapan yang berpotensi lebih cepat dengan paha IM dibandingkan suntikan gluteal IM. Nilai PK CAB400-D diharapkan tetap sama dengan atau tanpa RPV, karena tidak ada interaksi obat-obat yang diharapkan antara CAB dan RPV, dan suntikan diberikan di tempat yang berbeda pada tubuh. 21 , 40
Pola AE terkait obat yang diamati dengan CAB400-D, termasuk ISR, konsisten dengan studi CAB200 lainnya, 9 , 12 – 14 , 18 , 27 , 41 dan ISR lebih sering diamati setelah suntikan SC dibandingkan IM. Tidak ada perbedaan signifikan dalam ISR yang diamati antara suntikan SC dengan steroid topikal atau NSAID, yang disertakan untuk menilai potensi efeknya pada tingkat keparahan atau durasi ISR. Secara keseluruhan, tidak ada sinyal keamanan baru yang diidentifikasi dengan CAB400-D dibandingkan dengan data CAB200 historis. 9 , 12 – 14 , 18 , 27
Peserta menilai persepsi mereka tentang nyeri pascainjeksi (NRS) rendah di seluruh kelompok, dengan tingkat nyeri tertinggi umumnya terjadi 5 hari setelah injeksi (Gambar S4 ). Pada skala 0 hingga 10, skor NRS median tidak melebihi 5 pada hari ke-1, 2, 5, atau 8 di seluruh kelompok/rute pemberian. Secara keseluruhan, peserta merasa ISR dapat diterima secara umum di seluruh dosis dan rute (Gambar S5 ), temuan yang konsisten dengan hasil yang dilaporkan oleh peserta dari data CAB200 historis. 9 , 12 – 14 , 16 , 18 , 27 , 42
Beberapa aspek dari penelitian ini membatasi berbagai penilaian PK. Misalnya, karena tingkat dosis yang tidak konsisten di seluruh kelompok, membandingkan paparan CAB di seluruh rute pemberian merupakan tantangan: paparan CAB setelah injeksi SC 2 tidak dapat dibandingkan dengan injeksi gluteal IM atau paha IM karena normalisasi dosis tidak dapat diterapkan pada injeksi 2 saja. Karena kurangnya nilai AUC yang diturunkan dari waktu nol hingga tak terhingga (AUC 0-inf ), bioavailabilitas relatif di seluruh rute pemberian tidak dapat dinilai, dan proporsionalitas dosis tidak dapat dinilai untuk AUC 0-inf . Kisaran demografi dan ukuran sampel yang terbatas mencegah penilaian hubungan antara penyerapan CAB400-D dan faktor intrinsik dan ekstrinsik. Selain itu, proporsionalitas dosis injeksi paha IM tidak dapat dinilai karena terbatasnya jumlah tingkat dosis yang diuji. Keterbatasan terkait PK ini dapat diatasi dengan menggunakan analisis PK populasi.
Terdapat keterbatasan lain yang tidak terkait PK. Analisis silang kohort 4b kurang kuat karena ukuran sampel yang kecil, yang membatasi kemampuan untuk mendeteksi efek yang signifikan secara statistik kecuali jika perbedaan sebenarnya antara pengobatan topikal cukup besar. Selain itu, penggunaan analgesik lain yang diizinkan selama penelitian mungkin telah mengurangi kemampuan untuk mengamati manfaat tambahan dari pengobatan steroid topikal dan NSAID topikal yang diberikan pada nyeri terkait ISR. Terakhir, kurangnya kelompok kontrol plasebo mencegah evaluasi efektivitas suntikan dengan atau tanpa steroid topikal/NSAID.
Kesimpulan
Studi ini menunjukkan bahwa data PK CAB400-D tidak mendukung interval pemberian dosis lebih lama dari sekali setiap 2 bulan. Keamanan dan tolerabilitas CAB400-D dapat diterima dan serupa dengan data historis CAB200, yang mendukung penyelidikan lebih lanjut tentang formulasi CAB baru yang diberikan di lokasi suntikan gluteal IM, abdomen SC, dan paha IM. Formulasi CAB baru yang dapat diberikan lebih jarang (misalnya, setiap 4 bulan atau lebih) atau memungkinkan pemberian sendiri saat ini sedang dalam pengembangan klinis.

