
Abstrak
Eksosom yang mikroskopis namun kuat, memimpin terobosan revolusioner di bidang penyakit ginjal. Vesikel yang tertutup membran ini, dengan diameter berkisar antara 30 hingga 150 nm, membawa muatan seperti protein, lipid, dan asam nukleat, yang berfungsi sebagai jembatan informasi antara sel dalam keadaan sehat dan sakit. Baru-baru ini, kemajuan signifikan telah dicapai dalam memahami peran penting eksosom dalam menguraikan penyakit ginjal, memberikan perspektif baru tentang mekanisme penyakit, diagnosis, pemantauan, prognosis, dan pengobatan. Berbagai macam sumber eksosom, biokompatibilitasnya, stabilitasnya yang luar biasa, serta kemampuan penyimpanan dan pengangkutannya yang mudah, menjadikannya bintang yang sedang naik daun di bidang diagnostik penyakit ginjal. Potensi diagnostik yang sangat besar yang terkandung dalam struktur kecil ini muncul dengan cepat, khususnya dalam pengembangan teknik berbasis biopsi cair. Artikel ini memberikan gambaran umum yang komprehensif tentang fungsi biologis eksosom dalam penyakit ginjal, yang menyoroti potensinya sebagai penanda diagnostik utama. Lebih jauh, artikel ini mengeksplorasi potensi aplikasi eksosom dalam pemberian terapi, yang membuka jalan bagi strategi pengobatan yang inovatif. Akhirnya, kami melihat sekilas prospek penelitian masa depan di bidang ini, dengan keyakinan bahwa dengan kemajuan teknologi terkait eksosom yang berkelanjutan, diagnostik penyakit ginjal akan menjadi lebih tepat dan efisien, sehingga membawa harapan bagi pasien. Eksosom mendorong diagnostik penyakit ginjal ke era baru.
Singkatan
ACR
penolakan seluler akut
Bahasa Indonesia: ABMR
penolakan yang dimediasi antibodi
AKI
cedera ginjal akut
AUC
area di bawah kurva
aPLA2Rab
antibodi anti-PLA2R
AMR
penolakan yang dimediasi antibodi
GP 1 AZ
glikoprotein-alfa-2-seng
SANGGUL
nitrogen urea darah
Kamera
penolakan aktif kronis yang dimediasi antibodi
Penyakit Ginjal Kronis (PGK)
penyakit ginjal kronis
lingkaran RNA
RNA melingkar
ccRCC
sel bening RCC
Bahasa Indonesia: CAIX
karbonat anhidrase IX
TENANG1
kalmodulin-1
DGF
fungsi cangkok tertunda
Tanggal
nefropati diabetik
eLFG
mengevaluasi laju filtrasi glomerulus
EGF
faktor pertumbuhan epidermis
Bahasa Indonesia: EGFR
reseptor faktor pertumbuhan epidermal
EC
sel endotel
Penyakit Menular Seksual (ESRD)
penyakit ginjal stadium akhir
Kendaraan Listrik
vesikel ekstraseluler
Eksosik
chip mikrofluida saluran berkelok-kelok tak beraturan
FSGS
glomerulosklerosis segmental fokal
GEC (Global Ecological Commission) adalah lembaga nirlaba yang dibentuk oleh para petinggi GEC untuk mendistribusikan informasi dan data kepada masyarakat.
sel endotel glomerulus
HG
glukosa tinggi
Bahasa Indonesia: IgAN
Nefropati imunoglobulin A
Kendaraan Bermotor Listrik (ILV)
vesikel intraluminal
IMN
nefropati membranosa idiopatik
Bahasa Indonesia: ISEG
Masyarakat Internasional untuk Vesikel Ekstraseluler
KRT
terapi penggantian ginjal
LN
nefritis lupus
LNIV-CC
Pasien LNIV dengan bulan sabit seluler bersamaan
MCD
penyakit perubahan minimal
Bahasa Indonesia:
RNA pembawa pesan
RNA kecil
mikroRNA
Bahasa Inggris: MSC
sel induk mesenkimal
MVB (Mobil Vanguard Bermotor)
badan multivesikular
MNWB
buah naga magnetik
M N
nefropati membranosa
MUC3A
musin 3A
Bahasa Indonesia: NGALE
lipokalin yang terkait dengan gelatinase neutrofil
PON 1
paraoksonase 1
PLA2R
reseptor fosfolipase A2
Gereja Katolik Roma
karsinoma sel ginjal
DETIK
kromatografi pengecualian ukuran
SKR
kreatinin serum
Penyakit Lupus
lupus eritematosus sistemik
SMN
nefropati membranosa sekunder
TEC (Teknologi Informasi dan Komunikasi)
sel epitel tubulus
TCMR
Penolakan yang dimediasi sel T
Universitas Negeri Amerika
asam urat
Bahasa Indonesia: UF
ultrafiltrasi
tidak berkhasiat
lipokalin yang terkait dengan gelatinase neutrofil
Pernyataan Dampak Translasi
Eksosom, sebagai biomarker yang menjanjikan di bidang biopsi cair, dapat diterapkan dalam diagnosis dini, prediksi tingkat risiko penyakit, dan identifikasi penyebab potensial yang lebih akurat. Eksosom dapat memandu klasifikasi kasus, memungkinkan intervensi tepat waktu, penyesuaian rencana perawatan, dan memperlambat perkembangan penyakit. Artikel ini mengulas aplikasi spesifik eksosom di bidang penyakit ginjal dalam beberapa tahun terakhir, terutama dalam diagnosis, yang bertujuan untuk memberikan perspektif komprehensif untuk biomarker diagnostik klinis.
1. PENDAHULUAN
Penyakit ginjal mencakup spektrum kondisi termasuk penyakit ginjal kronis, akut, dan stadium akhir (ESRD), yang mempengaruhi sekitar lebih dari 10% dari populasi global. 1 , 2 Saat ini, tidak ada perawatan efektif yang tersedia untuk ESRD, terutama mengandalkan terapi penggantian ginjal (KRT). Setiap tahun, jutaan orang di seluruh dunia meninggal karena gagal ginjal karena tidak tersedianya KRT, 3 dan bahkan di lingkungan perawatan kesehatan yang kaya sumber daya, angka kematian di antara pasien yang menerima KRT berikutnya berkisar antara 50% hingga 80%. 4 Hal ini menimbulkan ancaman yang signifikan terhadap kesehatan manusia sambil memberikan beban berat pada ekonomi perawatan kesehatan global. Untuk memajukan pemantauan populasi pasien dengan penyakit ginjal, ada kebutuhan mendesak untuk pengembangan biomarker yang sensitif dan spesifik.
Eksosom adalah vesikel ekstraseluler (EV) skala nano, yang komposisinya bergantung pada sel asal dan statusnya saat ini, yang dimuat dengan konten termasuk protein, lipid, dan asam nukleat. 5 Dengan demikian, komponen aktif biologis ini mempertahankan karakteristik sel yang mengeluarkan dan dapat menimbulkan beragam fungsi spesifik sel dengan memediasi komunikasi antara sel atau jaringan. Eksosom terdapat secara luas dalam cairan biologis, membuatnya mudah diakses dan nyaman untuk pengumpulan non-invasif. 6 , 7 Heterogenitas dan stabilitas tinggi eksosom, bersama dengan perannya dalam komunikasi antar sel, memberi mereka potensi luar biasa untuk mengatur tingkat ekspresi molekul tertentu dan memicu respons fisiologis tertentu. Hal ini telah memicu minat yang signifikan dalam memanfaatkan eksosom untuk tujuan diagnostik, prognostik, dan terapeutik. 8 – 12 Lebih jauh lagi, penelitian telah menunjukkan bahwa biomarker ini mungkin lebih sensitif dalam mendeteksi cedera dini dan subklinis, yang menyoroti keunggulan eksosom sebagai biomarker diagnostik dini.
Artikel ini menjelaskan penelitian terkini tentang fungsi biologis eksosom dalam penyakit ginjal, memberikan gambaran umum tentang bukti yang mendukung eksosom sebagai biomarker yang kuat untuk penyakit ginjal. Dalam tinjauan ini, tujuan kami adalah untuk meringkas secara komprehensif penemuan yang dibuat dalam beberapa tahun terakhir mengenai eksosom sebagai biomarker diagnostik dalam penyakit ginjal, dan mengeksplorasi potensi signifikannya dalam memprediksi perkembangan penyakit dan memandu pendekatan pengobatan. Melalui eksplorasi bidang yang baru muncul ini, kita mungkin berpotensi menyaksikan terobosan yang belum pernah terjadi sebelumnya dalam diagnosis dan pengobatan penyakit ginjal.
2 TINJAUAN UMUM EKSOSOM
2.1 Biogenesis eksosom dan muatannya
Sebagai partikel turunan sel yang tertutup lapisan ganda lipid, 13 Eksosom dapat disekresikan oleh hampir semua jenis sel. 14 Berdasarkan sifat fisikokimia dan proses biogenesisnya, EV dapat dibagi menjadi tiga subtipe: eksosom (<200 nm), 15 mikrovesikel (100–1000 nm), 16 dan vesikel apoptosis (1000–5000 nm) 17 (Gambar 1 ). Di antara mereka, biogenesis eksosom dimulai dengan endositosis membran sel, membentuk endosom awal. Di bawah regulasi kompleks penyortiran endositosis dan protein kunci lainnya, endosom awal secara bertahap matang menjadi endosom akhir, yang bertunas ke dalam melalui membran plasma ke dalam lumen untuk menghasilkan badan multivesikular (MVB) yang mengandung vesikel intraluminal (ILV) 6 (Gambar 2 ). MVB memiliki dua nasib, salah satunya adalah MVB menyatu dengan lisosom dan terdegradasi karena kargo ubiquitilasi yang dikandungnya, dan yang lainnya adalah mereka menyatu dengan membran sel, berlabuh dan melepaskan ILV ke lingkungan eksternal melalui tindakan sitosol. 18 Saat ini, proses pembentukan dan sekresi eksosom terutama diatur melalui jalur kompleks penyortiran endosomal yang diperlukan untuk transportasi (ESCRT)-tergantung dan jalur independen ESCRT, 19 , 20 serta jalur autofagi-lisosom. 21 Melalui mekanisme rumit ini, eksosom memainkan peran yang sangat diperlukan dalam komunikasi antar sel, memberikan perspektif multidimensi dan spasiotemporal untuk pensinyalan seluler. Melalui mekanisme canggih ini, eksosom memainkan peran yang sangat diperlukan dalam transfer informasi sel-ke-sel, membawa perspektif baru komunikasi seluler spasiotemporal multidimensi.
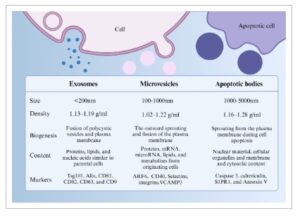
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Karakteristik berbagai jenis EV. Ada berbagai jenis EV, dan karakteristik fisik, mekanisme pembentukan, pola pelepasan, konten, dan penandanya tidak sama persis.
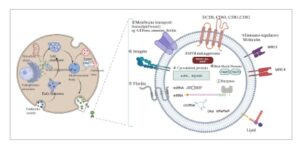
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Biogenesis dan identifikasi eksosom. Eksosom berasal dari jalur endositosis dan diatur oleh jaringan trans-Golgi, mitokondria, dan retikulum endoplasma untuk membentuk MVB yang mengandung ILV. MVB dapat menyatu dengan membran plasma untuk eksositosis atau menargetkan degradasi lisosom. Selain itu, ketika MVB bergabung dengan autofagosom, muatan dapat didegradasi di dalam lisosom dan didaur ulang oleh sel. Eksosom dienkapsulasi dalam lapisan ganda fosfolipid dan mengandung protein yang terlibat dalam biogenesis eksosom, termasuk protein ESCRT, protein transpor membran, protein tetraspanin, dan sebagainya (seperti yang disebutkan dalam teks). Singkatnya, eksosom dapat membawa berbagai jenis protein permukaan sel, protein intraseluler, lipid, RNA, DNA, dan metabolit.
Tata nama eksosom telah lama menjadi isu yang kontroversial. Semakin banyak peneliti yang menyadari kesulitan dalam membedakan EV setelah mereka meninggalkan sel. Selain eksosom sejati, “sampel eksosom” yang dihasilkan menggunakan teknik yang ada juga mencakup sejumlah besar entitas non-vesikular, seperti mikrovesikel dan badan apoptosis. Menurut pedoman International Society for Extracellular Vesicles, “vesikel ekstraseluler” direkomendasikan sebagai istilah umum untuk biopartikel yang dilepaskan dari sel, tertutup oleh lapisan ganda lipid dan tidak dapat direplikasi. 15 Eksosom merupakan subtipe EV kecil, dengan vesikel intraseluler biasanya memiliki diameter lebih kecil dari 200 nm. Oleh karena itu, kecuali dinyatakan lain, istilah “eksosom” yang digunakan dalam artikel ini mengacu pada campuran EV kecil, termasuk eksosom, badan apoptosis, mikrovesikel, ektosom, dan asidokalsisom.
Eksosom, sebagai keluarga vesikel heterogen, menunjukkan komposisi konten yang beragam dan membawa muatan yang berbeda (Gambar 2 ). 22 Penelitian menunjukkan bahwa asal subseluler eksosom dan status aktivasi sel donor dapat berkontribusi terhadap heterogenitasnya. 23 – 25 Namun, karena asal endosomalnya, subpopulasi ini umumnya mengandung molekul yang sama. Penelitian yang relevan telah mengonfirmasi bahwa eksosom diperkaya dengan protein, beberapa di antaranya umum dimiliki oleh eksosom sementara yang lain khusus untuknya. Protein-protein ini meliputi protein ESCRT yang terlibat dalam pembentukan eksosom dan transpor MVB (ALIX, TSG101, HSP70, dan HSP90), 18 , 26 – 28 transpor membran dan protein terkait fusi (Annexins, protein Rab GTPase, dan flotillin), 29 , 30 tetraspanin (CD9, CD63, CD81, dan CD82), 31 – 33 protein cytoskeletal (aktin, miosin) dan lainnya. 34 Di sisi lain, protein tertentu sangat bergantung pada jenis asal sel, seperti integrin, protein MHC kelas I dan II, antara lain. 34 Pada saat yang sama, lipid juga merupakan konstituen penting dari eksosom. Dibandingkan dengan EV lainnya, eksosom memiliki struktur hierarki lipid yang lebih kompleks, 35 diperkaya dengan sphingolipid, kolesterol, fosfolipid, gliserofosfolipid, dan seramida. 36 , 37 Struktur membran dwi lapis yang dibentuk oleh lipid ini memberikan stabilitas pada eksosom. Lipid tidak hanya memainkan peran penting dalam mempertahankan morfologi eksosom tetapi juga berpartisipasi dalam biogenesis dan regulasi homeostasis sel penerima. 38 Di sisi lain, asam nukleat dalam eksosom juga telah dipelajari secara ekstensif, termasuk messenger RNA (mRNA), microRNA (miRNA), circular RNA (circRNA), DNA dan jenis asam nukleat lainnya. Asam nukleat ini dapat berfungsi sebagai pembawa untuk regulasi epigenetik dan memiliki potensi besar untuk komunikasi antar sel dan sebagai biomarker diagnostik potensial. 39 – 41 Perlu dicatat bahwa kelimpahan RNA dalam eksosom bervariasi secara signifikan tergantung pada jenis asal sel, dan proses penyortiran memainkan peran penting dalam menentukan spesies RNA mana yang dikemas ke dalam eksosom. 8 , 42 Melalui mekanisme yang kompleks dan beragam ini, eksosom menyajikan gambaran multifaset yang menarik tentang keserbagunaan dan heterogenitas internalnya.
2.2 Fungsi eksosom
Eksosom pernah dianggap sebagai kantong sampah sel, yang mendorong eliminasi protein dan molekul yang tidak diinginkan atau berlebih untuk mempertahankan homeostasis seluler. 43 Namun, kita sekarang tahu bahwa eksosom bukan sekadar pembawa limbah; mereka secara aktif berpartisipasi dalam berbagai fungsi seluler. 44 , 45 Secara umum, eksosom dapat mengirimkan informasi dan memengaruhi sel target melalui beberapa mekanisme potensial: 1. Fusi eksosom dengan membran plasma sel penerima, yang mengarah pada transfer isi eksosom. 2. Penyerapan eksosom ke dalam endosom, diikuti oleh pelepasan muatannya ke dalam sitoplasma. 3. Mereka juga dapat mengaktifkan reseptor dan pensinyalan hilir dalam sel target melalui interaksi reseptor-ligan. 46 – 48 Seperti dibahas di bagian sebelumnya, eksosom membawa protein, asam nukleat, dan lipid, yang dibentuk secara selektif dan diatur oleh komponen tertentu. Struktur unik ini menjadikan eksosom sebagai mediator yang sangat baik untuk komunikasi antar sel sebagai molekul pensinyalan kecil. Eksosom telah terbukti memainkan peran penting dalam berbagai proses seperti peradangan, 49 regulasi imun, 50 angiogenesis, 51 proliferasi sel, 52 apoptosis, 53 , 54 dan pensinyalan antar sel, 55 dengan demikian memengaruhi proses fisiologis dan patologis berbagai penyakit, termasuk kanker, 56 , 57 penyakit ginjal, 58 penyakit kardiovaskular, 59 dan penyakit neurodegeneratif. 60 Namun, dalam tinjauan ini, kami akan fokus pada peran penting eksosom di bidang penyakit ginjal.
2.3 Teknik utama isolasi eksosom
Eksosom dapat disekresikan oleh hampir semua jenis sel, sehingga sulit untuk mengisolasinya secara spesifik dari serpihan sel kompleks dan komponen pengganggu. Ultrasentrifugasi adalah metode yang umum digunakan untuk mengisolasi eksosom dari berbagai sampel seperti serum, media kultur sel, air liur, urin, dan cairan serebrospinal, dan metode ini telah menjadi “standar emas” saat ini karena kapasitas pemrosesannya yang tinggi. 61 Namun, eksosom yang disiapkan melalui metode ini rentan terhadap kerusakan struktural dan fungsional. 14 , 62
Dalam beberapa tahun terakhir, dengan kemajuan teknologi ilmiah, beberapa metode isolasi eksosom telah dikembangkan berdasarkan karakteristik biokimia dan fisikokimianya. Metode-metode ini meliputi ultracentrifugation, ultrafiltration (UF), immunoaffinity capture, polymerprecision based on charge neutralization, size-exclusion chromatography (SEC), dan microfluidic techniques. Setiap metode memiliki kelebihan dan kekurangannya sendiri, yang menyebabkan variasi dalam konsentrasi, kemurnian, dan ukuran eksosom (Tabel 1 ). Dengan menganalisis prinsip, langkah, dan kelebihan serta kekurangan masing-masing metode isolasi yang berbeda, kami memberikan perspektif yang komprehensif tentang strategi terkini untuk isolasi eksosom.
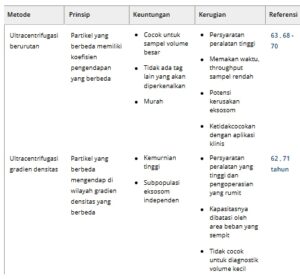
Perlu dicatat bahwa teknik-teknik ini tidak saling eksklusif, dan kombinasinya dapat sangat bermanfaat dalam meningkatkan kemurnian eksosom. Seperti dalam studi perbandingan, Lobb dkk. membandingkan penggunaan teknik pemisahan yang berbeda untuk pengolahan media kultur sel dan plasma manusia. Hasilnya menunjukkan bahwa menggabungkan UF dan SEC meningkatkan kemurnian dan hasil dibandingkan dengan ultracentrifugasi berulang, sekaligus mengurangi waktu pemrosesan secara keseluruhan. 63 Penelitian lebih lanjut diperlukan untuk mengetahui cara menggabungkan keduanya guna mencapai hasil terbaik.
Selain itu, bahan awal yang berbeda memerlukan metode pemrosesan yang berbeda, dan teknik pemisahan terus berkembang dengan meningkatnya permintaan dalam penelitian ilmiah. Ada bukti yang semakin kuat bahwa eksosom darah dan urin adalah biomarker yang paling menjanjikan untuk penyakit ginjal. 64 , 65 Darah adalah cairan kompleks yang mengandung berbagai komponen seperti eksosom, protein plasma, badan apoptosis, mikrovesikel, dan serpihan sel, yang mempersulit isolasi eksosom. Ding et al. merancang chip mikrofluida saluran serpentin tidak teratur (ExoSIC) berdasarkan magnetic-nanowaxberry (MNWB) untuk isolasi eksosom terus-menerus dari plasma. ExoSIC mencapai peningkatan efisiensi penangkapan eksosom dengan menginduksi pencampuran cairan yang kacau, menghasilkan hasil eksosom 24 kali lipat lebih tinggi dibandingkan dengan metode sentrifugasi tradisional. Kemurnian eksosom juga meningkat karena efek pengecualian ukuran. 66 Di sisi lain, urin, sebagai cairan biologis dinamis yang mengalami perubahan cepat, mengandung lebih sedikit partikel pengganggu dibandingkan dengan darah atau plasma tetapi memiliki konsentrasi eksosom yang lebih rendah. Zhang dkk. mengembangkan metode isolasi eksosom cepat melalui penggabungan partikel TiO2 magnetik dan aptamer CD63, yang berhasil mengisolasi dan menangkap 92,6% eksosom urin yang utuh secara struktural dalam waktu 10 menit. 67 Secara bersamaan, sifat afinitas ganda aptamer Fe3O4@TiO2-CD63 dapat secara signifikan meningkatkan sensitivitas penangkapan EV, sehingga mengurangi kehilangan vesikel selama proses isolasi. Untuk meningkatkan hasil dan kemurnian eksosom yang efektif dan memfasilitasi penemuan biomarker penyakit, diyakini bahwa dalam waktu dekat, kombinasi teknologi baru seperti mikrofluida dan elektronik dengan teknik pemisahan eksosom tradisional akan mengalami perkembangan yang lebih luas.
3 EKSOSOM DI GINJAL
Bukti yang semakin banyak menunjukkan bahwa interaksi seluler yang dimediasi eksosom memainkan peran penting dalam perkembangan penyakit ginjal. 81 Di bagian ini, kami akan fokus pada penyelidikan eksosom dalam keadaan fisiologis dan patologis ginjal. Kami juga akan membahas asal usul eksosom yang berbeda dalam penyakit ginjal, serta mengeksplorasi mekanisme yang mendasarinya.
3.1 Eksosom dalam fisiopatologi ginjal
Ginjal adalah organ penting dalam menjaga lingkungan yang stabil dalam tubuh, bertanggung jawab untuk eliminasi limbah metabolisme dan pemeliharaan keseimbangan air-elektrolit/asam-basa, 82 sedangkan eksosom tidak hanya terlibat dalam perkembangan normal ginjal, tetapi juga bertindak sebagai pengatur multifaset dari perkembangan penyakit ginjal, dan eksosom cenderung memainkan peran dalam fisiologi dan patofisiologi ginjal melalui komunikasi antar sel dalam unit ginjal. 83 , 84 Analisis proteomik telah mengonfirmasi bahwa dalam keadaan ginjal normal, 99,96% protein yang ada dalam EV urin menunjukkan karakteristik sel urogenital, 85 , 86 yang menunjukkan bahwa eksosom dari berbagai bagian unit ginjal dapat dilepaskan ke dalam urin atau diangkut ke sel ginjal lainnya. Bukti yang muncul menunjukkan bahwa eksosom tertentu berpartisipasi dalam jalur pensinyalan distal-proksimal, yang memberikan efek regulasi yang signifikan pada aktivitas metabolisme dan status fungsional sel efektor. Validasi eksperimental telah menunjukkan bahwa molekul pensinyalan spesifik yang dibawa oleh eksosom dapat menjalani transmisi longitudinal sepanjang sistem tubulus ginjal, dengan demikian berkontribusi pada proses fisiologis penting seperti modulasi GFR dan pemeliharaan homeostasis elektrolit. 87 Khususnya, kapasitas regulasi homeostatis eksosom dapat merupakan fungsi biologis utamanya—berfungsi sebagai mekanisme penting yang melaluinya sel mempertahankan proses metabolisme normal dan berpartisipasi dalam keseimbangan fisiologis sistemik. Regulasi homeostatis ini pada dasarnya bergantung pada transportasi yang dimediasi eksosom dari biomolekul fungsional utama, termasuk miRNA, mRNA, dan faktor regulasi lainnya dengan aktivitas biologis yang tepat. 88 , 89 Penyakit ginjal dicirikan oleh patologi yang rumit, dengan hipoksia, 90 stres oksidatif, 51 peradangan, 91 dan fibrosis ginjal dianggap sebagai proses patologis inti. 92 Cedera ginjal memicu peradangan, yang menyebabkan fibrosis ginjal yang progresif dan ireversibel. Proses ini melibatkan interaksi kompleks antara berbagai sel inflamasi dan jalur pensinyalan sitokin, yang berfungsi sebagai dasar patologis dan jalur utama penyakit ginjal. 93 , 94 Selain itu, tingginya laju metabolisme ginjal membuatnya sangat rentan terhadap stres oksidatif, yang dapat memperburuk kerusakan oksidatif, menginduksi apoptosis sel endotel (EC), peradangan, autophagy, dan fibrosis, yang mengakibatkan kelainan histologis dan fungsional pada jaringan ginjal dan akhirnya menyebabkan cedera ginjal. 51 , 95Perlu dicatat bahwa eksosom telah dilaporkan berpartisipasi aktif dalam hampir semua proses biologis ini. Selain itu, lingkungan mikro seluler pada penyakit ginjal dapat memengaruhi pelepasan eksosom. Misalnya, dalam kondisi hipoksia, pH asam, toksin uremik, glukosa tinggi (HG), dan stres oksidatif, terjadi peningkatan sekresi eksosom. Efek patologis yang diamati mungkin berasal dari tindakan terkoordinasi eksosom dengan fungsi serupa selama periode yang panjang. Mekanisme dan peran spesifik eksosom dalam proses ini masih memerlukan studi lebih lanjut.
3.2 Berbagai asal usul eksosom pada penyakit ginjal
Dalam keadaan sehat maupun sakit, eksosom dapat berasal dari berbagai jenis sel seperti podosit, sel mesangial, sel epitel, dan makrofag. Vesikel ini dilepaskan ke ruang ekstraseluler dan dapat dideteksi dalam berbagai cairan dan jaringan tubuh, termasuk darah, urin, cairan serebrospinal, ASI, air liur, cairan ketuban, getah bening, dan empedu. 100 Seperti yang disebutkan sebelumnya, eksosom memainkan peran penting dalam perkembangan penyakit ginjal. Selain itu, beragam molekul bioaktif yang berasal dari eksosom dapat memengaruhi fungsi seluler saat mencapai sel penerima; mereka dapat memodifikasi metabolisme atau mengubah ekspresi gen sel penerima, sehingga mendorong atau menghambat perkembangan penyakit.
3.2.1 Sel mesangial
Sel mesangial, sebagai sel matriks, tidak hanya berperan dalam struktur jaringan tetapi juga terlibat erat dalam regulasi imun melalui fagositosis, penyajian antigen, dan respons inflamasi. Sel-sel ini sangat penting untuk menjaga homeostasis glomerulus dan merespons cedera glomerulus. 101 Glukosa berfungsi sebagai faktor yang mampu memodulasi pelepasan dan mengganggu sekresi eksosom oleh sel-sel mesangial. Stimulasi HG menginduksi peningkatan kuantitas EV. Selain itu, Antônio et al. mengamati bahwa HMC yang diobati dengan HG-Exos menunjukkan peningkatan kadar reseptor fibronektin, angiotensinogen, renin, AT1, dan AT2. 102 Dalam sebuah studi in vitro, ditemukan bahwa pelepasan eksosom yang diinduksi HG dari sel-sel mesangial mengaktifkan jalur pensinyalan PI1K-AKT dalam podosit melalui TGF -β3 , yang menyebabkan interaksi antara sel-sel mesangial dan podosit. 103 Interaksi ini menginduksi apoptosis podosit dan menghambat adhesi podosit. Eksosom yang berasal dari sel mesangial juga dapat mengatur jalur pensinyalan PI3K/Akt/mTOR atau menargetkan ekspresi ULK2, menekan autofagi podosit, sehingga memperbaiki kerusakan podosit dan mengendalikan perkembangan penyakit. 104 , 105
3.2.2 Sel Endotel
Cedera EC merupakan inti dari kerusakan ginjal akut dan kronis, yang dipicu oleh penipisan oksigen, pembentukan spesies oksigen reaktif, dan hiperperfusi, serta memainkan peran penting dalam mengatur proses seperti peradangan dan koagulasi. 106 Mereka berkomunikasi dengan sel target atau lingkungan sekitar melalui pelepasan eksosom. Misalnya, sel endotel glomerulus (GEC) mengeluarkan EV yang mengandung TGF -β1 setelah terpapar HG, yang dapat mengaktifkan sel mesangial dan meningkatkan fibrosis ginjal, 107 sementara GEC yang diobati dengan TGF -β mengalami transfer parakrin eksosom yang mengandung miR-192-5p untuk menurunkan regulasi nukleonektin podosit dan mengakibatkan penataan ulang sitoskeletal. 108 MiR-670-3p yang dilepaskan oleh EC meningkatkan kalsifikasi arteri dengan menargetkan IGF-1 dan mungkin menjadi target potensial untuk pengobatan dan prognosis kalsifikasi arteri pada pasien ESRD. 109
3.2.3 Sel epitel ginjal
Sel epitel tubulus ginjal (TEC) adalah jenis sel yang paling banyak di ginjal dan sering mengalami kerusakan akibat hipoksia, proteinuria, toksin, gangguan metabolik, dan penuaan. Selain itu, TEC sering menjadi lokasi awal cedera ini. Bukti yang semakin banyak menunjukkan bahwa tubulus ginjal tidak hanya mengalami kerusakan tetapi juga memainkan peran pendorong dalam perkembangan penyakit ginjal. 110 Sebagai mediator komunikasi antar sel, eksosom memfasilitasi komunikasi antara berbagai jenis sel. Temuan menunjukkan bahwa eksosom yang dilepaskan dari TEC yang membawa miR-19b-3p memainkan peran patologis utama dalam peradangan interstisial tubulus ginjal melalui internalisasi vesikel yang dimediasi makrofag. 111 Diketahui bahwa pelepasan eksosom dari sel epitel meningkat dalam kondisi hipoksia, dan eksosom miR-374b-5p, yang diisolasi dari TEC hipoksia, menyebabkan polarisasi M1 dan produksi sitokin inflamasi, yang mendorong cedera ginjal intrarenal dan ekstrarenal. 112 Secara konsisten, ditemukan pula bahwa peningkatan pelepasan eksosom yang mentransfer mRNA CCL2 dari TEC ke makrofag merupakan mekanisme utama peradangan tubulointerstitial ginjal yang diinduksi albumin. 113
3.2.4 Makrofag
Makrofag memainkan peran penting sebagai sel imun multifungsi dalam menjaga kesehatan ginjal dan mendorong cedera dan perbaikan ginjal. Mereka memberikan efek beragam dengan mengintegrasikan sinyal endokrin/parakrin atau pensinyalan ligan-reseptor dalam lingkungan jaringan lokal. 114 , 115 Penelitian telah menjelaskan bahwa fenotipe makrofag dipengaruhi oleh perubahan dalam lingkungan mikro ginjal dan berbagai tahap penyakit ginjal. Misalnya, pada AKI terkait sepsis, makrofag dengan fenotipe berbeda mengatur pensinyalan miR-93/TXNIP melalui pengiriman eksosom; di sisi lain, modulasi ini menyebabkan gangguan fungsional sel epitel glomerulus, yang berdampak pada perkembangan AKI yang diinduksi sepsis. 116 , 117 Menghambat apoptosis podosit memainkan peran penting dalam menunda perkembangan penyakit ginjal diabetes. Eksosom yang berasal dari makrofag diketahui membawa molekul aktif biologis seperti miR-25-3p dan miR-5-2p, yang terlibat dalam cedera podosit selama neuropati diabetik. Molekul-molekul ini memberikan efek nefroprotektif dengan mengaktifkan autofagi seluler dan menghambat apoptosis podosit yang diinduksi HG/lipopolisakarida (LPS). 118 , 119 Selain itu, makrofag dapat membawa eksosom seperti miR-342-3p, miR-21-5p, dan miR-193a-5p dan mengirimkannya ke sel karsinoma sel ginjal (RCC), sehingga mendorong proliferasi, migrasi, dan sifat invasif RCC secara in vitro dan in vivo. 120 – 122
3.2.5 Podosit
Podosit merupakan sel terpenting yang bertanggung jawab atas penyaringan dan memainkan peran krusial dalam menjaga integritas penghalang penyaringan glomerulus. Setelah terluka, podosit tidak dapat beregenerasi. Perubahan fenotipik pada podosit (diferensiasi sel, hipertrofi, apoptosis, fusi prosesus kaki, atau penghapusan) dan pelepasan podosit merupakan penyebab utama proteinuria dan perkembangan penyakit ginjal. 123 Mekanisme spesifik mungkin melibatkan miR-221 yang berasal dari podosit, yang memediasi cedera pada sel tubulus proksimal melalui jalur pensinyalan Wnt/ β -catenin. 124 Penelitian juga menunjukkan bahwa miRNA dari podosit yang rusak menyebabkan cedera pada TEC ginjal, yang bergantung pada aktivasi jalur p38. Jalur interaksi glomerulus-tubulus ini dapat menjelaskan penurunan fungsi ginjal pada penyakit glomerulus dan berkontribusi pada perkembangan cedera tubulus pada penyakit glomerulus. 125
4 KEUNTUNGAN BIOMARKER EKSOSOM PADA PENYAKIT GINJAL
Eksosom tidak hanya berperan dalam patogenesis penyakit ginjal tetapi juga berfungsi sebagai sumber berharga dari biomarker non-invasif potensial untuk diagnosis dan prognosis. Sebagai organ non-regeneratif, diagnosis penyakit ginjal biasanya bergantung pada biopsi ginjal yang sangat invasif. Namun, metode ini dibatasi oleh kendala pemantauan berkelanjutan dan bias pengambilan sampel. Di sisi lain, biomarker konvensional yang digunakan dalam praktik klinis tidak ideal, kurang sensitif dalam mengidentifikasi cedera ginjal dini. Selain itu, kreatinin serum (SCr), yang umumnya digunakan untuk mengevaluasi laju filtrasi glomerulus (eGFR), memiliki keterbatasan yang terkenal termasuk diagnosis yang tertunda dan kerentanan terhadap gangguan dari faktor non-ginjal. 126 Selain itu, keandalan mikroalbuminuria sebagai prediktor penyakit ginjal stadium akhir baru-baru ini dipertanyakan. 127 Mengingat keterbatasan pendekatan diagnostik saat ini, ada kebutuhan untuk mengeksplorasi biomarker molekuler yang lebih kompleks untuk diagnosis dini, penentuan stadium yang akurat, dan prognosis yang lebih baik. Di antara ini, eksosom menonjol (Gambar 3 ). Pertama, kompleksitas cairan tubuh menimbulkan hambatan dalam identifikasi dan validasi biomarker dalam analisis rutin. Eksosom dihasilkan oleh beragam jenis sel dalam tubuh kita, dan mengisolasi komponen EV dari cairan tubuh dapat menguras sebagian besar protein yang berlimpah, sehingga secara signifikan mengurangi kompleksitas sampel. Kedua, eksosom memiliki berbagai sumber, mudah diakses, dan bersifat minimal invasif. Eksosom relatif mudah diidentifikasi karena mengekspresikan kandungan biologis seperti protein dan lipid, sehingga dapat dibedakan sebagai biomarker dari EV lainnya. Ketiga, eksosom menunjukkan spesifisitas seluler yang tinggi dan mengandung komponen yang sangat mencerminkan karakteristik sel induknya, seperti asam nukleat (mRNA, miRNA, dan DNA), protein, lipid, dan metabolit. Zat-zat ini terdapat dalam konsentrasi yang relatif rendah dalam urin dan darah yang bersirkulasi. Namun, eksosom memiliki kemampuan untuk mengangkut zat-zat ini ke dalam sirkulasi perifer dan ditemukan dalam cairan tubuh seperti darah, urin, air liur, dan air mani. 128 Isolasi EV spesifik sel dapat memberi kita informasi mengenai kondisi patologis tertentu. Dengan kata lain, informasi yang disampaikan oleh EV yang berasal dari penyakit dapat digunakan untuk menentukan status atau perkembangan penyakit. Selain itu, karena struktur lapisan lipid dan ketahanannya terhadap degradasi enzimatik, eksosom dapat mempertahankan integritasnya dalam cairan biologis, mencegah kerusakan akibat faktor lingkungan potensial lainnya. 129Stabilitas ini memungkinkan mereka untuk berfungsi sebagai indikator keadaan fisiologis atau patologis sel-sel yang berasal. Bahkan pada tahap awal penyakit, eksosom dapat diisolasi untuk penilaian klinis. Eksperimen telah mengevaluasi stabilitas eksosom dalam plasma pada kondisi penyimpanan yang berbeda (37, 4, -20, dan -80 °C, dengan dan tanpa inhibitor protease) dan memperoleh sampel pada berbagai titik waktu selama periode 3 bulan. 130 Analisis imunoblot protein mengungkapkan bahwa semua sampel EV yang dipulihkan diuji positif untuk penanda EV TSG101, yang menunjukkan stabilitas EV setidaknya selama 3 bulan. Ge et al. juga mengonfirmasi hal ini dan menemukan bahwa menyimpan miRNA plasma pada suhu -20 °C setidaknya selama 5 tahun memiliki dampak minimal pada jumlah total. 131 miRNA spesifik menunjukkan pola lokalisasi spesifik segmen nefron. Misalnya, miR-192 menunjukkan pengayaan 3,8 kali lipat lebih tinggi dalam sel mesangial glomerulus dibandingkan dengan TEC ginjal ( p <0,01). Karakteristik yang dikodekan secara spasial ini memfasilitasi identifikasi lokasi cedera yang tepat dalam mikrostruktur ginjal. 132 Akhirnya, pertimbangan penting adalah bahwa biopsi jaringan tidak dapat dilakukan pada frekuensi optimal, dan seiring waktu, kemudahan penggunaan dan peningkatan ketersediaan biopsi cair dapat bermanfaat bagi pasien dalam berbagai cara, bahkan jika dalam beberapa kasus sensitivitasnya mungkin lebih rendah daripada uji jaringan standar emas. Oleh karena itu, eksosom sebagai biomarker lebih representatif dan dapat diterapkan secara klinis. Belum jelas apakah ada perbedaan antara eksosom urin dan darah sebagai biomarker diagnostik untuk penyakit ginjal. Menurut laporan, eksosom urin adalah vesikel internal MVB yang menyatu dengan membran plasma apikal TEC ginjal dan diangkut ke ruang urotelial melalui membran luar MVB. Umumnya, sulit bagi eksosom yang bersirkulasi untuk memasuki urin melalui glomerulus dalam kondisi fisiologis. Oleh karena itu, sumber eksosom urin terbatas pada ginjal dan dapat disekresikan oleh berbagai sel dalam sistem urin. Pengayaan protein atau penanda dari segmen ginjal tertentu, kandung kemih, dan prostat telah terdeteksi dalam eksosom urin, yang menawarkan kemungkinan untuk mengisolasi populasi eksosom spesifik jaringan. Aspek lain, kandungan eksosom dalam darah dipengaruhi oleh berbagai faktor dan bervariasi tergantung pada jenis sampel (plasma, serum, dan cairan lainnya). Sebaliknya, eksosom plasma dan eksosom serum dapat berasal dari berbagai jenis sel yang menghadap lumen pembuluh darah, termasuk berbagai jenis sel darah dan sel endotel. 133Dalam sampel darah, eksosom yang berasal dari plasma menunjukkan konsentrasi miRNA yang lebih tinggi dibandingkan dengan serum, sehingga menjadikannya sampel yang berpotensi lebih unggul untuk studi proteomik eksosom berbasis darah. Dapat disimpulkan bahwa eksosom urin secara langsung berasal dari unit ginjal dan dapat mencerminkan kerusakan parenkim ginjal secara langsung, sementara eksosom darah mengintegrasikan beberapa sinyal organ melalui sirkulasi sistemik untuk mengevaluasi beban patologis sistemik. Oleh karena itu, komponen eksosomal tertentu, khususnya miRNA, telah dikenal dalam beberapa tahun terakhir sebagai biomarker indikatif potensial dengan sensitivitas dan spesifisitas yang kuat untuk berbagai penyakit ginjal. Biomarker eksosomal tidak hanya berkontribusi untuk memahami mekanisme patofisiologis yang mendasarinya tetapi juga membantu dalam diagnosis cedera ginjal dini. Biomarker non-invasif ini dapat membantu menentukan waktu yang optimal untuk intervensi, sehingga meningkatkan manajemen pasien dan hasil prognosis.
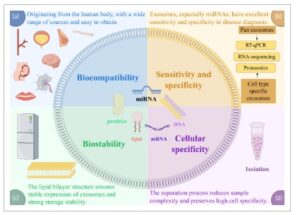
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
Keunggulan eksosom sebagai biomarker diagnostik untuk penyakit ginjal. Ketersediaan luas pengumpulan sampel minimal invasif, serta stabilitas, spesifisitas, dan sensitivitas biomarker eksosom tertentu, secara kolektif mendukung kegunaannya sebagai alat diagnostik.
5 PERAN BARU EKSOSOM SEBAGAI PENANDA DIAGNOSTIK DI BIDANG NEFROPATI
Pada tahun 1998, Kelompok Kerja Definisi Biomarker dari National Institutes of Health mendefinisikan biomarker sebagai “karakteristik yang diukur dan dievaluasi secara objektif sebagai indikator proses biologis normal, proses patogenik, atau respons farmakologis terhadap intervensi terapeutik.” 134 Terjadinya penyakit ginjal jelas dipengaruhi oleh banyak gen, protein, jalur metabolisme, dan faktor lingkungan. Dalam praktik klinis, biomarker yang umum digunakan untuk mengevaluasi kesehatan ginjal memiliki keterbatasan yang terkenal. Dalam banyak kasus, mengidentifikasi cedera ginjal patologis tertentu dan mengevaluasi perkembangannya masih memerlukan bantuan biopsi ginjal. Eksosom, sebagai biomarker diagnostik yang berharga, memiliki potensi luar biasa dalam identifikasi dini dan pemantauan disfungsi ginjal (Tabel 2 ).
TABEL 2. Gambaran umum eksosom sebagai biomarker pada penyakit ginjal.
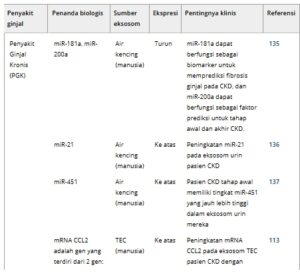
5.1 Penyakit ginjal kronis
Penyakit ginjal kronis (CKD) adalah suatu kondisi yang ditandai dengan kerusakan ireversibel pada glomerulus dan tubulus ginjal melalui proses kompleks seperti peradangan dan fibrosis, yang pada akhirnya menyebabkan gagal ginjal. Biasanya stadiumnya berdasarkan eGFR dan derajat proteinuria. 206 Sejumlah penelitian telah menunjukkan perbedaan kelimpahan EV pada pasien CKD dibandingkan dengan kontrol sehat. Khurana et al., menggunakan analisis RNA-seq, mengidentifikasi 30 RNA non-coding yang diekspresikan secara berbeda yang berasal dari eksosom yang berasal dari urin pada pasien CKD. Di antara ini, miRNA-181a menunjukkan kelimpahan yang menurun secara signifikan pada kelompok CKD dibandingkan dengan kelompok kontrol dan berkorelasi dengan tingkat fibrosis ginjal. 135 Penelitian ini juga menemukan bahwa penurunan regulasi miR-200a dapat memprediksi tahap awal dan akhir CKD. Demikian pula, penelitian telah menemukan peningkatan regulasi miR-21 dan seruloplasmin dalam eksosom urin pasien CKD. Yang pertama berkorelasi negatif dengan fungsi ginjal, sedangkan yang terakhir menunjukkan peningkatan kadar pada model tikus sebelum timbulnya proteinuria, yang meletakkan dasar bagi potensi mereka sebagai biomarker diagnostik dini untuk CKD. 136 , 138 Studi lain mengamati kadar miR-451 yang lebih tinggi pada subjek CKD tahap awal dan korelasi negatifnya dengan eGFR manusia. 137 Eksperimen ini menunjukkan bahwa penurunan regulasi miR-451 menargetkan gen YWHAZ dan CAB39, yang menunjukkan bahwa itu mungkin merupakan respons dini terhadap cedera sel ginjal dan biomarker diagnostik potensial untuk CKD. Proteinuria yang menyertai CKD mendorong peningkatan regulasi mRNA CCL2 dalam eksosom TEC, yang memperburuk peradangan interstisial. Oleh karena itu, berspekulasi bahwa mRNA CCL2 dapat berfungsi sebagai biomarker diagnostik baru untuk CKD. 113 Protein permukaan EV seperti faktor pertumbuhan epidermal (EGF) dan Paraoxonase 1 (PON1) telah disarankan sebagai biomarker potensial untuk perkembangan CKD. 139 , 140 Telah divalidasi bahwa kadar EGF dalam urin dan aktivitas plasma PON1 dikaitkan dengan perkembangan CKD. Fibrosis ginjal merupakan ciri khas perkembangan penyakit dan kerusakan permanen pada CKD. Beberapa biomarker eksosomal telah diusulkan untuk penilaian fibrosis ginjal non-invasif, seperti hsa_circ_0036649, 207 hsa_circ_0008925, 208 miR-200b, dan seterusnya. 209
5.2 Cedera ginjal akut
Cedera ginjal akut (AKI) adalah sindrom klinis yang ditandai dengan penurunan fungsi ginjal yang cepat, biasanya didiagnosis berdasarkan akumulasi produk akhir metabolisme nitrogen (urea dan kreatinin), penurunan produksi urin, atau kombinasi keduanya. 210 Analisis miRNA dalam eksosom urin dapat mencerminkan ekspresi gen seluler di ginjal. Untuk penemuan mekanisme patogenik dan biomarker, penelitian telah menunjukkan peningkatan kadar miR-16, miR-24, dan miR-200c dalam eksosom urin selama tahap awal cedera ginjal, sedangkan kadar miR-125 dan miR-351 meningkat pada tahap akhir (fase fibrosis ginjal) karena pelepasan yang diatur oleh TGF-β1. 141 Telah diamati juga bahwa kadar miRNA-21 meningkat pada pasien dengan AKI, dan kadarnya berkorelasi positif dengan tingkat keparahan AKI. 142 Di sisi lain, aquaporin-1, 211 protein Fetuin-A, 212 dan protein ATF3 143 , 213 dalam eksosom urin telah diidentifikasi sebagai biomarker diagnostik potensial untuk AKI. Dalam beberapa tahun terakhir, Awdishu et al. juga telah mengidentifikasi MGAM sebagai protein EV yang unik dan melimpah pada pasien dengan AKI terkait sirosis hati, menunjukkan spesifisitas yang kuat, 144 dan studi proteomik baru-baru ini menunjukkan bahwa NHE3 eksosom urin meningkat pada berbagai tikus AKI dan pasien AKI terkait sepsis, dan meningkat lebih awal pada AKI yang diinduksi cisplatin dan AKI terkait candesartan yang mengandung NaCl rendah daripada pada SCr yang meningkat lebih awal. 145 Lebih jauh, lipokalin terkait gelatinase neutrofil (uNGAL) dalam urin menunjukkan kemampuan diskriminatif yang tinggi dalam memprediksi ATN-AKI, dengan ambang batas optimal untuk membedakannya dari bentuk AKI lainnya adalah 220 ng/mL, yang menunjukkan sensitivitas 89% dan spesifisitas 78%. 146 Kadar uNGAL yang meningkat juga terdeteksi secara signifikan pada pasien dengan AKI yang sedang berkembang dan AKI yang parah. Temuan-temuan ini secara kolektif menunjukkan bahwa perubahan pada penanda eksosom urin yang disebutkan di atas dapat berfungsi sebagai biomarker untuk mendiagnosis AKI, membedakan etiologi, dan membantu dalam memprediksi tingkat keparahannya. Tidak hanya eksosom urin tetapi juga eksosom serum dapat berfungsi sebagai penanda diagnostik untuk AKI. Sebuah studi observasional mengidentifikasi dan memvalidasi sekumpulan miRNA, termasuk miR-101-3p, miR-127-3p, miR-210-3p, miR-126-3p, miR-26b-5p, miR-29a-3p, miR-146a-5p, miR-27a-3p, miR-93-3p, dan miR-10a-5p, sebagai penanda diagnostik untuk memprediksi status penyakit AKI pada pasien Unit Perawatan Intensif dan Bedah Jantung.214 Lebih jauh lagi, dalam model tikus AKI yang diinduksi sepsis, ekspresi diferensial miR-181a-5p dan miR-23b-3p dalam EV yang bersirkulasi ditemukan mendahului peningkatan kadar kreatinin, 147dan kedua miRNA menargetkan faktor transkripsi yang terkait dengan pengaturan proses inflamasi.
5.3 Karsinoma sel ginjal
RCC adalah salah satu tumor ganas yang paling umum dalam sistem urin, dengan rasio kejadian pria-wanita sebesar 2:1. 215 Angka kematian yang tinggi di antara pasien terutama disebabkan oleh kesulitan dalam diagnosis dini, invasi lokal, dan metastasis dini. Subtipe utama RCC meliputi RCC sel jernih (ccRCC), RCC stroma, dan RCC kromatolisis jarang. Sebagian besar penelitian tentang biomarker eksosomal untuk RCC difokuskan pada miRNA karena kenyamanannya dalam pengambilan sampel, spesifisitas deteksi yang lebih baik, dan stabilitas yang lebih tinggi. Studi dalam serum atau plasma juga telah memberikan wawasan komprehensif tentang peran miRNA dalam RCC. Tinjauan oleh Barth et al. merangkum bahwa miRNA diekspresikan secara berbeda dalam darah individu dan pasien yang sehat. Misalnya, dalam serum, ekspresi miR-210, miR-193a-3p, miR-362, miR-572, miR-106a, dan miR-1233 meningkat, sementara miR-28-5p menurun. Dalam plasma, kadar miR-210, miR-149-3p, dan miR-424-3p yang meningkat telah diamati, sedangkan miR-508-3p dan miR-92a-1-5p menurun. Menariknya, kombinasi miR-224 dengan miR-141, miR-378 dengan miR-210, dan miR-508-3p dengan miR-885-5p menunjukkan kemampuan diagnostik terbaik. 216 Pada tahun yang sama, Xiao et al. mendeteksi peningkatan kadar miR-149-3p dan miR-424-3p eksosomal, serta penurunan ekspresi miR-92a-1-5p secara signifikan dalam sampel plasma dari 22 pasien RCC dan 16 subjek kontrol. Nilai sensitivitasnya masing-masing adalah 0,875, 0,750, dan 0,750, sedangkan nilai spesifisitasnya masing-masing adalah 0,773, 0,727, dan 0,818,148 yang menunjukkan bahwa miRNA ini dapat berfungsi sebagai biomarker baru untuk mendiagnosis RCC. Dalam studi terbaru yang menganalisis basis data TCGA, terungkap bahwa ekspresi tinggi MYO15A dikaitkan dengan hasil yang buruk pada RCC. Selain itu, dibandingkan dengan kelompok kontrol yang sehat, pasien RCC menunjukkan peningkatan kadar MYO15A eksosomal yang signifikan dalam serum. 149 Studi proteomik sebelumnya telah menunjukkan pengayaan signifikan berbagai protein pada pasien RCC, termasuk protein biru tembaga, oncorin, protein terkait Dikkopf 4, MMP9, dan CAIX, serta AQP-1, enkephalinase, dipeptidyl peptidase-1, dan syntenin-1 yang berkurang. 217 Dalam beberapa tahun terakhir, Nora dkk. telah berhasil mendeteksi biomarker EV kecil dalam urin pasien CCRCC. 150 Biomarker protein membran spesifik, karbonat anhidrase IX (CAIX), yang diekspresikan pada EV kecil, dapat digunakan untuk diagnosis CCRCC. Ekspresinya yang berkurang secara signifikan dalam urin membuatnya sangat sensitif untuk mendeteksi dan memantau kejadian dan perkembangan CCRCC.
Urine, sebagai biofluida dinamis, memiliki potensi sebagai sumber yang berharga untuk pengembangan biomarker RCC. Pada tahun 2012, Von et al. awalnya mengusulkan penggunaan miRNA spesifik dalam eksosom urin untuk penelitian ccRCC. Mereka menemukan peningkatan ekspresi miRNA-15a dalam urin pasien RCC ganas dibandingkan dengan tumor lain, yang menunjukkan spesifisitas yang kuat. 218 Hasil ini juga dikonfirmasi oleh penelitian terkini. 151 miRNA eksosom urin lain yang menunjukkan potensi diagnostik adalah miR-210. Ia diekspresikan secara berlebihan dalam plasma pasien ccRCC, dan tidak hanya itu, tingkat ekspresi miRNA-210 menurun secara signifikan 1 minggu setelah operasi, yang mengonfirmasi kemampuan diagnostik dini yang sangat baik. 152 Dalam analisis sampel urin dari 100 pasien, Song et al. mengidentifikasi 16 miRNA yang diekspresikan secara berbeda antara pasien ccRCC dan individu sehat. Di antara ini, miR-30c-5p yang mengalami penurunan regulasi menunjukkan sensitivitas dan spesifisitas masing-masing sebesar 68,57% dan 100% untuk mendiagnosis ccRCC. 153 Selain itu, miR-30a-5p telah diusulkan sebagai biomarker urin berdasarkan metilasi miR, dengan aplikasi potensial dalam stratifikasi risiko untuk ccRCC. 154 Lebih jauh lagi, peningkatan regulasi tingkat ekspresi miR-425-5p telah diamati dalam lini sel dan jaringan RCC, khususnya dengan peningkatan 100 kali lipat dalam ekspresi miR-425-5p dalam sel RCC, yang membuatnya lebih sensitif untuk diagnosis RCC. 155 Temuan ini menggarisbawahi peran penting eksosom sebagai sumber biomarker non-invasif untuk diagnosis RCC.
5.4 Nefropati diabetik
Nefropati diabetik (DN) adalah komplikasi serius dari diabetes melitus yang disebabkan oleh perubahan struktural dan fungsional pada ginjal. Ini adalah penyebab paling umum dari ESRD, dan mikroalbuminuria secara luas diakui sebagai fitur utama nefropati diabetik. 81 , 219 Bukti yang cukup besar dalam beberapa tahun terakhir telah menyoroti spesifisitas eksosom sebagai penanda awal DN dan korelasi eksosom tertentu dengan peningkatan proteinuria. Perubahan dalam profil miRNA pasien T1DN telah dilaporkan dalam berbagai penelitian. Satu penelitian menganalisis miRNA eksosomal urin pada pasien diabetes dengan atau tanpa DN dan menemukan pengayaan miR-130a dan miR-145, serta penurunan regulasi miR-155 dan miR-424. Selain itu, ekspresi berlebihan miR-145 divalidasi dalam model eksperimental awal DN. 156 Sebuah studi komprehensif pada profil miRNA serum pasien T1DN mengungkapkan peningkatan regulasi miR-518d-3p dan miR-618 dibandingkan dengan pasien diabetes tanpa neuropati, meskipun validasi lebih lanjut diperlukan untuk menetapkan spesifisitas. 157 Pada pasien T2DN, eksosom urin let-7i-3p, miR-24-3p, miR-27b-3p, dan let-7c-5p diekspresikan secara berlebihan, sementara miR-29c-5p dan miR-15b-5p diturunkan regulasinya. Selain itu, kadar darah EV CDH2 dan MCP-1 menurun, dan perubahan ini terjadi sebelum timbulnya mikroalbuminuria. Studi juga menunjukkan bahwa kadar ekspresi miRNA ini berhubungan dengan penanda fungsi ginjal seperti SCr, rasio albumin-kreatinin urin, dan eGFR. 158 – 160 , 220 Namun, Tsai et al. menemukan peningkatan kadar miR-15b-5p yang diambil dari urin pada pasien T2DN. Ekspresi berlebihannya telah terbukti mengatur apoptosis sel mesangial yang disebabkan oleh HG. Oleh karena itu, ekspresi miR-15b-5p dalam urin harus ditafsirkan dengan hati-hati kecuali divalidasi dalam kelompok yang lebih besar. 161 Selain itu, dua miRNA yang meningkat secara signifikan, miR-188-5p dan miR-150-3p, diidentifikasi dalam EV urin dari pasien DN yang menjalani biopsi ginjal. Sebaliknya, kadar miR-153-3p dan miR-133a-3p menurun. 162
Sebuah studi observasional dengan desain cross-sectional mengungkapkan tingkat tinggi ekspresi gen mRNA WT1 dan tingkat rendah ekspresi gen mRNA ACE dalam EV darah pasien DN. Kuantifikasi mRNA ini juga secara efektif memprediksi tingkat keparahan albuminuria dan cedera glomerulus. 163 Studi lain menunjukkan bahwa mRNA CCL21 yang berasal dari eksosom urin meningkat dalam DN dan dikaitkan dengan perubahan ekspresi CCL21 jaringan ginjal dan infiltrasi sel T. Ini dapat berfungsi sebagai biomarker awal untuk mengidentifikasi DN dan mekanisme patogenik terkaitnya. 164 Tao et al. awalnya melaporkan penggunaan kadar AEBP1 yang berasal dari EV dengan area di bawah kurva (AUC) 0,880 sebagai biomarker baru untuk diagnosis DN. 165 Lebih jauh, kadar AEBP1 menunjukkan korelasi negatif dengan eGFR dan LDL, dan korelasi positif dengan Cr, protein urin 24 jam, dan serum CYC. Di sisi lain, diketahui bahwa terdapat perbedaan ekspresi untuk protein WT1, 221 AMBP, MLL3, VDAC1, 222 dan protein reguecalcitonin pada pasien DN. 223 Mempertimbangkan peran penting AQP ginjal dalam mengatur keseimbangan cairan di ginjal, Rossi et al. mengusulkan bahwa AQP2 dan AQP5 menunjukkan kecenderungan meningkat seiring dengan perkembangan penyakit, yang memberikan informasi berharga untuk penggunaan diagnostik protein eksosomal pada DN. 166 Pada pasien DN, peningkatan kadar ekspresi protein kinase serin/treonin eksosomal urin PAK6 (PAK6), reseptor faktor pertumbuhan epidermal (EGFR), 167 dan kalmodulin-1 (CALM1) telah diidentifikasi. 168 Untuk mendiagnosis DN, AUC untuk PAK6 adalah 0,903, untuk EGFR adalah 0,842, dan kombinasi kedua protein tersebut adalah 0,912. CALM1 menunjukkan nilai AUC sebesar 0,941 dan 0,903 pada tahap penemuan dan validasi DN, yang menunjukkan efisiensi diagnostik yang signifikan bagi pasien DN. Singkatnya, EV memainkan banyak peran dalam DN, meliputi berbagai aspek mulai dari mekanisme patogenik hingga perkembangan dan diagnosis penyakit.
5.5 Nefropati membranosa
Nefropati membran (MN) adalah sekelompok penyakit autoimun yang ditandai dengan pengendapan kompleks imun di bawah sel epitel membran dasar glomerulus, yang menyebabkan penebalan membran dasar. 224 Secara etiologi, penyakit ini dapat diklasifikasikan sebagai nefropati membran idiopatik (IMN) dan nefropati membran sekunder. Li et al. pertama kali menunjukkan bahwa kuantifikasi absolut miR-217 plasma dapat berfungsi sebagai biomarker diagnostik yang berguna untuk MN. MiR-217 plasma secara signifikan diturunkan regulasinya pada pasien MN dibandingkan dengan kelompok kontrol, dengan sensitivitas dan spesifisitas masing-masing sebesar 88,9% dan 75,9%. Investigasi lebih lanjut mengungkapkan bahwa miR-217 dapat berpartisipasi dalam apoptosis podosit pada MN dengan menargetkan TNFSF11. 80 Sementara itu, Zhang et al. memberikan bukti pertama tentang perbedaan signifikan dalam miRNA eksosomal urin dan repetitive region-derived small RNA antara individu dengan IMN dan kontrol sehat. Mereka mengidentifikasi 131 miRNA yang diekspresikan secara berbeda, termasuk 28 miRNA yang diekspresikan secara spesifik. 225 Melalui analisis sekuensing berthroughput tinggi dari profil miRNA dalam eksosom urin, Guo et al. menemukan bahwa dibandingkan dengan kelompok kontrol yang sehat, pasien IMN menunjukkan penurunan regulasi miR-9-5p dan miR-30b-5p. Mereka juga menemukan korelasi antara miR-9-5p dan kadar Trigliserida, eGFR, dan miR-30b-5p dengan antibodi reseptor antifosfolipase A2, ALB, dan kadar β 2-MG. Selain itu, penelitian terkait telah mengungkapkan bahwa miR-9-5p dan miR-30 mungkin terlibat dalam menjaga homeostasis podosit dan mengatur Treg. Analisis kurva ROC gabungan menunjukkan bahwa ekspresi miR-30b-5p dan miR-9-5p memiliki nilai diagnostik potensial untuk IMN. 169 Reseptor fosfolipase A2 tipe-M (PLA2R) adalah antigen spesifik dalam IMN. Sementara antibodi anti-PLA2R serum (aPLA2Rab) menunjukkan spesifisitas hampir 98% dalam mendiagnosis IMN, sensitivitasnya berkisar antara 40% hingga 80%. Sebaliknya, PLA2R eksosom urin menunjukkan sensitivitas 95,4% dan spesifisitas 63,3% dalam mendiagnosis IMN. Menggabungkan PLA2R eksosom urin dengan deteksi aPLA2Rab serum secara signifikan meningkatkan sensitivitas skrining IMN. 170 CircRNA memiliki nilai klinis yang signifikan dalam mendiagnosis IMN, meskipun terbatas dalam jumlah penelitian. Mereka menunjukkan spesifisitas dan sensitivitas yang tinggi dalam analisis proteomik. 226 Sebuah penelitian oleh Ma et al. menemukan peningkatan regulasi yang signifikan dari gen mucin 3A (MUC3A), yang sesuai dengan circRNA yang mengkode kromosom 7 dari chr7:100550808|100.551.062 dalam serum eksosom dari pasien dengan IMN, dan berspekulasi bahwa gen MUC3A mungkin terkait dengan ekspresi antibodi IgG4 dan anti-PLA2R. 171Baru-baru ini, Li dkk. menunjukkan potensi diagnostik hsa_circ_0001250. Dalam penelitian mereka, mereka menemukan bahwa peningkatan regulasi hsa_circ_0001250 bersifat unik pada IMN dibandingkan dengan kelompok kontrol sehat dan kelompok sindrom nefrotik idiopatik. Kadar hsa_circ_0001250 menunjukkan korelasi positif dengan kadar proteinuria. 172
5.6 Glomerulosklerosis segmental fokal
Patogenesis glomerulosklerosis segmental fokal (FSGS) ditandai dengan cedera podosit, dengan podosit memainkan peran penting dalam menjaga stabilitas dan fungsi glomerulus. 227 MiR-30, sebagai peserta dalam cedera podosit, menunjukkan ekspresi yang melimpah pada podosit normal dan penurunan regulasi pada podosit pasien FSGS. Hal ini menunjukkan potensi mereka sebagai biomarker diagnostik untuk FSGS. 173 Xiao dkk. menemukan bahwa empat miRNA plasma (miR-17, miR-451, miR-106a, dan miR-19b) mengalami penurunan regulasi yang signifikan dalam FSGS dibandingkan dengan kontrol yang sehat. MiRNA ini terlibat dalam pengaturan apoptosis podosit dan berkontribusi pada patogenesis FSGS. Studi ini juga menunjukkan spesifisitas kombinasi penurunan regulasi ini untuk mendiagnosis FSGS. 174 Lebih jauh lagi, WT1, sebagai faktor transkripsi yang mengontrol diferensiasi podosit dan keseimbangan intraseluler, memiliki bukti kuat yang menunjukkan hubungannya dengan WT-1 eksosom urin dan FSGS. Misalnya, pada model hewan FSGS awal, ditemukan kadar WT-1 eksosom urin yang meningkat, yang memprediksi timbulnya penyakit lebih awal daripada proteinuria dan bahkan sebelum kerusakan jaringan glomerulus. Studi selanjutnya yang melibatkan subjek manusia telah memperoleh hasil yang serupa. 175 , 176 MicroRNA-193a telah ditunjukkan sebagai faktor patogenik baru dan target dalam FSGS dalam berbagai studi. 228 , 229 Dalam beberapa tahun terakhir, telah dilaporkan bahwa miR-193a dapat berfungsi sebagai biomarker non-invasif untuk mendiagnosis dan mengevaluasi hasil pada pasien FSGS primer. Peningkatan signifikan kadar miR-193a eksosom urin telah diamati pada pasien FSGS, dan penelitian lebih lanjut telah mengungkapkan korelasi positif antara kadarnya dan indeks glomerulosklerosis. 177 Huang dkk. juga menunjukkan potensi diagnostik miR-193a; namun, studi mereka difokuskan pada pasien pediatrik dengan FSGS primer. Tingkat miR-193a yang meningkat secara signifikan mampu membedakan dengan lebih baik antara pasien pediatrik dengan FSGS primer dan mereka yang mengalami penyakit perubahan minimal (MCD), dengan area di bawah kurva ROC sebesar 0,85. 178 Analisis spektrometri massa proteomik terkini dari eksosom mesotelial limbah dialisis peritoneal menunjukkan bahwa 10% (251) dari 2490 protein yang diidentifikasi dikaitkan dengan FSGS. Di antara protein yang mengalami peningkatan regulasi dalam FSGS, annexin A13 muncul sebagai biomarker potensial yang paling penting dan menjanjikan, mencapai akurasi 100% dalam membedakan eksosom dari pasien FSGS yang menjalani dialisis peritoneal dari mereka yang tidak mengalami FSGS. 179
5.7 Nefropati imunoglobulin A
Nefropati imunoglobulin A (IgAN) adalah penyakit yang dimediasi imun dan glomerulonefritis primer yang paling umum, ditandai dengan adanya endapan IgA1 yang dominan di tunika glomerulus. 230 Sejak awal tahun 2014, Serino dkk. mengonfirmasi nilai diagnostik gabungan serum miR-148b dan let-7b dalam IgAN, dan penelitian lebih lanjut menunjukkan spesifisitas yang sangat baik dari kombinasi miRNA ini untuk mendiagnosis IgAN. 180 Duan dkk. berfokus pada identifikasi miRNA yang diekspresikan secara berbeda dalam IgAN. Melalui analisis PCR kuantitatif, mereka menemukan peningkatan regulasi miR-25-3p, miR-144-3p, dan miR-486-5p yang signifikan dalam IgAN. Kombinasi ketiga miRNA ini meningkatkan nilai AUC untuk mendiagnosis IgAN menjadi 0,940. 181 Studi lain menemukan peningkatan ekspresi plasma untuk miR-148a-3p, miR-150-5p, miR-20a-5p, dan miR-425-3p pada pasien IgAN, khususnya pada mereka dengan penyakit tahap awal. 182 Tidak hanya itu, profil ekspresi miRNA diubah secara signifikan dalam sedimen urin pasien IgAN. Studi lain menunjukkan bahwa kadar miR-34a, miR-205, miR-155, dan miR-21 urin dapat membedakan pasien IgAN dari kontrol normal dalam kisaran tertentu. 183 Demikian pula, ditemukan bahwa miR-29c eksosomal urin dan miR-205 secara signifikan meningkat, sementara miR-146a menurun pada pasien IgAN. 184 Szeto dkk. memvalidasi perbedaan signifikan dalam kadar miR-150, miR-204, miR-431, dan miR-555 dalam urin antara kelompok kontrol IgAN dan sehat. Di antara ini, miR-204 menunjukkan sensitivitas 100% dan spesifisitas 55,5% dalam mendiagnosis IgAN, dengan area di bawah kurva ROC sebesar 0,976. Nilai kritis untuk miR-204 ditetapkan sebesar 1,70 unit. 185 Ada juga temuan ekspresi miR-4639 dan miR-210 yang lebih tinggi dalam plasma dan eksosom urin pada pasien dengan IgAN, yang menunjukkan peran potensial mereka dalam menilai fungsi ginjal dan kadar proteinuria. 186 Pengamatan eksperimental serupa telah menemukan bahwa dibandingkan dengan kontrol sehat, pasien IgAN menunjukkan peningkatan regulasi kadar miR-451a, let-7d-3p, dan miR-223 yang signifikan dalam eksosom urin. 187 Kadar ini juga menunjukkan korelasi positif dengan indikator fungsi ginjal seperti Cr. Kombinasi has-miR-451a dan has-let-7d-3p menghasilkan AUC sebesar 0,8125, 188 yang menekankan nilai potensial eksosom sebagai biomarker untuk diagnosis, penilaian keparahan, dan perkembangan penyakit IgAN.
5.8 Nefritis lupus
Nefritis lupus (LN) adalah penyakit ginjal yang disebabkan oleh lupus eritematosus sistemik, di mana sistem imun menyerang ginjal, yang menyebabkan cedera tubulus, peradangan tubulointerstitial, dan fibrosis. 231 Hingga saat ini, berbagai penelitian telah melaporkan perubahan dalam profil ekspresi miRNA pada pasien LN. Eksperimen awal oleh Solé et al. menunjukkan korelasi negatif yang kuat antara kadar miR-29c dalam eksosom urin dan indeks kronisitas histologis dan glomerulosklerosis, yang menunjukkan potensinya sebagai biomarker yang sensitif dan spesifik untuk mendiagnosis tingkat keparahan LN kronis. 189 Pada tahun 2019, Solé memberikan serangkaian eksosom gabungan lainnya (miR-21, miR-150, dan miR-29c) untuk mendeteksi fibrosis ginjal dini dan memprediksi perkembangan penyakit pada LN. Eksperimen in vitro menunjukkan bahwa kombinasi miRNA ini meningkatkan fibrosis ginjal dengan meningkatkan molekul pro-fibrotik melalui jalur SP1 dan Smad3/TGF β . 190 Studi lain menunjukkan penurunan signifikan kadar miR-21 dan let-7a yang terkait dengan eksosom urin pada pasien dengan LN aktif, yang berkorelasi negatif dengan proteinuria dan laju filtrasi glomerulus. Ekspresi miRNA ini meningkat setelah pengobatan lengkap, yang menunjukkan hubungan dekatnya dengan stadium klinis LN. 191 Eksosom urin miR-146a, melalui regulasi negatifnya terhadap TRAF6 dan IRAK1, terkait erat dengan aktivitas lupus, proteinuria, dan fitur histologis. Ia dapat membedakan pasien LN, khususnya menunjukkan akurasi tinggi dalam membedakan pasien LN aktif. 192 Selain itu, Li et al. menemukan profil ekspresi miRNA yang unik pada pasien LNIV dengan sabit seluler bersamaan (LNIV-CC). Di antara mereka, miR-146a-5p, miR-654-5p, dan miR-3135b dalam eksosom urin berfungsi sebagai penanda diagnostik non-invasif untuk LNIV-CC. 193 Eksosom urin tRF3-Ile AAT-1 dan tiRNA5-Lys-CTT-1 yang diekspresikan secara signifikan menunjukkan kemampuan diskriminatif presisi tinggi antara pasien SLE dengan dan tanpa LN. Bila dikombinasikan dengan indikator klinis eGFR, keduanya menunjukkan nilai diagnostik yang lebih besar, dengan AUC sebesar 0,838. 194
Tidak hanya ada hubungan antara ekspresi miRNA eksosomal urin dan LN, tetapi darah juga berfungsi sebagai media penting untuk memfasilitasi sirkulasi eksosom dan transfer molekul pensinyalan sel ke berbagai bagian tubuh. Sebuah studi observasional kasus-kontrol cross-sectional menunjukkan bahwa kadar plasma miR-221-5p, miR-380-3p, miR-556-5p, miR-758-3p, dan miR-3074-3p merupakan biomarker diagnostik potensial untuk LN pada pasien lupus eritematosus sistemik (SLE). Sensitivitas rata-rata adalah 97%, spesifisitas 70,3%, nilai prediktif positif 82,5%, dan efisiensi diagnostik 87,9%. 232 Tan dkk. mengamati korelasi negatif antara kadar miR-451a eksosomal serum dan kadar protein urin 24 jam serta skor SLEDAI pada pasien LN. Mereka selanjutnya menemukan bahwa penurunan regulasi ekspresi miR-451a proliferatif adalah yang paling signifikan, yang menunjukkan potensinya sebagai biomarker untuk mendiagnosis secara klinis berbagai jenis patologis LN.195 Dibandingkan dengan kelompok kontrol yang sehat, pasien SLE menunjukkan peningkatan regulasi miR-21 eksosomal serum, miR-155, dan miR-181a, dan penurunan regulasi miR-223. MiRNA ini menunjukkan perbedaan yang signifikan antara pasien LN dan non-LN, dengan miR-21 dan miR-155 berkorelasi positif dengan tingkat keparahan kadar proteinuria. Ekspresi gabungan miR-181a dan miR-223 memiliki nilai diagnostik potensial untuk SLE dan LN. 196 , 197 Pada pasien SLE dengan LN, miRNA eksosomal serum yang meningkat secara signifikan, has-miR-4796-5p dan has-miR-7974, merupakan biomarker yang menjanjikan untuk mendiagnosis LN, menunjukkan potensi yang kuat dengan AUC yang melebihi 0,8. 198 Berdasarkan temuan tersebut di atas, miRNA terkait eksosom dalam cairan biologis dapat berfungsi sebagai biomarker diagnostik untuk SLE/LN dalam pengaturan klinis.
5.9 Transplantasi ginjal
Transplantasi ginjal adalah pengobatan pilihan untuk penyakit ginjal stadium akhir, dan penerima transplantasi memerlukan pemantauan seumur hidup untuk mendeteksi reaksi penolakan alograf. 233 Laporan terbaru menunjukkan bahwa kandungan eksosom dan penanda permukaan berbeda secara signifikan antara pasien dengan reaksi penolakan dan non-penolakan, menjadikannya biomarker prediktif atau diagnostik baru yang potensial di bidang transplantasi. Lim et al. melakukan studi pertama pada biomarker diagnostik proteomik potensial baru yang terkait dengan penolakan akut yang dimediasi sel T (TCMR), di mana Tetraspanin-1 dan Hemopexin ditemukan meningkat secara signifikan dalam urin pasien TCMR dibandingkan dengan mereka yang tidak memiliki reaksi penolakan di antara penerima transplantasi ginjal. 199 Jung et al. mengamati peningkatan yang signifikan dalam kadar zinc-alpha-2-glikoprotein (AZGP1) pada pasien dengan penolakan kronis yang dimediasi antibodi aktif (CAMR), dibandingkan dengan kelompok kontrol tanpa penolakan, menunjukkan AZGP1 sebagai biomarker protein yang spesifik dan sensitif untuk CAMR melalui analisis proteomik. 200 Dalam penolakan yang dimediasi antibodi (AMR), transkrip mRNA dalam eksosom plasma menunjukkan ekspresi berlebih. Oleh karena itu, profil transkrip mRNA gp130, SH2D1B, TNF α , dan CCL4 dapat berfungsi sebagai biomarker prediktif dan diagnostik untuk AMR. 201 Pada pasien dengan penolakan seluler akut terhadap alograf ginjal, eksosom urin positif CD3 biasanya diekspresikan berlebihan oleh limfosit T, dengan nilai AUC, sensitivitas, spesifisitas, dan akurasi masing-masing sebesar 0,911, 0,928, 0,875, dan 0,900. 202 Sejak awal tahun 2013, Alvarez dkk. menemukan pengayaan neutrophil gelatinase-associated lipocalin (NGAL) dalam fraksi eksosomal urin dari pasien dengan fungsi graft tertunda (DGF) setelah transplantasi ginjal, yang menunjukkan bahwa NGAL eksosomal urin dapat berfungsi sebagai biomarker untuk cedera pascatransplantasi atau fungsi graft tertunda. 203 Dalam beberapa tahun terakhir, Wang dkk. telah mengamati ekspresi spesifik miRNA pada pasien dengan DGF, termasuk has-miR-33a-5p_R-1, has-miR-98-5p, dan has-miR-151a-5p. Di antara mereka, ekspresi has-miR-151a-5p berkorelasi positif secara signifikan dengan kadar SCr, nitrogen urea darah, dan asam urat pada pasien. 204 Dalam pengembangan karakteristik mRNA eksosomal urin, penelitian telah mengidentifikasi tanda tangan multigen (CD74, C3, CXCL11, CD44, dan IFNAR2) yang mampu membedakan antara TCMR dan penolakan yang dimediasi antibodi (ABMR). Kelima gen tersebut diekspresikan secara berlebihan dalam ABMR, dengan AUC sebesar 0,87. 205Secara keseluruhan, data ini menunjukkan bahwa eksosom dapat secara efektif mencerminkan status cangkokan, dan terdapat perbedaan yang signifikan antara eksosom pasien dengan reaksi penolakan dan mereka yang tidak. Namun, untuk menetapkan peran eksosom sebagai biomarker prediktif atau diagnostik bagi penerima transplantasi, diperlukan penelitian lebih lanjut dengan ukuran sampel yang lebih besar yang berfokus pada penelitian eksosomal yang serupa.
6. POTENSI TERAPEUTIK EKSOSOM
Eksosom, sebagai alat terapi baru, memiliki potensi untuk memodulasi perkembangan penyakit dan pemberian obat (Gambar 4 ). Bukti yang semakin banyak menunjukkan bahwa eksosom memiliki efek perlindungan ginjal dengan mentransfer molekul bioaktif dari sel donor ke sel penerima, sehingga mengubah ekspresi gen dan respons biologis sel penerima untuk memengaruhi perjalanan penyakit. 234 , 235
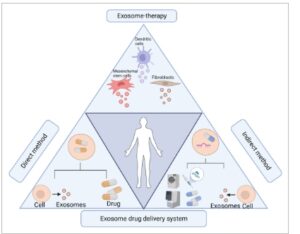
GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
Eksosom dalam pengobatan. Dalam uji klinis, eksosom yang berasal dari sel punca mesenkimal, fibroblas, dan sel dendritik telah digunakan untuk pengobatan berbagai penyakit ginjal. Selain itu, eksosom sangat menjanjikan sebagai pembawa alami dalam sistem penghantaran obat. Dalam pendekatan langsung, eksosom diisi dengan agen terapeutik, sementara metode tidak langsung melibatkan rekayasa genetika, modifikasi kimia, dan teknik fisik yang diterapkan pada sel atau eksosom yang sesuai untuk menghasilkan eksosom terapeutik buatan.
Sel punca mesenkimal (MSC), sel fibroblas, sel dendritik, dan eksosom yang berasal dari sel progenitor endotel merupakan sumber yang menjanjikan untuk eksosom terapeutik. 236 , 237 Mengambil MSC-Exos sebagai contoh, eksosom ini mengurangi cedera ginjal melalui efek parakrin dan menunjukkan predileksi terhadap ginjal yang rusak (Gambar 5 ). 238 – 240 Misalnya, uji klinis telah menunjukkan model in vivo bahwa Zhang et al. mengidentifikasi peran jalur pensinyalan miR-146a-5p/TRAF6 dalam imunomodulasi yang dimediasi UC-MSC, mengendalikan polarisasi makrofag, sehingga menghambat peradangan ginjal dan memulihkan fungsi ginjal. 241 MiRNA-122a yang berasal dari MSC sumsum tulang dapat memperbaiki struktur ginjal yang terganggu dan mengurangi fibrosis ginjal dengan memodulasi transduksi pensinyalan mTOR dan autofagi. 242 Lebih jauh lagi, Human umbilical cord MSC-Exos memperbaiki AKI iskemik dan mendorong perbaikan tubulus ginjal dengan menargetkan penangkapan siklus sel dan apoptosis TEC ginjal melalui jalur miR-125b-5p/p53. 243 Potensi diferensiasinya juga patut diperhatikan, karena MSC dapat digunakan untuk membudidayakan sel ginjal secara eks vivo untuk menggantikan sel asli yang rusak. Dalam kondisi tertentu, sel-sel ini telah berhasil dikultur menjadi struktur organoid tiga dimensi dengan fitur kompleks unit ginjal dan karakteristik fungsional dalam waktu 4 minggu. 244 Lebih jauh lagi, dalam model tikus cedera iskemia/reperfusi, pemberian MSC mengakibatkan diferensiasinya menjadi TEC ginjal, yang menginduksi integritas struktural jaringan dan pemulihan jaringan, 245 yang menyoroti peran penting MSC-Exos dalam pengobatan regeneratif ginjal.
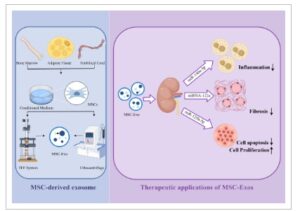
GAMBAR 5
Buka di penampil gambar
Kekuatan Gambar
Ringkasan sumber sel MSC-Exos, pendekatan isolasi, dan pemanfaatannya dalam penyakit ginjal. MSC yang diisolasi dari jaringan adiposa, sumsum tulang, atau tali pusat berfungsi sebagai sumber eksosom terapeutik. Eksosom ini sebagian besar diisolasi dan dimurnikan menggunakan sistem ultrasentrifugasi dan filtrasi aliran tangensial. MSC-Exos yang terlibat dalam pengobatan penyakit ginjal memiliki kapasitas untuk memodulasi respons inflamasi, fibrosis, proliferasi sel, dan apoptosis, di antara fungsi lainnya.
Penemuan eksosom sebagai pembawa alami untuk berbagai senyawa sintetis dan biomolekul dalam terapi sel telah memicu minat besar di bidang penghantaran obat, menawarkan beberapa karakteristik yang diinginkan untuk sistem penghantaran obat, seperti biokompatibilitas, sitotoksisitas rendah, stabilitas biologis, dan imunogenisitas rendah. 53 , 246 , 247 Karena komposisi membran selnya, eksosom dapat melekat pada sel target melalui repertoar protein adhesi permukaan dan ligan pembawa (tetraspanin, integrin, dan molekul MHC), 20 secara efektif mengirimkan muatannya ke sel target. Pemuatan kargo terapeutik ke dalam eksosom melibatkan perakitan langsung, seperti mencampur obat secara langsung dengan eksosom yang diisolasi. 248 Di sisi lain, fleksibilitas struktural eksosom memungkinkan berbagai metode untuk memodifikasi konfigurasi aslinya, termasuk rekayasa genetika, prosedur kimia, teknik fisik, dan teknologi mikrofluida, yang memungkinkan perakitan tidak langsung untuk memuat kargo tambahan ke dalam eksosom. 249 Untuk mengirimkan eksosom terapeutik ke sel atau jaringan target, strategi penargetan pasif atau aktif dapat digunakan. Penargetan pasif memanfaatkan tropisme sel alami eksosom, sementara penargetan aktif mencapai pengiriman eksosom spesifik melalui teknik seperti rekayasa permukaan. 234 , 250
Berdasarkan eksosom, ada banyak pendekatan dan aplikasi terapeutik baru.251 – 253 Selain itu , penerapan vesikel intraseluler dalam pengobatan translasi dan pengaturan klinis tidak boleh diabaikan.254 Batas yang menjanjikan namun kurang dieksplorasi ini menjamin perhatian kita untuk penyelidikan dan eksplorasi lebih lanjut.
7 KESIMPULAN DAN PERSPEKTIF MASA DEPAN
Penelitian tentang eksosom merupakan salah satu bidang yang paling menarik dalam biologi sel, dan studi yang terkait dengan penyakit ginjal terus meningkat. Seperti yang dibahas sebelumnya, eksosom memainkan peran penting sebagai muatan vesikular yang membawa dan mentransfer molekul komunikasi dan sinyal antarsel. Eksosom secara aktif berpartisipasi dalam berbagai fungsi yang penting untuk fungsi ginjal normal dan memainkan peran penting dalam mendorong dan menangkal respons fisiologis dan patologis yang berhubungan dengan ginjal. Seiring dengan semakin jelasnya peran eksosom dalam jalur penyakit, eksosom semakin banyak dikembangkan untuk tujuan terapeutik dan diagnostik. Meskipun tidak ada produk eksosom klinis yang disetujui FDA, jumlah uji klinis yang sedang berlangsung yang melibatkan terapi dan diagnostik berbasis eksosom terus meningkat.
Dalam beberapa tahun terakhir, di bidang nefrologi, potensi eksosom sebagai sumber biomarker penting telah diakui secara luas oleh banyak lembaga penelitian. Langkah penting berikutnya adalah beralih dari penemuan ke aplikasi. Kemajuan dalam teknologi dan analisis komputasi telah membuat biopsi cair semakin sensitif, spesifik, dan akurat. Kemajuan ini menandai era baru pengobatan presisi, yang bertujuan untuk pengobatan penyakit ginjal yang dipersonalisasi, skrining dini, diagnosis dan prognosis yang akurat, deteksi kekambuhan, pemantauan longitudinal, dan pemilihan obat. Eksosom, sebagai biomarker yang sangat menjanjikan di bidang biopsi cair, memiliki potensi besar untuk diagnosis dini dan penentuan penyebab yang lebih tepat. Deteksi dini perubahan kadar biomarker eksosomal dapat mendahului diagnosis klinis dan memandu stratifikasi kasus, sehingga memungkinkan intervensi dini yang tepat waktu untuk memperlambat perkembangan penyakit ginjal. Selain nilai diagnostiknya, eksosom dapat memprediksi stadium dan tingkat keparahan penyakit pada pasien, menginformasikan strategi pengobatan, dan memfasilitasi pemantauan berkelanjutan terhadap kemanjuran terapi. Namun, penerapan eksosom sebagai biomarker ke dalam praktik klinis untuk penyakit ginjal saat ini masih kurang. Salah satu tantangan utama yang harus diatasi adalah kurangnya konsensus dalam metode isolasi eksosom. Untuk memfasilitasi penerapan klinis eksosom, sangat penting untuk menstandardisasi pengumpulan sampel cairan tubuh dan lebih mengoptimalkan metode isolasi atau mengembangkan teknologi baru untuk mengisolasi eksosom secara lebih efektif. Perlu dicatat juga bahwa signifikansi translasi dari sebagian besar temuan penelitian sangat bergantung pada pemilihan bahan biologis yang tepat dari kelompok pasien yang homogen dengan fitur klinis, stadium penyakit, dan latar belakang etnis yang serupa. Oleh karena itu, uji klinis dan validasi dalam kelompok besar masih diperlukan untuk memberikan dukungan data medis yang substansial untuk translasi klinis. Lebih jauh, ekspresi eksosom tertentu yang tidak teratur pada penyakit lain menunjukkan bahwa molekul-molekul ini mungkin tidak memiliki spesifisitas penyakit yang memadai dan tidak dapat digunakan sebagai biomarker. Untuk mengatasi masalah ini, analisis gabungan menggunakan eksosom, miRNA, dan protein sebagai biomarker dapat digunakan untuk meningkatkan sensitivitas dan spesifisitas uji diagnostik dan memfasilitasi penggunaannya sebagai biomarker. Investigasi ketat untuk mendeteksi dan mengkarakterisasi eksosom akan semakin meningkatkan pemahaman kita tentang peran berbeda mereka dalam kesehatan dan penyakit, menawarkan wawasan baru tentang asal, diagnosis, dan pilihan pengobatan untuk gangguan ginjal.

