
Abstrak
Sistein adalah asam amino yang sangat terkonservasi dengan beragam peran dalam fungsi protein. Sementara perannya dalam pembentukan jembatan disulfida dicirikan dengan baik, kontribusi sistein terisolasi dalam pelipatan protein sebagian besar belum dieksplorasi. Di sini kami menyelidiki dampak residu sistein pada jalur pelipatan domain MATH dalam protein SPOP dengan membandingkan mutan tipe liar dan serin. Melalui analisis kinetik, kami menunjukkan bahwa residu sistein yang terkubur menstabilkan baik perantara pelipatan awal maupun keadaan transisi utama. Terutama, efek tersebut terganggu setelah substitusi dengan serin tetapi dipertahankan dengan alanin. Temuan ini menunjukkan bahwa, dalam konteks struktural tertentu, sistein berperilaku sebagai residu hidrofobik daripada residu polar. Hasil kami menantang klasifikasi tradisional sistein sebagai asam amino polar dan menyoroti kontribusinya yang unik terhadap pelipatan protein, dengan implikasi untuk rekayasa protein dan biologi struktural.
1. PENDAHULUAN
Sistein adalah asam amino yang sangat serbaguna yang, meskipun kelimpahannya relatif rendah di banyak organisme, telah dilestarikan sepanjang evolusi. Faktanya, bersama dengan glisin, prolin, dan triptofan, sistein mewakili residu yang paling terkonservasi secara evolusi (Marino & Gladyshev, 2010 ; Marino & Gladyshev, 2011 ). Konservasi evolusioner seperti itu menggarisbawahi peran sistein yang beragam dalam protein yang mencakup dari katalisis, regulasi, stabilisasi struktural, hingga pengikatan kofaktor (Marino & Gladyshev, 2012 ). Lebih jauh lagi, kemampuan untuk membentuk jembatan disulfida sangat signifikan, karena ikatan ini berfungsi sebagai satu-satunya koneksi kovalen alami antara untai polipeptida yang terpisah serta dalam rantai polipeptida tunggal, yang berkontribusi secara kritis terhadap stabilitas struktur protein (Sevier & Kaiser, 2002 ).
Klasifikasi kimia dan fisik Cys sering kali menjadi subjek perdebatan, khususnya mengenai apakah itu harus dianggap hidrofobik atau polar (Fersht & Dingwall, 1979 ; Kyte & Doolittle, 1982 ; Nagano et al., 1999 ; Rose, 1978 ; Sevier & Kaiser, 2002 ; Taylor, 1986 ; Wimley & White, 1996 ). Meskipun banyak buku teks yang secara dangkal mengklasifikasikan Cys sebagai asam amino polar, analisis struktural tampaknya menunjukkan bahwa sistein dapat berperilaku sebagai residu hidrofobik, yang sangat sering terkubur dalam inti nonpolar suatu protein. Memang, analisis dari 15.000 struktur Protein Data Bank (PDB) acak mengungkapkan bahwa sistein yang terisolasi mewakili asam amino yang paling terkubur, diikuti oleh Ile, Val, dan Ala (Marino & Gladyshev, 2010 ).
Dalam konteks pelipatan protein, peran sistein terisolasi sebagian besar telah diabaikan. Faktanya, sementara banyak karya eksperimental dan komputasional telah membahas peran jembatan S–S dalam pelipatan (Johnson et al., 1997 ; Parrini et al., 2008 ; Pecher & Arnold, 2009 ; Sanchez-Romero et al., 2013 ; Vogl et al., 1995 ), terutama menyoroti stabilisasi entropi mereka terhadap keadaan terdenaturasi, ketidakmampuan untuk menghasilkan mutasi konservatif Cys secara umum telah menghalangi penyertaan residu ini dalam karya mutasi (Fersht, 2024 ; Fersht & Sato, 2004 ). Lebih jauh lagi, untuk menghindari multimerisasi yang tidak diinginkan secara in vitro, sistein sering kali digantikan dengan serin, berdasarkan asumsi bahwa sulfur dan oksigen memiliki sifat kimia yang serupa (Smertina et al., 2022 ; Smith et al., 2021 ; van der Lee et al., 2014 ; Xia et al., 2015 ).
Seperti serin, sistein dapat membentuk ikatan hidrogen dan sebagian besar tetap terprotonasi pada pH fisiologis. Namun, menurut skala elektronegativitas Linus Pauling (di mana oksigen, sulfur, dan hidrogen masing-masing memiliki nilai 3,44, 2,58, dan 2,2) (Pauling, 1932 ), gugus hidroksil membentuk ikatan kovalen polar karena perbedaan elektronegativitas 1,24 antara oksigen dan hidrogen, sedangkan perbedaan elektronegativitas yang lebih kecil sebesar 0,4 pada gugus tiol mengklasifikasikannya sebagai ikatan kovalen nonpolar. Mengingat elektronegativitas karbon sebesar 2,55, ikatan SH dalam tiol lebih menyerupai ikatan CH dalam hal karakteristik polaritas, daripada ikatan OH dalam gugus hidroksil. Oleh karena itu, perilaku Cys harus lebih sesuai dengan residu hidrofobik—suatu kesimpulan yang, hingga saat ini, secara mengejutkan, kurang dikarakterisasi.
Untuk menyimpulkan peran sistein dalam pelipatan, kami meneliti di sini jalur pelipatan domain MATH dari protein SPOP (MATH), yang berisi empat Cys terisolasi, sebagai studi kasus. Kami menunjukkan bahwa salah satu Cys ini bertanggung jawab untuk stabilisasi perantara pelipatan awal dan keadaan transisi utama, yang sangat tidak stabil ketika Cys digantikan oleh serin. Sebaliknya, mengganti Cys dengan alanin tidak mengganggu stabilitas keadaan metastabil ini, memberikan indikasi yang jelas tentang sifat hidrofobik Cys tersebut. Efek seperti itu telah lolos dari upaya sebelumnya untuk mengkarakterisasi pelipatan domain yang sama melalui analisis mutasi (Marsden et al., 2018 ). Seperti dibahas di bawah, penyelidikan ini memungkinkan penyediaan wawasan baru tentang peran sistein dalam pelipatan protein dan menantang asumsi tradisional mengenai klasifikasi polar atau nonpolarnya dalam bagian protein.
2 HASIL DAN PEMBAHASAN
Mekanisme kinetik pelipatan domain MATH sebelumnya telah dikarakterisasi secara ekstensif dengan menggunakan sinergi antara kinetika aliran terhenti dan mutagenesis terarah-situs/permutasi melingkar (Marsden et al., 2018 ). Secara singkat, diamati bahwa pelipatan berlangsung dengan akumulasi perantara yang sangat padat dan terlipat sebagian. Karena kompleksitas data pelipatan, karakterisasi perantara tersebut tidak dapat dicapai secara menyeluruh, dan pekerjaan mutasi dianalisis dalam kondisi yang sedikit tidak stabil (3 M GdnHCl), di mana perantara tidak terisi, dan difokuskan terutama pada keadaan transisi utama pelipatan. Semua percobaan dilakukan dengan adanya DTT, sehingga menghindari pembentukan ikatan S–S antarmolekul yang tidak diinginkan.
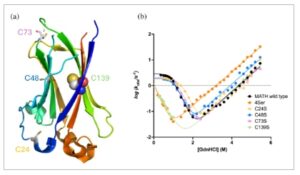
Untuk mengeksplorasi peran masing-masing dari keempat Cys dalam pelipatan MATH, kami menghasilkan varian yang diarahkan ke situs masing-masing di mana masing-masing dari mereka digantikan dengan Ser, yaitu C24S, C48S, C73S, dan C139S. Selain itu, varian kuadrupel di mana semua Cys bermutasi menjadi Ser, bernama 4Ser, juga diekspresikan dan dimurnikan. Struktur MATH (Usher et al., 2021 ), yang menyoroti keempat residu sistein, dilaporkan dalam Gambar 1a .
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Efek mutasi Cys dalam pelipatan MATH. (a) Struktur tiga dimensi domain MATH (PDB: 2CR2) dengan residu sistein yang disorot pada posisi 24, 48, 73, dan 139. Seperti yang dijelaskan secara rinci dalam teks, sistein yang terkubur pada posisi 139, yang disorot dalam bentuk bola, merupakan elemen kunci dalam stabilisasi keadaan antara dan transisi pelipatan. (b) Eksperimen pelipatan kinetik MATH tipe liar dan variannya: 4Ser, C24S, C48S, C73S, C139S. Sementara plot chevron tipe liar, C24S, C48S, dan C73S konsisten dengan mekanisme tiga keadaan (seperti yang terlihat dari kelengkungan yang menonjol pada konsentrasi denaturan rendah), dalam kasus C139S dan 4Ser, datanya konsisten dengan skenario berbentuk V dua keadaan. Percobaan dilakukan dengan menggunakan alat pengaduk tunggal SX-18 dengan aliran terhenti (Applied Photophysics), dalam buffer 50 mM Hepes pH 7,5 dengan 10 mM DTT pada suhu 37°C, menggunakan guanidin hidroklorida sebagai denaturan. Emisi fluoresensi diukur dengan filter kaca potong 360 nm, menggunakan panjang gelombang eksitasi 280 nm. Setidaknya lima jejak individu diperoleh dan kemudian dirata-ratakan untuk setiap konsentrasi denaturan. Plot chevron dipasangkan dengan persamaan tiga keadaan, kecuali untuk varian 4Ser dan C139S, yang dipasangkan dengan persamaan dua keadaan.
Bahasa Indonesia: Dalam analogi dengan karya sebelumnya oleh Clarke dan rekan kerja (Marsden et al., 2018 ), kinetika pelipatan dan pembukaan lipatan MATH dan variannya diselidiki dengan aliran terhenti, dipicu oleh pengenceran 11 kali lipat protein terdenaturasi atau protein asli ke dalam buffer yang sesuai, dan semua eksperimen dilakukan dengan adanya DTT. Dalam semua kasus, rangkaian waktu pelipatan dan pembukaan lipatan keduanya dipasang secara memuaskan pada peluruhan eksponensial tunggal pada setiap konsentrasi denaturan akhir. Plot semilogaritmik dari konstanta laju pelipatan dan pembukaan lipatan versus konsentrasi denaturan (plot chevron) MATH tipe liar, C24S, C48S, C73S, dan C139S dan 4Ser dilaporkan dalam Gambar 1b . Menariknya, sementara plot chevron dari wt, C24S, C48S, dan C73S menampilkan kelengkungan yang jelas (roll-over) di cabang pelipatan ulang dan konstanta laju yang pada dasarnya tidak berubah, dalam kasus C139S, pelipatan sangat diperlambat dan pelipatan ulang tampak linier. Hebatnya, lengan pelipatan 4Ser sangat mirip dengan C139S, yang menunjukkan bahwa gangguan kinetika pelipatan dapat secara univokal dikaitkan dengan mutasi Cys139 menjadi Ser.
Kehadiran kelengkungan dalam plot chevron merupakan tanda khas dari perantara sementara (Gautier et al., 2020 ; Gianni et al., 2007 ; Matouschek et al., 1990 ; Parker et al., 1995 ; Travaglini-Allocatelli et al., 2003 ). Oleh karena itu, hilangnya kelengkungan yang jelas yang diamati dalam kasus varian C139S dan 4Ser dengan jelas menunjukkan bahwa Cys139 sangat penting dalam organisasi struktural keadaan metastabil tersebut. Secara analogis, penurunan yang luar biasa dari konstanta laju pelipatan yang terkait dengan keadaan transisi utama hampir 2 orde besaran menunjukkan bahwa Cys139 juga menstabilkan keadaan transisi pelipatan utama. Kesimpulan ini sejalan dengan apa yang sebelumnya disarankan oleh Clarke dan rekan kerja, yang menyarankan keadaan transisi pelipatan MATH terutama distabilkan oleh interaksi antara untai N- dan C-terminal (Marsden et al., 2018 ), dengan Cys139 terletak di yang terakhir (Gambar 1a ). Namun, kami mencatat, meskipun merupakan mutasi “konservatif” yang jelas, C139S menunjukkan perubahan paling luar biasa dalam konstanta laju pelipatan, dibandingkan dengan semua 35 varian yang dikarakterisasi sebelumnya, yang menunjukkan bahwa residu ini mewakili elemen kunci dalam stabilisasi keadaan antara dan transisi.
Berdasarkan hasil yang disorot di atas, dapat disimpulkan bahwa Cys139 yang terkubur memiliki peran kunci dalam menstabilkan pelipatan antara dan keadaan transisi. Untuk menyelidiki apakah stabilisasi tersebut dapat dikaitkan dengan sifat hidrofobik sistein yang terkubur, kami melakukan dua percobaan kunci. Pertama, kami membandingkan perilaku pelipatan protein tipe liar dan mutan C139S dalam kondisi pH netral dan basa. Kedua, kami mengganti C139 dengan alanin untuk menilai dampaknya pada pelipatan ulang protein.
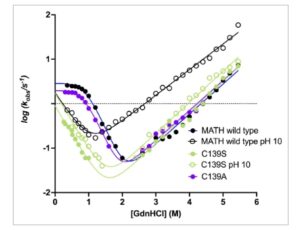
Asam amino, seperti molekul lainnya, mengandung gugus yang dapat terionisasi (misalnya, –OH, –NH₂, –SH) yang dapat mengubah keadaan protonasinya tergantung pada pH larutan. Dengan menyesuaikan pH di atas atau di bawah pKa rantai samping tertentu, maka dimungkinkan untuk memodulasi keadaan protonasinya. Mengingat bahwa pKa sistein kira-kira 9,5, pada pH 10, gugus tiol kemungkinan terdeprotonasi, membentuk ion tiolat. Bentuk tiolat menunjukkan karakteristik yang jauh lebih polar, mirip dengan serin, dan tidak dapat bertindak sebagai rantai samping hidrofobik. Plot chevron dari MATH tipe liar yang diukur pada pH 10 dilaporkan dalam Gambar 2. Hebatnya, plot chevron pada pH 10 menunjukkan destabilisasi yang jelas dari zat antara dan tampaknya kembali ke mekanisme pelipatan dua-keadaan, dengan lengan pelipatan ulang yang diamati sangat mirip dengan C139S dan 4S. Selain itu, gangguan pelipatan yang disebabkan oleh pH basa sepenuhnya ditiadakan dalam kasus C139S, yang mengembalikan chevron yang hampir identik pada pH basa dan netral (Gambar 2 ). Oleh karena itu, tampak bahwa deprotonasi Cys139 mengganggu kemampuannya untuk menstabilkan perantara pelipatan dengan bertindak sebagai residu hidrofobik dan ketika Cys139 digantikan oleh serin, yang secara inheren bersifat polar, mekanisme pelipatan tetap tidak terpengaruh terlepas dari pH.
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Perbandingan percobaan pelipatan kinetik MATH tipe liar (lingkaran hitam) dan varian C139S (lingkaran hijau), C139A (lingkaran ungu) dilakukan dalam buffer 50 mM Hepes pH 7,5 dan dalam buffer 50 mM CHES pH 10 yang keduanya dilengkapi dengan 10 mM DTT pada suhu 37°C. Plot chevron MATH tipe liar pada pH 10 dan mutan C139S, dalam kedua kondisi percobaan, disesuaikan dengan persamaan dua keadaan, sementara MATH tipe liar dan mutan C139A pada pH 7,5 disesuaikan dengan persamaan tiga keadaan.
Seperti yang diantisipasi di atas, untuk membuktikan lebih lanjut sifat hidrofobik Cys139 dalam struktur MATH, kami mensubstitusinya dengan alanin dan menjadikannya subjek percobaan pelipatan dan pembukaan. Yang menggembirakan kami, varian C139A menampilkan kinetika pelipatan dan pembukaan yang hampir identik jika dibandingkan dengan protein tipe liar (Gambar 2 ). Temuan ini memberikan bukti tegas bahwa Cys139 berperilaku sebagai residu hidrofobik dalam struktur MATH. Sebagai catatan tambahan, varian yang sama juga diekspresikan dalam referensi (Marsden et al., 2018 ) dan mengembalikan hasil yang hampir identik seperti yang dilaporkan dalam karya ini, namun kegagalan untuk menyelidiki secara rinci sifat hidrofobik C139 sebelumnya telah menyembunyikan perannya dalam stabilisasi perantara pelipatan dan keadaan transisi.
Hasil yang dijelaskan dalam karya ini sangat menarik setidaknya dalam dua hal. Pertama, kami menunjukkan bahwa sistein yang terkubur mungkin memiliki peran penting dalam menstabilkan perantara pelipatan dan keadaan transisi. Sementara banyak penelitian sebelumnya berfokus pada peran jembatan S–S dalam membentuk entropi keadaan terdenaturasi (Johnson et al., 1997 ; Parrini et al., 2008 ; Pecher & Arnold, 2009 ; Sanchez-Romero et al., 2013 ; Vogl et al., 1995 ), kontribusi sistein yang diisolasi terhadap stabilitas pelipatan sebagian besar masih belum dieksplorasi. Temuan kami menunjukkan bahwa bahkan tanpa adanya ikatan disulfida, sistein yang terkubur dapat memberikan efek stabilisasi yang signifikan pada perantara pelipatan sementara, yang menekankan pentingnya fungsionalnya di luar kimia redoks. Kedua, hasil kami memberikan tantangan tambahan pada klasifikasi tradisional sistein sebagai asam amino polar dan menganjurkan pemahaman yang lebih bernuansa tentang perilakunya dalam protein. Kami menyoroti keterbatasan asumsi umum bahwa sistein dapat langsung digantikan oleh serin dengan cara yang konservatif dan menggarisbawahi kontribusi struktural dan fungsional sistein yang unik. Temuan ini dapat memiliki implikasi yang lebih luas untuk rekayasa protein dan studi pelipatan, khususnya dalam desain protein yang mengandung sistein.
3 BAHAN DAN METODE
3.1 Ekspresi dan pemurnian protein
Konstruksi yang mengkode MATH wildtype (dibeli dari Eurofins Genomics) dan semua varian Serine (4Ser) disubkloning dalam vektor pHTP1, yang sebelumnya dijelaskan dalam https://www.nzytech.com/en/mb282-nzyeasy-cloning-expression-kit-i/ . Empat varian C24S, C48S, C73S, dan C139S, yang berhubungan dengan substitusi residu sistein tunggal ke Serine, serta varian C139A, masing-masing dihasilkan menggunakan QuikChange Lightning Mutagenesis Kit (Agilent technologies, Inc., Santa Clara, CA, USA) mengikuti petunjuk pabrik. Primer dibeli dari Eurofins Genomics, dan sekuens semua konstruksi dikonfirmasi oleh sekuensing DNA. Semua konstruksi yang mengkode varian MATH disubkloning dalam vektor plasmid pHTP1 dan kemudian ditransformasikan dalam sel Escherichia coli BL21 (DE3). Sel bakteri ditumbuhkan dalam medium LB, yang mengandung 30 μg/mL kanamisin, pada suhu 37°C hingga OD600 = 0,7–0,8, dan kemudian ekspresi protein diinduksi dengan 1 mM IPTG. Setelah induksi, sel ditumbuhkan pada suhu 25°C semalaman dan kemudian dikumpulkan menggunakan sentrifugasi (10 menit, 5000 rpm). Untuk memurnikan protein berlabel His, pelet disuspensikan kembali dalam buffer yang terbuat dari 50 mM Tris–HCl, 300 mM NaCl, dan 10 mM Imidazole, pH 7,5, dan dengan penambahan tablet antiprotease (cOmplete, bebas EDTA, Roche Diagnostics GmbH, Mannheim, Jerman), kemudian disonikasi dan disentrifugasi. Fraksi yang larut dari lisat sel bakteri dimasukkan ke dalam kolom HisTrap Chelating HP (GE Healthcare Bio-Sciences AB, Uppsala, Swedia) bermuatan nikel yang diseimbangkan dengan buffer yang sama. Setiap varian protein kemudian dielusi dengan gradien dari 0 hingga 1 M imidazol dengan menggunakan sistem ÄKTA-prime. Fraksi yang mengandung protein dikumpulkan, dan buffer ditukar dengan 50 mM Tris–HCl dan 300 mM NaCl, pH 7,5, menggunakan kolom desalinasi HiTrap (GE Healthcare). Kemurnian semua varian protein dinilai melalui SDS-PAGE.
3.2 Percobaan kinetika pelipatan (pelepasan) aliran terhenti
Percobaan kinetika (pelepasan) lipatan dilakukan pada peralatan aliran-terhenti Applied Photophysics Pi-star 180, memantau perubahan emisi fluoresensi, mengeksitasi sampel pada 280 nm, dan merekam emisi fluoresensi dengan menggunakan filter kaca potong 320 nm. Percobaan dilakukan pada 298 K, dengan menggunakan penyangga pada pH netral (penyangga Tris–HCl pH 7,5) dan basa (penyangga CHES pH 10) dengan Guanidinium klorida (GdnCl) sebagai agen denaturan. Konsentrasi protein akhir biasanya 2 μM. Untuk setiap konsentrasi denaturan, setidaknya lima jejak individu dirata-ratakan. Semua rangkaian waktu yang diamati dianalisis dengan fase eksponensial tunggal menggunakan prosedur pemasangan yang disediakan oleh perangkat lunak Applied Photophysics.

