
ABSTRAK
Bisa ular kobra Afrika ( Naja spp.) mengandung racun yang didominasi oleh protein dan peptida dengan variasi antar dan intraspesifik. Ada beberapa obat yang disetujui FDA dari racun bisa ular dari wilayah lain, termasuk Amerika Selatan dan Asia. Pembuatan profil proteom bisa ular kobra Afrika yang penting secara medis dari lokasi yang berbeda akan membantu dalam mengembangkan agen antikanker yang lebih efektif. Bisa ular kobra yang meludah ( Naja pallida dan Naja nigricincta woodi ) dan ular kobra yang tidak meludah dari subgenus Uraeus ( Naja anchietae , Naja annulifera , dan Naja nivea ) difraksinasi dengan kromatografi cair kinerja tinggi fase terbalik (RP-HPLC). Dengan menggunakan LC–MS/MS bebas label, racun bisa diidentifikasi dan dikelompokkan ke dalam famili berdasarkan kelimpahan relatifnya. Sitotoksisitas bisa dari sampel mentah dan terfraksinasi diuji dalam lini sel karsinoma pankreas (MIA PaCa-2) menggunakan uji Alamar Blue. Analisis viabilitas sel mengungkap efek sitotoksik dari bisa ular kobra yang meludah terhadap lini sel MIA PaCa-2 dibandingkan dengan sel MRC-5 normal. Sebaliknya, bisa ular kobra yang tidak meludah tidak menunjukkan aktivitas sitotoksik terhadap sel MIA PaCa-2. Fraksi bisa RP-HPLC terpilih dari ular kobra yang meludah mengungkap bahwa Fraksi 6 N. pallida dan Fraksi 9 N. n. woodi pada tingkat minimal bersifat sitotoksik terhadap sel MIA PaCa-2. Data LC–MS/MS memperlihatkan bahwa sementara Fraksi 6 N. pallida didominasi oleh fosfolipase 2 CM-III basa dan Sitotoksin 2, Fraksi 9 N. n. woodi didominasi oleh fosfolipase 2 CM-III basa, fosfolipase 2 CM-II basa, dan Sitotoksin 3. Fraksi-fraksi ini akan dimurnikan dan dipelajari untuk menentukan mekanisme di balik sitotoksisitas yang mendasarinya terhadap sel MIA PaCa-2.
1 Pendahuluan
Ular kobra Afrika ( Naja spp.) termasuk dalam famili ular Elapidae, yang termasuk di antara ular yang paling luas penyebarannya dan penting secara medis serta berkontribusi terhadap banyak kasus envenomasi gigitan ular (SBE) di Afrika sub-Sahara (Benjamin et al. 2020 ; Gutiérrez et al. 2017 ). Bisa ular ini, di antara racun lainnya, didominasi oleh racun tiga jari (3FTX) dan menyebabkan patologi termasuk nekrosis jaringan, kardiotoksisitas, dan neurotoksisitas (Offor et al. 2022 ). Tiga subgenus ular kobra Afrika meliputi Afronaja (ular kobra meludah Afrika), Boulengerina dan Uraeus (ular kobra tidak meludah Afrika), dengan karakteristik yang serupa dan berbeda (Wallach et al. 2009 ; Wüster et al. 2018 ).
Data pada proteom racun Naja spp. yang tersedia mengungkapkan bahwa sementara subgenus Afronaja dan Boulengerina didominasi oleh famili racun 3FTX dan fosfolipase A2 (PLA 2 ), subgenus Uraeus didominasi oleh 3FTX dengan sedikit atau tanpa PLA 2 (Offor dan Piater 2024a ). Envenomasi gigitan ular adalah penyakit tropis terabaikan yang terutama menyerang orang-orang dari daerah tropis dan subtropis di seluruh dunia, terutama di Afrika, Asia, dan Amerika Selatan (Gutiérrez et al. 2017 ; WHO 2019 ). Di Afrika sub-Sahara, diperkirakan ada 1 juta gigitan ular dan ini termasuk 268.471 kasus envenomasi, 12.290 kematian, 14.766 amputasi, dan 55.332 kasus gangguan stres pascatrauma (Halilu et al. 2019 ). Laporan terkini menunjukkan bahwa data tentang keracunan ular dari negara-negara Afrika sub-Sahara seperti Afrika Selatan dan Mozambik diremehkan karena berbagai tantangan, termasuk korban yang tidak melapor ke rumah sakit, dan malah menggunakan tabib tradisional (Berg et al. 2024 ; Farooq et al. 2022 ; Lermer et al. 2023 ). Sejauh ini, antiracun merupakan pengobatan utama saat ini untuk SBE.
Bisa ular mengandung beberapa campuran senyawa yang didominasi oleh protein dan peptida yang berkontribusi terhadap toksisitas. Toksin bisa ular dapat dieksplorasi untuk kemungkinan aplikasi terapeutik dalam pengobatan penyakit, termasuk kanker. Untuk tujuan ini, toksin bisa ular telah diterapkan dalam pengembangan beberapa obat antiperdarahan dan antihipertensi yang disetujui oleh Badan Pengawas Obat dan Makanan AS (FDA), seperti Tirofiban dan Captopril, masing-masing (Cushman dan Ondetti 1991 ).
Lebih jauh lagi, famili toksin bisa ular termasuk disintegrin (DIS), L-amino acid oxidase (LAAO), 3FTX, dan snake venom metalloproteinase (SVMP), telah menunjukkan sifat antikanker terhadap lini sel kanker tertentu dibandingkan dengan lini sel normal (Offor dan Piater 2024b ). Misalnya, peptida miotoksis bisa ular Asp49 PLA 2 (MTX-1) dan Lys49 PLA 2 (MTX-2) dari Bothrops brazili menginduksi sitotoksisitas terhadap lini sel leukemia sel T manusia (JURKAT) (Costa et al. 2008 ), sementara LAAO dari bisa ular Crotalus adamanteus menunjukkan aktivitas antitumor terhadap sel kanker ovarium CAOV3 dan OVCAR3 (Xiong et al. 2022 ). Sejauh pengetahuan kami, hanya PLA 2 crotoxin yang telah lulus uji klinis Fase 1 terhadap berbagai sel kanker (Almeida et al. 2023 ; Cura et al. 2002 ). Hal ini menyoroti perlunya lebih banyak penelitian antikanker, terutama dengan bisa ular yang endemik di Afrika sub-Sahara. Dalam hal ini, Observatorium Kanker Global 2022 (GLOBOCAN) menempatkan kanker pankreas sebagai penyebab kematian terkait kanker ketujuh dan ketiga belas secara global dan di Afrika, masing-masing, dengan tingkat kelangsungan hidup sekitar 5 tahun sebesar 9% (Globocan 2022 ; Lippi dan Mattiuzzi 2020 ; Zhu et al. 2018 ). Penelitian ini bertujuan untuk membuat profil proteom dari bisa dua ekor ular kobra Afrika yang suka meludah ( N. pallida dan N. n. woodi ) dan tiga ekor ular kobra yang tidak suka meludah ( N. anchietae , N. annulifera , dan N. nivea ), dan juga untuk menyelidiki sitotoksisitasnya terhadap lini sel kanker MIA PaCa-2 pankreas.
2 Bahan dan Metode
2.1 Racun
Sampel racun yang dibekukan dalam keadaan beku dari dua ekor ular kobra penyembur N. pallida (Tanzania), N. n. woodi (Afrika Selatan), dan tiga ekor ular kobra yang tidak menyemburkan racun N. anchietae (Botswana), N. annulifera (Afrika Selatan), dan N. nivea (Cape Town, Afrika Selatan) disediakan (SA Venom Suppliers) dan disimpan pada suhu −20°C hingga digunakan.
2.2 Kromatografi Cair Kinerja Tinggi Fase Terbalik (RP-HPLC)
Fraksinasi dilakukan menggunakan strategi dekompleksasi dengan modifikasi minor (Tan et al. 2019 ). Sekitar 3 mg dari setiap racun dilarutkan dalam 200 μL asam trifluoroasetat (TFA) 0,1% dalam Milli-Q H 2 O. Larutan disentrifugasi pada 10.000 x g , 4 °C, selama 10 menit. Supernatan (volume injeksi 25 μL untuk setiap putaran) dikenakan RP-HPLC pada laju alir 1 mL/menit dalam sistem pemurnian seri Agilent 1200 (Agilent Technologies Inc. USA) (Laustsen et al. 2015 ). Fraksinasi dilakukan menggunakan kolom C18 Lichrosphere RP18-5 yang dibungkus 25 cm × 4,6 mm, 5 μm (Merck, Jerman). Kolom tersebut diekuilibrasi terlebih dahulu dengan Eluen A (0,1% TFA dalam Milli-Q H 2 O) dan dielusi dengan Eluen B (0,1% TFA dalam asetonitril (ACN)) dengan gradien linier (5% B selama 10 menit, 5%–15% B selama 20 menit, 15%–45% B selama 120 menit, dan 45%–70% B selama 20 menit). Absorbansi dipantau pada 215 nm, dan fraksi puncak dikumpulkan oleh pengumpul fraksi, dikeringkan dalam suhu beku, dan disimpan pada suhu −20°C hingga digunakan.
2.3 Elektroforesis Gel Poliakrilamid-Sodium Dodecyl Sulfat (SDS-PAGE)
Fraksi racun yang dibekukan dari fraksinasi RP-HPLC dilarutkan kembali dengan Milli-Q H 2 O dan dianalisis dengan 15%-SDS/PAGE pada 20 mA dan 300 V konstan selama sekitar 1 jam dalam kondisi reduksi (Laemmli 1970 ; Tan et al. 2019 ). Tangga protein dielektroforesis di samping sampel untuk mengukur berat molekul peptida. Gel diwarnai oleh Fairbanks dengan Coomassie Brilliant Blue R-250 (Fairbanks et al. 1971 ).
2.4 Identifikasi Peptida LC–MS/MS Tanpa Label
2.4.1 Persiapan Sampel dan Akuisisi Data LC–MS/MS
Fraksi RP-HPLC yang diliofilisasi, dan fraksi-fraksi yang terkumpul lebih lanjut karena konsentrasi yang lebih rendah, dilarutkan dalam Milli-Q H 2 0 dan dikirim ke Centre for Proteomic and Genomic Research (CPGR; Cape Town, Afrika Selatan) untuk pembersihan sampel dan analisis LC–MS/MS bebas label dalam larutan. Sekitar 10 μg sampel protein direduksi dengan 10 mM dithiothreitol (DTT) (Sigma D9779, AS), dialkilasi dengan 15 mM iodoacetamide (IAA) (Sigma 16125, AS) pada suhu 37°C selama 30 menit. pH sampel disesuaikan hingga kira-kira pH 8. Tripsin (Pierce 90058, AS) dan LysC (Pierce 90307, AS) yang disiapkan dalam 50 mM trietilamonium bikarbonat (TEAB) (Sigma T7408, AS) ditambahkan dalam rasio 1:100 dan 1:500 total protein, masing-masing. Sampel dikeringkan semalaman dengan sentrifugasi vakum dan dilarutkan dalam 20 μL buffer pemuatan yang mengandung 2% ACN (Burdick dan Jackson, Jerman) dan 0,1% asam format (FA) (Sigma 56302, AS).
LC–MS dilakukan pada Q-Exactive quadrupole-orbitrap MS (Thermo Fisher Scientific, AS) yang dipasangkan dengan sistem nano-IPLC Dionex Ultimate 3000. Data mentah diperoleh dengan Xcalibur v4.1.31.9, Chromeleon v6.8 (SR13), Orbitrap MS v2.9 (build 2926) dan Thermo Foundations 3.1 (SP4). Peptida terlarut dalam ACN dan FA (sekitar 400 ng) dimuat pada kolom perangkap C18 (PepMap100, 9027905000, 300 μm × 5 mm × 5 μm). Sampel dicuci selama 3 menit sebelum mengganti katup setelah elusi peptida pada kolom analitis. Pemisahan kromatografi dilakukan menggunakan kolom ReproSil-Pur 120 C-18-AQ (DrMaisch, r119.aq.n150.075, 75 μm × 15 cm × 1,9 μm). Pelarut A terdiri dari air LC (Burdick dan Jackson BJLC365, AS) dan 0,1% FA, sedangkan pelarut B mengandung ACN dan 0,1% FA. Gradien multi-langkah untuk pemisahan peptida dihasilkan pada 300 nL/menit: pelarut B 2%–5% selama 1,5 menit, pelarut B 5%–18% selama 50 menit, pelarut B 18%–30% selama 1 menit, dan pelarut B 30%–80% selama 4 menit. Gradien dipertahankan selama 5 menit pada pelarut B 80%, kemudian dikembalikan ke pelarut B 2% selama 5 menit. MS dioperasikan dalam mode ion positif dengan suhu kapiler 120°C dan tegangan elektrospray yang diberikan sebesar 1,95 kV. Pengambilan data dilakukan dengan emitor baja tahan karat Proxeon (Thermo Fisher TFES523, AS).
2.4.2 Analisis Data
Pencarian basis data dilakukan menggunakan Perangkat Lunak Byonic PMI-Byonic-com v3.8.13 (Protein Metrics, AS) dan basis data protein Naja yang bersumber dari UniProtKB ( www.uniprot.org ) tertanggal 19 Juni 2023. Parameter pencarian yang digunakan meliputi enzim tripsin yang memotong residu lisin (K) dan arginin (R) di terminal C, sepenuhnya spesifik di terminal peptida, jumlah maksimum pembelahan yang terlewat adalah dua, toleransi prekursor 10 ppm dan toleransi fragmen 20 ppm. Modifikasi tetap adalah karbamidometil (C), sedangkan modifikasi variabel adalah deamidasi (N, Q), dan oksidasi (M). Batasan tingkat penemuan palsu protein (FDR) adalah 1%, dengan massa prekursor maksimum 10.000 dan ambang batas 300 ditetapkan untuk signifikansi. Perangkat lunak tersebut menghasilkan peptida unik yang mewakili jumlah total kecocokan spektrum peptida (PSM) untuk protein. Plot skor dan plot pemuatan kesalahan massa dibuat untuk mengukur kemungkinan variasi, keyakinan, dan signifikansi protein. Skor Byonic yang lebih besar dari 300 dan log basis 10 dari nilai p protein yang lebih besar dari 1 digunakan sebagai ambang batas untuk menentukan signifikansi protein yang diekspresikan secara berbeda. Kelimpahan relatif setiap protein racun dihitung menggunakan data dari LC–MS/MS dan RP-HPLC, dan disajikan dalam diagram lingkaran.
2.4.3 Estimasi Kelimpahan Relatif Protein
Kelimpahan relatif protein A dihitung sebagai rasio intensitas spektral rata-rata protein A dari fraksi tertentu terhadap total intensitas spektral rata-rata semua protein dalam fraksi tersebut dikalikan dengan luas di bawah kurva (AUC) untuk fraksi puncak dalam %.
mathematical equation
2.5 Uji Viabilitas Sel
Garis sel kanker MIA Paca-2 dan sel normal MRC-5 (disumbangkan oleh Prof. LR Motadi, Universitas Johannesburg, SA) dikultur dalam medium Eagle yang dimodifikasi Dulbecco (DMEM) (Thermo Fisher Scientific, AS) yang dilengkapi dengan serum anak sapi janin (FCS) (Thermo Fisher Scientific, AS), 1% Amfoterisin B (Thermo Fisher Scientific, AS), dan 1% antibiotik Pen-Strep (Penisilin Streptomisin) (Thermo Fisher Scientific, AS) selama 24 jam pada suhu 37°C, 5% CO 2 hingga konfluensi 70–80. Sel dibilas dengan 1X PBS (Thermo Fisher Scientific, AS) dan dipisahkan dengan Tripsin (Thermo Fisher Scientific, AS). Volume akhir sel (100 μL) yang mengandung 1 × 10 4 sel/sumur disemai pada pelat 96 sumur dan diinkubasi selama 24 jam. Media dibuang dan diganti dengan 100 μL media segar yang mengandung racun mentah (1, 10, dan 20 μg/mL) atau Fraksi (5, 10, 20, dan 40 μg/mL) yang dilarutkan dalam 1X PBS dan diinkubasi selama 24 jam. Sel yang tidak diobati menerima media segar (100 μL), sel kontrol positif diobati dengan 1% Etoposide (Sigma, AS) dan sel kontrol negatif diobati dengan 0,1% PBS. Alamar Blue (10%) (Thermo Fisher Scientific, AS) ditambahkan ke setiap sumur dan diinkubasi dalam gelap selama 2 jam dalam kondisi yang sama. Fluoresensi diukur pada panjang gelombang eksitasi 530/25 nm dan panjang gelombang emisi 590/25 nm pada pembaca mikroplat GloMax Discover (Promega, AS).
2.6 Analisis Data
Analisis data, termasuk pembuatan diagram batang, ANOVA satu arah diikuti oleh uji post hoc Dunnett, dan IC 50 , dilakukan dengan perangkat lunak Graph Pad Prism v8.4.3(686). Data dari tiga replikasi independen disajikan sebagai rata-rata ± simpangan baku (* p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001) di mana nilai p kurang dari 0,05 ( p < 0,05) signifikan terhadap perlakuan yang menyebabkan viabilitas sel berkurang dibandingkan dengan kontrol yang tidak diobati.
3 Hasil
3.1 Fraksinasi Racun Kobra Meludah dan Tidak Meludah dengan RP-HPLC
Fraksinasi dua bisa ular kobra yang meludah ( N. pallida dan N. n. woodi ) dan tiga bisa ular kobra yang tidak meludah ( N. anchietae , N. annulifera , dan N. nivea ) dilakukan dengan RP-HPLC. Kromatogram yang dihasilkan dari fraksinasi menunjukkan profil elusi bisa yang berbeda antara 1 dan 140 menit. Sebagian besar protein bisa ular N. pallida dielusi antara 45 dan 140 menit (Gambar 1A ), N. n. woodi (50–140 menit) (Gambar 1C ), N. anchietae (60–135 menit) (Gambar 2A ), dan N. annulifera (Gambar 2C ) dan N. nivea (Gambar 2F ) antara 45 dan 135 menit. Analisis SDS-PAGE terhadap fraksi puncak yang dikumpulkan menunjukkan bahwa sebagian besar toksin racun pada ular kobra yang meludah dan tidak meludah adalah protein dengan berat molekul rendah (Gambar 1 dan 2 ).
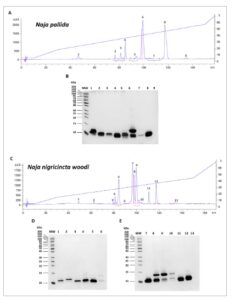
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Analisis racun ular kobra Naja pallida dan Naja nigricincta woodi setelah fraksinasi. Racun difraksinasi dengan RP-HPLC dalam kromatogram (A) N. pallida dan (C) N. n. woodi . Fraksi puncak dianalisis dengan 15% SDS-PAGE dalam kondisi reduksi untuk N. pallida (B) dan N. n. woodi (D dan E).

GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Analisis racun ular kobra yang tidak meludah Naja anchietae , Naja annulifera , dan Naja nivea setelah fraksinasi. Racun difraksinasi dengan RP-HPLC dalam kromatogram (A) N. anchietae , (C) N. annulifera , dan (F) N. nivea . Fraksi puncak dianalisis dengan 15% SDS-PAGE dalam kondisi reduksi untuk N. anchietae (B), N. annulifera (D dan E), dan N. nivea (G dan H).
3.2 Profil Proteom LC–MS/MS pada Bisa Kobra yang Meludah dan Tidak Meludah
Fraksi bisa ular kobra yang meludah dan tidak meludah yang dikumpulkan dari fraksinasi RP-HPLC dikenakan identifikasi protein LC–MS/MS bebas label dalam larutan. Protein yang signifikan disortir menurut fraksinya masing-masing dan dihitung kelimpahan relatifnya (Tabel S1–S5 ). Protein selanjutnya dikelompokkan ke dalam familinya: N. pallida (12 famili), N. n. woodi (8 famili), N. anchietae (12 famili), N. annulifera (12 famili), dan N. nivea (12 famili) (Tabel S6–S10 ) (Gambar 3 dan 4 ). Toksin berkelimpahan rendah lainnya dan protein tanpa aktivitas toksin yang diketahui ditunjukkan pada Tabel S11–S15 .
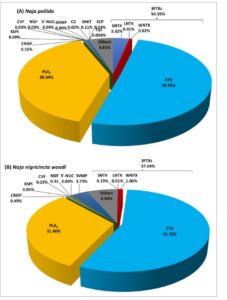
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
Analisis proteom bisa ular kobra penyembur Naja pallida (A) dan Naja nigricincta woodi (B). Fraksi puncak bisa dari RP-HPLC dianalisis dengan LC–MS/MS bebas label. Kelimpahan relatif protein dikelompokkan ke dalam beberapa famili. Singkatan: CTX, sitotoksin/kardiotoksin; SNTX, neurotoksin pendek; WNTX, toksin lemah; LNTX, neurotoksin panjang; PLA 2 , fosfolipase A2; SVMP, metaloproteinase bisa ular; KSPI, penghambat protease serin tipe Kunitz; CRISP, protein sekretori kaya sistein; NGF, faktor pertumbuhan saraf; CVF, faktor bisa ular; ShKT, protein yang mengandung domain ShKT; 5′-NUC, 5′-nukleotidase. CTX, SNTX, dan WNTX merupakan bagian dari superfamili racun tiga jari (3FTX). Lainnya merupakan racun yang jumlahnya sangat rendah dan protein yang fungsi racunnya tidak diketahui.
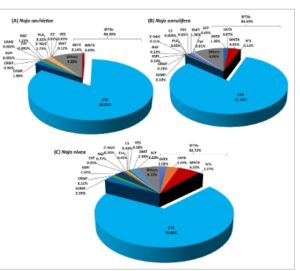
GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
Analisis proteom bisa ular kobra yang tidak meludah Naja anchietae (A), Naja annulifera (B), dan Naja nivea (C). Fraksi puncak bisa dari RP-HPLC dianalisis dengan LC–MS/MS bebas label. Kelimpahan relatif protein dikelompokkan ke dalam famili yang berbeda. Singkatan: CTX, sitotoksin/kardiotoksin; SNTX, neurotoksin pendek; LNTX, neurotoksin panjang; WNTX, toksin lemah; NTL, protein mirip neurotoksin; PLA 2 , fosfolipase A2; SVMP, metaloproteinase bisa ular; KSPI, penghambat protease serin tipe Kunitz; CRISP, protein sekretori kaya sistein; NGF, faktor pertumbuhan saraf; CVF, faktor bisa ular; ShKT, protein yang mengandung domain ShKT; 5′-NUC, 5′-nukleotidase; C3, komplemen C3; VES, vespryn; SCP, protein yang mengandung domain SCP. CTX, SNTX, LNTX, NTL, dan WNTX merupakan bagian dari superfamili toksin tiga jari (3FTX). Toksin lainnya merupakan toksin dengan kelimpahan yang sangat rendah dan protein dengan fungsi toksin yang tidak diketahui.
Gambar 3A,B menunjukkan bahwa racun ular kobra penyembur N. pallida dan N. n. woodi didominasi oleh famili 3FTX dan PLA 2. Untuk N. pallida , 3FTX merupakan famili yang paling dominan dengan kelimpahan relatif sebesar 54,50% (Gambar 3A ). Subfamili tersebut terdiri dari neurotoksin pendek (SNTX, 3,32%), neurotoksin panjang (LNTX, 0,01%), neurotoksin lemah (WNTX, 0,62%), dan sitotoksin (CTX, 50,55%) dari total proteom racun. Setelah 3FTX, famili racun paling dominan kedua adalah fosfolipase A2 (PLA 2 , 39,34%). Toksin penting lain yang diidentifikasi dari bisa N. pallida termasuk metaloproteinase bisa ular (SVMP, 0,80%), protein sekretori kaya sistein (CRISP, 0,16%), dan inhibitor protease serin tipe Kunitz (KSPI, 0,09%). Demikian pula, 3FTX adalah keluarga yang paling dominan untuk bisa N. n. woodi (Gambar 3B ). Toksin ini terdiri dari 57,03% dari total protein bisa. Subfamili terdiri dari SNTX (0,19%), LNTX (0,01%), WNTX (1,06%), dan CTX (55,78%) dari total proteom bisa. PLA 2 (31,40%) adalah keluarga protein paling melimpah kedua. Toksin lain dengan kelimpahan yang nyata termasuk SVMP (3,73%), NGF (0,51%), CRISP (0,49%), dan CVF (0,22%).
Tidak seperti kobra penyembur, bisa ular kobra yang tidak menyemburkan memiliki 3FTX sebagai satu-satunya famili protein toksin yang dominan (Gambar 4A–C ). Bisa ular Naja anchietae didominasi oleh 3FTX (84,39%) dengan subfamili seperti SNTX (0,14%), WNTX (6,3%), dan CTX (83,62%) (Gambar 4A ). Toksin lain dengan aktivitas toksin yang penting termasuk SVMP (1,96%), PLA 2 (0,31%), CRISP (0,94%), NGF (1,22%), dan 5′-NUC (1,75%). Sebagai perbandingan, bisa ular Naja annulifera mengandung 86,69% dari famili 3FTX, yang terdiri dari subfamili SNTX (1,36%), LNTX (0,07%), WNTX (4,03%), NTL (0,13%), dan CTX (81,10%). Bisa ular ini mengandung racun penting lainnya, yang meliputi SVMP (0,10%), CRISP (0,28%), KSPI (0,13%), NGF (0,12%), 5′-NUC (0,11%), dan PLA 2 (0,05%). Bisa ular N. nivea , seperti semua ular kobra yang diteliti, didominasi oleh 3FTX (82,72%) (Gambar 4C ). Subfamili tersebut juga memiliki CTX (70%) sebagai racun yang paling dominan, diikuti oleh WNTX (6,22%), LNTX (3,24%), SNTX (2,02%), dan NTL (1,2%). Racun utama lainnya yang diidentifikasi dari bisa ular N. nivea meliputi SVMP (2,59%), CRISP (1,11%), KSPI (2,97%), NGF (0,77%), 5′-NUC (0,26%), PLA 2 (0,45%), dan VES (0,18%).
3.3 Aktivitas Antikanker Fraksi Racun Mentah dan RP-HPLC
3.3.1 Sitotoksisitas Racun Mentah pada Lini Sel MIA PaCa-2
Bisa kasar dari dua bisa ular kobra penyembur ( N. pallida dan N. n. woodi ) dan tiga ular kobra yang tidak menyemburkan racun dari subgenus Uraeus ( N. anchietae , N. annulifera , dan N. nivea ) diuji terhadap lini sel MIA PaCa-2 untuk menyelidiki kemungkinan aktivitas sitotoksisitas menggunakan uji Alamar Blue. Bisa kasar dari N. pallida dengan (IC 50 = 8,66) dan N. n. woodi (IC 50 = 30,38) menyebabkan penurunan viabilitas sel yang bergantung pada konsentrasi pada lini sel MIA PaCa-2 (Gambar 5A,B ) dibandingkan dengan lini sel normal MRC-5 (Gambar 6A,B ). Ada efek sitotoksisitas yang lebih nyata dari bisa kasar N. pallida pada lini sel MIA PaCa-2 dibandingkan dengan bisa N. n. woodi . Menariknya, lini sel MRC-5 normal tidak menunjukkan penurunan signifikan dalam viabilitas sel ketika diobati dengan racun kasar dari N. pallida dan N. n. woodi pada konsentrasi tertinggi yang diuji sebesar 20 μg/mL (Gambar 6A,B ). Sebaliknya, racun kobra yang tidak meludah tidak bersifat sitotoksik terhadap MIA PaCa-2 (Gambar 5C–E ) maupun lini sel normal MRC-5, kecuali untuk sedikit penurunan proliferasi sel yang diamati pada yang terakhir dengan pengobatan N. anchietae dan N. annulifera (Gambar 6C,D ). Karena racun kobra yang meludah efektif terhadap lini sel kanker MIA PaCa-2 tanpa efek yang dapat diamati pada viabilitas sel lini sel normal MRC-5, fraksi RP-HPLC-nya digunakan untuk pengujian lebih lanjut.
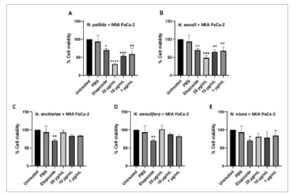
GAMBAR 5
Buka di penampil gambar
Kekuatan Gambar
Sitotoksisitas racun mentah terhadap lini sel MIA PaCa-2. Racun dari ular kobra yang meludah ( N. pallida (A) dan N. n. woodi (B)) dan ular kobra yang tidak meludah ( Naja anchietae (C), Naja annulifera (D), dan N. nivea (E)) digunakan untuk mengobati sel kanker guna menentukan efek sitotoksisitas. Data dinormalisasi menjadi 100% terhadap sel yang tidak diobati. Etoposide (1% b/v) digunakan sebagai kontrol positif, sedangkan 0,1% 1X PBS digunakan sebagai kontrol negatif. Data dari tiga replikasi independen disajikan sebagai mean ± simpangan baku (* p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001) di mana nilai- p kurang dari 0,05 ( p < 0,05) signifikan terhadap perlakuan yang menyebabkan viabilitas sel berkurang dibandingkan dengan kontrol yang tidak diberi perlakuan.
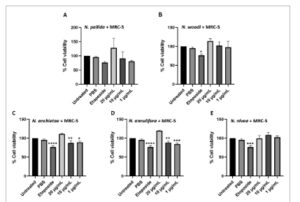
GAMBAR 6
Buka di penampil gambar
Kekuatan Gambar
Sitotoksisitas racun mentah terhadap lini sel normal MRC-5. Racun dari ular kobra yang meludah ( N. pallida (A) dan N. n. woodi (B)) dan ular kobra yang tidak meludah ( Naja anchietae (C), Naja annulifera (D), dan N. nivea (E)) digunakan untuk mengobati lini sel normal guna menentukan kemungkinan efek sitotoksisitas. Data dinormalisasi menjadi 100% terhadap sel yang tidak diobati. Etoposide (1% b/v) digunakan sebagai kontrol positif, sedangkan 0,1% 1X PBS digunakan sebagai kontrol negatif. Data dari tiga replikasi independen disajikan sebagai mean ± simpangan baku (* p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001) di mana nilai- p kurang dari 0,05 ( p < 0,05) signifikan terhadap perlakuan yang menyebabkan viabilitas sel berkurang dibandingkan dengan kontrol yang tidak diberi perlakuan.
3.3.2 Sitotoksisitas Fraksi Racun RP-HPLC pada Garis Sel MIA PaCa-2
Sitotoksisitas dari dua puncak paling menonjol dari fraksi RP-HPLC racun N. pallida (Fraksi 6 dan 8) dan N. n. woodi (Fraksi 7 dan 9) diuji terhadap lini sel MIA PaCa-2. Terdapat pengurangan proliferasi sel MIA PaCa-2 yang diamati dengan racun N. pallida Fraksi 6 (IC50 = 37,15) pada konsentrasi 5, 10, dan 40 μg/mL (Gambar 7A ). Sebaliknya, pengurangan proliferasi sel tidak diamati ketika lini sel MIA-PaCa-2 diobati dengan racun N. pallida Fraksi 8 (Gambar 7B ). Sebaliknya N. n. woodi Fraksi 9 menunjukkan sedikit pengurangan proliferasi sel pada konsentrasi 5 dan 10 μg/mL, sementara tidak ada sitotoksisitas signifikan yang diamati dengan N. n. woodi Fraksi 7 (Gambar 7C,D ).
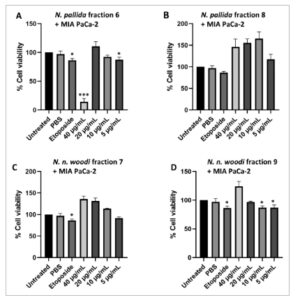
GAMBAR 7
Buka di penampil gambar
Kekuatan Gambar
Sitotoksisitas fraksi dari bisa ular kobra terhadap lini sel MIA PaCa-2. Fraksi dari N. pallida (A dan B) dan N. n. woodi (C dan D) digunakan untuk mengobati sel kanker guna menentukan efek sitotoksisitas. Data dinormalisasi menjadi 100% terhadap sel yang tidak diobati. Etoposide (1% b/v) digunakan sebagai kontrol positif, sedangkan 0,1% 1X PBS digunakan sebagai kontrol negatif. Data dari tiga replikasi independen disajikan sebagai rata-rata ± simpangan baku (* p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001) di mana nilai p kurang dari 0,05 ( p < 0,05) signifikan terhadap pengobatan yang menyebabkan viabilitas sel berkurang dibandingkan dengan kontrol yang tidak diobati.
4 Diskusi
Sementara dua ular kobra penyembur, N. pallida dan Naja nigricincta woodi termasuk dalam subgenus Afronaja , tiga ular kobra yang tidak menyemburkan , Naja anchietae , Naja annulifera , dan N. nivea, adalah anggota subgenus Uraeus (Offor dan Piater 2024a ; Trape et al. 2009 ; Wallach et al. 2009 ; Wüster et al. 2018 ). Ular kobra ini adalah bagian dari famili ular Elapidae yang menyebabkan banyak envenomasi gigitan ular di Afrika sub-Sahara (Benjamin et al. 2020 ; Gutiérrez et al. 2017 ). Kromatogram dari fraksinasi bisa ular kobra ini dan analisis SDS-PAGE mengungkapkan bahwa semua protein bisa keluar dalam waktu 140 menit. Toksin-toksin ini sebagian besar memiliki berat molekul rendah di bawah 15 kDa dan sebagian besar merupakan keluarga protein 3FTX dan PLA 2 , yang mendominasi proteom bisa ular kobra (Nguyen et al. 2022 ; Petras et al. 2011 ).
Dari data analisis LC–MS/MS, diamati bahwa famili protein 3FTX mendominasi baik racun kobra yang meludah maupun yang tidak meludah. CTX, anggota subfamili dari 3FTX, adalah yang paling melimpah di semua lima spesies ular Naja yang diteliti, yang sesuai dengan data proteom kobra sebelumnya (Nguyen et al. 2022 ; Offor dan Piater 2024a ). Selain itu, ada kelimpahan relatif yang bervariasi dari subfamili 3FTX lainnya, termasuk LNTX, WNTX, dan SNTX, yang terdeteksi dari racun kobra-kobra ini, yang menyoroti variasi toksin racun dalam ular genus Naja . Perbedaan utama antara racun kobra yang meludah dan yang tidak meludah ( subgenus Uraeus ) adalah kelimpahan PLA 2 yang rendah pada yang terakhir, sedangkan PLA 2 adalah toksin paling dominan kedua pada yang pertama. Laporan-laporan ini sesuai dengan data proteomik yang tersedia pada bisa ular kobra Afrika yang meludah dan tidak meludah (Nguyen et al. 2022 ; Offor dan Piater 2024a ). PLA 2 dan 3FTX diyakini bertanggung jawab atas efek toksik, terutama kerusakan jaringan lokal atau sitotoksisitas yang disebabkan oleh bisa ular kobra yang meludah (Petras et al. 2011 ). Neurotoksisitas, karakteristik utama bisa ular kobra yang tidak meludah dan meludah, didorong oleh aktivitas 3FTX melalui interaksi dengan reseptor asetilkolin nikotinik (nAChRs) di sambungan neuronmuskular, yang menyebabkan kelumpuhan dan kegagalan pernapasan (Williams et al. 2011 ).
Studi ini menyoroti beberapa variasi intra dan interspesies dibandingkan dengan data proteom yang tersedia, yang mungkin disebabkan oleh lokasi geografis ular yang berbeda. Misalnya, ada perubahan dalam kelimpahan relatif 3FTX (54,55%) dan PLA 2 (39,34%) dari bisa ular N. pallida Tanzania dalam studi ini dibandingkan dengan racun ular Kenya dengan kelimpahan relatif 3FTX dan PLA 2 masing-masing sebesar 67,70% dan 30,10% (Petras et al. 2011 ). Selain itu, studi ini mengidentifikasi racun lain yang berkelimpahan rendah, termasuk CRISP, LAAO, NGF, dan 5′-NUC dari N. pallida Tanzania , yang tidak terdeteksi dalam studi sebelumnya (Nguyen et al. 2022 ; Petras et al. 2011 ). N. n. Afrika Selatan Racun ular kobra penyembur woodi pada penelitian ini memiliki kelimpahan relatif 3FTX (57,04%) dan PLA 2 (31,40%) dibandingkan dengan subspesies N. n. nigricincta dari negara yang sama dengan 3FTX (74,57%) dan PLA 2 (22,244%) (Nguyen et al. 2022 ).
Untuk ular kobra yang tidak meludah, racun N. anchietae Namibia mengandung 3FTX (96,65%) dan PLA 2 (0,16%) (Nguyen et al. 2022 ) dibandingkan dengan racun N. anchietae Botswana dalam penelitian ini dengan 3FTX (84,39%) dan PLA 2 (0,31%). Di sini, CRISP, NGF, dan 5′-NUC terdeteksi tetapi tidak dalam penelitian sebelumnya. Racun N. annulifera (Afrika Selatan) dari penelitian ini mengandung 3FTX (86,69%) dan PLA 2 (0,05%), yang sebanding dengan racun dari spesies ular yang sama dari Mozambik (3FTX—79,20% dan PLA 2 —2,70%) (Sánchez et al. 2021 ). Dalam studi lain, PLA 2 tidak terdeteksi dalam racun N. annulifera Mozambik , yang menunjukkan adanya variasi di antara spesies ular yang berasal dari negara yang sama (Tan et al. 2020 ). N. nivea Afrika Selatan dalam studi ini memiliki 3FTX (82,72%) dan PLA 2 (0,45%) dibandingkan dengan dua percobaan sebelumnya di mana PLA 2 hanya terdeteksi dalam satu racun, bahkan ketika kedua ular tersebut berasal dari Afrika Selatan (Nguyen et al. 2022 ; Tan et al. 2022 ). Terdapat persamaan dan perbedaan yang diamati dalam deteksi dan kelimpahan relatif toksin lainnya, termasuk SVMP, LAAO, CRISP, NGF, CVF, 5′-NUC, dan KSPI, saat membandingkan data kami dan data yang sebelumnya dipublikasikan dari N. pallida (Petras et al. 2011 ; Nguyen et al. 2022 ), N. anchietae (Nguyen et al. 2022 ), N. annulifera (Tan et al. 2020 ; Sánchez et al. 2021 ; Nguyen et al. 2022 ), dan N. nivea (Nguyen et al. 2022 ; Tan et al. 2022 ; Lüddecke et al. 2024 ; McFarlane and Pukala 2024 ).
Sejak FDA menyetujui obat berbasis peptida racun pertama, Captopril, untuk pengobatan dan penanganan penyakit kardiovaskular hipertensi, pencarian obat berbasis racun ular semakin intensif (Cushman dan Ondetti 1991 ). Racun kasar dari ular kobra seperti Naja kaouthia , N. annulifera , dan Ophiophagus hannah menginduksi sitotoksisitas, apoptosis, dan antimetastasis terhadap sel tumor pankreas PaTu 8988 t (Kerkkamp et al. 2018 ). Racun ular krotoksin juga menunjukkan hasil yang menjanjikan dalam uji klinis Fase 1 terhadap kanker (Cura et al. 2002 ). Crotoxin diberikan secara intramuskular selama 30 hari kepada penderita kanker payudara, kanker gastrointestinal, kanker paru nonsel kecil, karsinoma serviks skuamosa, kanker prostat, karsinoma tiroid, karsinoma laring, karsinoma kandung kemih, adenokarsinoma tuba fallopi, kanker kepala dan leher, fibrosarkoma tingkat rendah, sarkoma Erwing, dan liposarkoma (Cura et al. 2002 ). Selain beberapa kondisi yang dapat dikelola, respons terapeutik crotoxin menjanjikan dengan dosis yang direkomendasikan sebesar 0,18 mg/m 2 untuk uji klinis Fase 2. Meskipun beberapa toksin racun, termasuk 3FTX, PLA 2 , DIS, dan LAAO, telah terbukti menjadi agen antikanker yang efektif dan ampuh, diperlukan lebih banyak penelitian untuk menjelaskan mekanisme kerjanya dan kemungkinan berlanjut ke studi klinis (Offor dan Piater 2024b ).
Dalam studi ini, bisa kasar dan fraksi RP-HPLC dari dua ular kobra penyembur ( N. pallida dan N. n. woodi ) bersifat sitotoksik terhadap lini sel MIA PaCa-2 dibandingkan dengan lini sel normal MRC-5 dengan cara yang bergantung pada konsentrasi. Sebaliknya, tiga ular kobra yang tidak menyemburkan ludah dari subgenus Uraeus ( N.anchietae , N. annulifera , dan N. nivea ) tidak bersifat sitotoksik terhadap lini sel MIA PaCa-2, dengan pengurangan minimal dalam proliferasi sel pada lini sel normal MRC-5 yang diobati dengan N.anchietae – dan N. annulifera . Bisa kasar dari Naja naja oxiana telah terbukti bersifat sitotoksik terhadap kanker payudara manusia (MCF-7), karsinoma hepatoseluler manusia (HepG2), dan karsinoma prostat manusia (DU145) dibandingkan dengan lini sel normal (MDCK) (Ebrahim et al. 2016 ).
Fraksi RP-HPLC dari bisa ular kobra mentah yang tidak meludah dihentikan karena bisa ular kobra mentah tersebut tidak bersifat sitotoksik terhadap lini sel MIA PaCa-2. Dua fraksi RP-HPLC dari masing-masing bisa ular N. pallida ( Fraksi N. pallida 6 dan 8) dan N. n. woodi ( Fraksi N. n. woodi 7 dan 9) diuji terhadap lini sel MIA PaCa-2. Untuk N. pallida , hanya Fraksi 6 yang menunjukkan sitotoksisitas signifikan terhadap sel MIA PaCa-2 pada konsentrasi 5 dan 40 μg/mL. Selain itu, untuk N. n. woodi hanya Fraksi 9 yang menginduksi pengurangan minimal proliferasi sel terhadap lini sel MIA PaCa-2 pada konsentrasi 5 dan 10 μg/mL. Analisis lebih lanjut dari data LC–MS/MS mengungkapkan bahwa toksin paling dominan yang terdeteksi dalam N. pallida Fraction 6 adalah fosfolipase 2 CM-III basa dan Cytotoxin 2 dengan kelimpahan relatif proteom masing-masing sebesar 36,7% dan 2,0% (Tabel S1 ). N. n. woodi Fraction 9 didominasi oleh fosfolipase 2 CM-III basa, fosfolipase 2 CM-II basa dan Cytotoxin 3 dengan kelimpahan relatif proteom masing-masing sebesar 16,1%, 5,3%, dan 2,5% (Tabel S2 ). Pemurnian dan studi lebih lanjut dari N. pallida Fraction 6 dan mungkin N. n. woodi Fraction 9 diperlukan untuk menjelaskan komponen toksin utama yang bertanggung jawab atas sitotoksisitas yang diamati terhadap lini sel MIA PaCa-2. Studi telah menunjukkan aktivitas antikanker dari PLA 2 dan sitotoksin, antara lain. Misalnya, Asp49-PLA 2 dasar dari Bungarus fasciatus menginduksi sitotoksisitas dan kematian sel pada sel MCF-7 (kanker payudara) dan A549 (kanker paru-paru) dibandingkan dengan sel epitel HK manusia nonkanker (Tran et al. 2019 ). PLA 2 dari Vipera raddei kurdestanica Iran menginduksi sitotoksisitas dan apoptosis pada lini sel kanker payudara MCF-7 dan MDA-MB-231 dibandingkan dengan sel epitel mama manusia normal MCF-10a (Malekara et al. 2020 ). Crotoxin (F1 CTX), PLA 2 heterodimerik yang diisolasi dari Crotalus durissus terrificus menginduksi sitotoksisitas terhadap lini sel kanker pankreas (PSN-1 dan PANC-1) dibandingkan dengan sel normal (Muller et al. 2018 ). Toksin ini juga menunjukkan sensitivitas tinggi terhadap sel glioma (GAMG dan HCB151) dan menyebabkan kerusakan DNA melalui aktivitas H2AX di kedua sel. NN-32, 3FTX, telah terbukti memiliki aktivitas potensial antikanker terhadap sel kanker paru A549 melalui induksi apoptosis, perubahan potensial membran mitokondria, dan penangkapan siklus sel (Kurkute et al. 2023 ). Sitotoksin (CT1 dan CT2) diisolasi dariNaja oxiana dan CT1 dan CT3 dari Naja haje menginduksi sitotoksisitas terhadap sel A549 dan leukemia promielositik HL60 (Feofanov et al. 2005 ). Kita tidak dapat mengesampingkan kemungkinan bisa ular kobra yang tidak meludah dan/atau toksin PLA 2 yang menginduksi sitotoksisitas terhadap jaringan lain. Khususnya, bisa ular kobra yang tidak meludah yang digunakan dalam penelitian ini ( N. anchietae , N. annulifera , dan N. nivea ) adalah dari subgenus Uraeus , yang komposisi PLA 2- nya sebagian besar kurang dari 1% dari komposisi bisa (Offor dan Piater 2024a ). Sebaliknya, bisa ular kobra yang tidak meludah dari subgenus Boulengerina memiliki komposisi PLA 2 yang sebanding dengan ular kobra yang meludah ( subgenus Afronaja ). Dengan demikian, kami cenderung percaya bahwa mayoritas aktivitas sitotoksisitas dari bisa ular kobra non-spitting Uraeus ini sebagian besar disumbangkan oleh 3FTX daripada PLA 2 . Misalnya, sementara bisa ular kobra non-spitting Mesir ( N. haje ) menunjukkan sifat antikanker terhadap leukemia limfoblastik 1301 (El Hakim et al. 2011 ), fraksi F7 bisa ular N. haje Maroko menunjukkan efek anti-proliferatif terhadap lini sel karsinoma hepatoseluler jika dibandingkan dengan lini sel normal (Lafnoune et al. 2021 ). Sebuah studi baru-baru ini terhadap peptida sitotoksin yang diisolasi dari N. anchietae dan N. senegalenses menunjukkan penghambatan proliferasi sel glioblastoma U87 (Boughanmi et al. 2024 ).
Sementara sel normal MRC-5 berasal dari sel fibroblas paru normal (jaringan ikat), sel MIA PaCa-2 berasal dari karsinoma pankreas (jaringan epitel). Sel MIA PaCa-2 memiliki tingkat proliferasi yang lebih tinggi, membran fosfolipid yang berubah dan jalur pensinyalan untuk interaksi racun bisa dan hidrolisis dibandingkan dengan lini sel normal MRC-5. Perbedaan ini dapat mengatur aksesibilitas, selektivitas, dan aktivitas bisa ular dan/atau racunnya (misalnya, PLA 2 ). Sementara kami mengakui bahwa perbedaan dalam sumber sel-sel ini dapat memengaruhi aktivitas racun bisa, kontrol negatif (sel yang diobati dengan PBS dan DMEM) dan kontrol positif (sel yang diobati dengan etoposide) digunakan untuk membandingkan data viabilitas sel yang diperoleh dari sel yang diobati dengan bisa ular dan/atau racunnya.
5 Kesimpulan
Envenomasi gigitan ular menyebabkan morbiditas dan mortalitas di seluruh Afrika sub-Sahara. Ada beberapa obat yang disetujui FDA dari racun bisa ular dari wilayah lain, termasuk Amerika Selatan dan Asia. Oleh karena itu, ada kebutuhan untuk membuat profil bisa dari Afrika yang penting secara medis Naja spp. dari berbagai lokasi untuk kemungkinan sifat antikanker. Dalam penelitian ini, profil bisa LC–MS/MS menunjukkan bahwa famili 3FTXs (kebanyakan subfamili CTX) adalah toksin yang paling dominan baik pada ular kobra yang meludah ( N. pallida dan N. n. woodi ) maupun yang tidak meludah ( N. anchietae , N. annulifera , dan N. nivea ). Selain itu, PLA 2 adalah toksin paling dominan kedua pada bisa ular kobra yang meludah, tetapi memiliki kelimpahan relatif yang sangat rendah pada bisa ular kobra yang tidak meludah, sehingga menunjukkan gagasan bahwa ia memainkan peran kecil atau tidak sama sekali dalam envenomasi yang disebabkan oleh ular kobra yang tidak meludah dari subgenus Uraeus . Keluarga toksin penting lainnya yang diidentifikasi dalam penelitian ini dengan kelimpahan relatif bervariasi meliputi SVMP, CRISP, KSPI, CVF, NGF, dan 5′-NUC. Sejauh pengetahuan kami, penelitian ini secara penting menyajikan data profil proteomik pertama dari N. n. woodi . Di sini, kami menetapkan bahwa bisa ular kobra yang meludah bersifat sitotoksik terhadap lini sel MIA PaCa-2 dibandingkan dengan lini sel MRC-5 normal pada konsentrasi maksimum yang diuji. Sebaliknya, bisa ular kobra yang tidak meludah tidak bersifat sitotoksik terhadap lini sel MIA PaCa-2. Penelitian ini selanjutnya mengimplikasikan kandungan toksin dari sebagian besar N. pallida Fraksi 6 (fosfolipase dasar 2 CM-III dan Sitotoksin 2) dan N. n. woodi fraksi 9 (fosfolipase dasar 2 CM-III, fosfolipase dasar 2 CM-II dan Sitotoksin 3) sebagai peptida potensial yang bertanggung jawab atas penurunan proliferasi sel yang diamati pada lini sel MIA PaCa-2. Dengan demikian, diperlukan penelitian lebih lanjut untuk mengidentifikasi toksin peptida racun tertentu yang bertanggung jawab atas efek sitotoksik ini. Memecahkan struktur racun racun ular kobra Afrika (misalnya, PLA 2 dan 3FTX) dapat membantu dalam menentukan selektivitas dan penetrasi sel kanker. Selain itu, mengembangkan konjugat toksin yang stabil atau sistem pengiriman ke target kanker adalah kunci untuk terapi antikanker yang ditargetkan. Selain itu, efek antikanker dari racun racun ini harus diuji lebih lanjut terhadap sel kanker lainnya.

