
ABSTRAK
Akrilamida (ACR) adalah zat kimia beracun dengan risiko karsinogenik tinggi yang dilepaskan sebagai akibat dari pemanasan atau pengolahan makanan pada suhu tinggi. Krisin (CHR) adalah flavonoid yang secara alami ditemukan dalam makanan seperti madu dan bunga markisa dan menonjol dengan sifat antioksidan, antikanker, dan anti-inflamasinya. Penelitian ini bertujuan untuk menentukan efek perlindungan CHR dalam hepatotoksisitas yang diinduksi ACR. ACR diberikan secara oral dengan dosis 38,27 mg/kg; CHR (25 atau 50 mg/kg) diberikan secara oral selama sepuluh hari. Metode biokimia dan molekuler digunakan untuk menyelidiki stres oksidatif, peradangan, dan penanda apoptosis pada jaringan hati. Selain itu, metode histologis digunakan untuk menentukan karakteristik struktural dan fungsional jaringan hati dan autofagi. Pengobatan CHR meringankan stres oksidatif yang diinduksi ACR dengan meningkatkan antioksidan (SOD, CAT, GPx, GSH) dan mengurangi peningkatan MDA oksidan. CHR mengurangi aktivitas inflamasi dengan menonaktifkan NF-κB dan sitokin pro-inflamasi. Peningkatan Casp-3, Casp-6, Casp-9, dan Bax yang disebabkan oleh ACR dikurangi oleh CHR, sementara kadar Bcl-2 antiapoptotik yang menurun meningkat. Secara imunohistokimia juga ditentukan bahwa CHR menghambat aktivitas Beclin-1 autofagik. CHR efektif dalam mengurangi kerusakan hepatotoksisitas yang disebabkan oleh ACR dan mungkin merupakan pilihan pengobatan yang efektif.
Ringkasan
Akrilamida menyebabkan hepatotoksisitas.
Krisin melemahkan stres oksidatif yang disebabkan oleh akrilamida.
Krisin meredakan peradangan akibat akrilamida.
Krisin melemahkan apoptosis yang diinduksi akrilamida.
Krisin melemahkan autofagi yang diinduksi akrilamida.
1 Pendahuluan
Akrilamida (ACR) adalah zat kimia beracun yang dilepaskan selama pemanasan dan pemrosesan makanan, yang menyebabkan kekhawatiran global [ 1 ]. ACR digunakan dalam pengolahan air minum, kosmetik, dan pertambangan, serta dilepaskan selama pengolahan panas produk goreng seperti kentang dan roti sebagai sumber paparan yang signifikan [ 2 ]. Sumber ACR signifikan lainnya adalah asap rokok [ 3 ]. Reaksi yang disebabkan oleh panas antara gugus amino dari asam amino bebas asparagin dan gugus karbonil glukosa dan fruktosa dalam makanan sebagian besar melepaskan ACR [ 4 ].
ACR diidentifikasi sebagai karsinogen potensial oleh Badan Internasional untuk Penelitian Kanker pada tahun 1994, karena alasan seperti efek toksiknya setelah dimetabolisme dan menembus semua organ dan jaringan dalam tubuh [ 5 ]. Paparan ACR telah dievaluasi pada populasi yang berbeda, dan pada bulan April 2002, Otoritas Pangan Nasional Swedia dan Universitas Stockholm bersama-sama mengumumkan bahwa pemrosesan cahaya makanan kaya karbohidrat melepaskan kadar ACR yang signifikan. Secara khusus, jumlah penting ACR sebesar 2300 μg/kg (2,3 PPM) dilaporkan dalam kentang goreng dan keripik. Secara umum, tubuh dapat menahan paparan rata-rata 4 µg/kg bb/hari, tetapi ACR dapat menyebabkan toksisitas jaringan pada manusia pada 200 µg/kg bb/hari dan karsinogenisitas pada 300 µg/kg bb/hari [ 6 ].
Karena ACR mudah larut dalam air, ia dapat cepat diserap oleh tubuh dan menembus jaringan. Setelah diserap oleh tubuh, ia dapat berikatan dengan DNA melalui reaksi adisi Michael dan menimbulkan efek toksik dan karsinogenik [ 7 ]. Biotransformasi oksidatif ACR dilakukan oleh enzim sitokrom P450 (CYP2E1), yang mengubahnya menjadi glisidamida. Konversi ACR ini menyebabkan peningkatan stres oksidatif dan dapat menimbulkan efek toksik pada organ vital seperti hati, ginjal, dan otak [ 8 ].
Jaringan hati merupakan organ utama yang memetabolisme racun, polutan lingkungan, bahan kimia, dan obat-obatan yang perlu dikeluarkan dari tubuh. Oleh karena itu, disfungsi pada jalur metabolisme di hati dapat menyebabkan kerusakan pada jaringan hati, yang menyebabkan banyak penyakit hati [ 9 ]. Stres oksidatif merupakan salah satu mekanisme utama dalam hepatotoksisitas ACR. Produksi spesies oksigen reaktif (ROS) yang diinduksi ACR dapat berdampak buruk pada kelangsungan hidup sel karena degradasi oksidatif lipid, protein, dan kerusakan membran sel karena modifikasi DNA yang ireversibel [ 10 ]. Penelitian telah melaporkan bahwa ACR menyebabkan toksisitas jaringan melalui stres oksidatif dan juga mengubah aktivitas enzim [ 11 ].
Penggunaan fitokimia yang berasal dari tanaman telah menjadi yang terdepan dalam melawan agen toksik yang mempengaruhi jaringan hati dan ginjal. Flavonoid, yang secara alami ditemukan di hampir semua tanaman, adalah fitokimia polifenol [ 12 ]. Flavonoid berkontribusi terhadap kesehatan manusia karena memiliki aktivitas biologis yang penting. Asupan harian rata-rata flavonoid dengan diet normal diperkirakan sekitar 1–2 g per hari [ 13 ]. Chrysin (CHR) adalah flavonoid alami yang ditemukan dalam madu, propolis, buah-buahan, sayuran, dan markisa ( Passiflora sp .) [ 14 , 15 ]. CHR ditemukan sebesar 0,10–5,3 mg/kg dalam berbagai jenis madu dan setinggi 28 g/L dalam propolis [ 16 ]. CHR memiliki aktivitas biologis dan farmakologis yang penting seperti aktivitas antioksidan, antiinflamasi, antikanker, dan antihipertensi [ 17 ]. CHR dilaporkan memberikan perlindungan signifikan terhadap kerusakan toksik pada berbagai organ dalam studi In-Vivo [ 18 ]. CHR meningkatkan aktivitas enzim antioksidan signifikan seperti glutathione peroksidase (GPx) dan glutathione (GSH) dalam model kanker dan mengurangi efek monooksigenase yang bergantung pada sitokrom P450 (CytP450) [ 19 ]. Karena reabsorpsi enterohepatik, CHR dapat didaur ulang dan digunakan kembali di usus, sehingga menghasilkan peningkatan bioavailabilitas lokal [ 20 ]. Secara kimia, CHR memiliki dua cincin benzena (yaitu, cincin A dan B) dan cincin heterosiklik beranggota enam (yaitu, cincin C). Tidak seperti flavonoid, CHR hanya mengandung gugus hidroksil pada cincin A (5,7-dihidroksil) dan tidak ada substituen pada cincin B. Fitur substituen yang unik ini menjadikannya senyawa model yang cocok untuk mempelajari hubungan struktur-aktivitas. Aktivitas farmakologis CHR terkait dengan gugus pada cincin A dan C, di mana gugus hidroksil dapat memberikan efek antitoksik. Namun, CHR aman digunakan dalam model praklinis. Konsumsi harian 0,5–3,0 g CHR aman bagi manusia [ 21 ].
Penelitian saat ini bertujuan untuk menentukan tingkat kerusakan toksik akibat ACR pada jaringan hati tikus dan efek perbaikan CHR melalui jalur kerusakan yang berbeda.
2 Bahan dan Metode
2.1 Bahan Kimia
ACR (Sigma, Nomor CAS 79-06-1, berat molekul: 71,08 g/mol) dan CHR (Sigma, nomor CAS: 480-40-0, kemurnian 97%) digunakan dalam prosedur eksperimen. Semua bahan kimia lain yang digunakan dalam analisis diperoleh dari Sigma dan Merck.
2.2 Kelompok Eksperimen
Dalam penelitian ini, tiga puluh lima tikus Wistar jantan (berusia 12 minggu, berat 230–250 g) diperoleh dari KONUDAM (Konya/Turki). Tikus-tikus tersebut ditempatkan dalam kondisi laboratorium standar (24°C–25°C, kelembapan 45%–50%, dan siklus terang/gelap 12/12 jam). Tikus-tikus tersebut diberi makan makanan tikus standar (Informasi Pendukung) dan minum air sepuasnya. Tikus-tikus tersebut dibagi menjadi beberapa kelompok selama 3 hari untuk adaptasi dan mulai ditempatkan di area tempat perawatan akan dilakukan. Tikus-tikus tersebut dibagi secara acak menjadi lima kelompok dengan tujuh ekor hewan dalam setiap kelompok.
1.
Kontrol (C): Selama 10 hari, garam diberikan secara oral sekali sehari.
2.
Akrilamida (ACR): ACR dengan dosis 38,27 mg/kg diberikan secara oral sekali sehari selama 10 hari.
3.
Chrysin (CHR): CHR diberikan secara oral pada dosis 50 mg/kg sekali sehari selama 10 hari.
4.
Akrilamida + Krisin-25 (ACR + CHR25): ACR dengan dosis 38,27 mg/kg secara oral sekali sehari selama 10 hari. Setelah 30 menit, CHR 25 mg/kg secara oral sekali sehari selama 10 hari.
5.
Akrilamida + Krisin-50 (ACR + CHR50): ACR dengan dosis 38,27 mg/kg secara oral sekali sehari selama 10 hari. Setelah 30 menit, CHR 50 mg/kg secara oral sekali sehari selama 10 hari.
Literatur digunakan untuk menentukan dosis, metode aplikasi, dan jumlah hewan yang digunakan dalam kelompok [ 22 , 23 ]. ACR dilarutkan dalam garam (1 mL) sementara CHR dilarutkan dalam minyak jagung (0,5 ml). Dosis disiapkan setiap hari. LD50 yang dilaporkan untuk ACR dan CHR masing-masing adalah 114,71 mg/kg [ 24 ] dan 4350 mg/kg [ 25 ], dan dosis yang kami berikan mewakili sekitar 33,7% dari LD50 ini untuk ACR dan 0,5%–1,0% untuk CHR.
Semua prosedur percobaan dilakukan sesuai dengan Petunjuk Eropa 2010/63/EU untuk percobaan pada hewan. Semua prosedur yang dilakukan dalam penelitian ini yang melibatkan hewan mematuhi pedoman ARRIVE.
2.3 Pengumpulan Jaringan
Dua puluh empat jam setelah perawatan terakhir (Hari ke-11), hewan dipenggal kepalanya dengan anestesi sevoflurane ringan, dan sampel hati serta darah diambil. Sampel darah diambil dari vena jugularis. Sampel darah dipindahkan ke tabung vakum tanpa antikoagulan untuk analisis biokimia, disentrifugasi pada 3000 rpm pada +4°C selama 10 menit, dipisahkan menjadi serum, dan disimpan dalam freezer dalam pada suhu -20°C hingga analisis biokimia dilakukan. Sebagian jaringan hati diambil untuk analisis biokimia dan disimpan pada suhu -20°C hingga analisis dilakukan. Bagian lainnya ditempatkan dalam larutan formaldehida 10% untuk pemeriksaan histologis.
2.4 Tes Fungsi Hati
Untuk menentukan fungsi hati, aktivitas serum alanine aminotransferase (ALT), aspartate aminotransferase (AST), dan alkaline phosphatase (ALP) ditentukan menggunakan pembaca enzyme-linked immunosorbent assay (ELISA) (Bio-Tek, Winooski, VT, AS) dan kit komersial (TML Diagnostic Medical Products, Ankara, Turki) seperti yang sebelumnya dilakukan di laboratorium kami [ 26 ].
2.5 Analisis Stres Oksidatif
Untuk menentukan tingkat stres oksidatif jaringan hati, tingkat malondialdehid (MDA), indikator peroksidasi lipid, sebagai oksidan, dan aktivitas superoksida dismutase (SOD), katalase (CAT) dan GPx, dan tingkat GSH sebagai antioksidan dianalisis. Untuk tujuan ini, jaringan hati diperlakukan dengan nitrogen cair dan digiling dalam lumpang dan alu. Jaringan yang digiling kemudian dicampur dengan 1,15% kalium klorida (KCl) (rasio 1:10) dan dihomogenkan menggunakan homogenizer (Tissue Lyser II, Qiagen, Belanda). Setelah homogenat disentrifugasi, supernatan digunakan. Untuk aktivitas SOD metode Sun et al. [ 27 ]; aktivitas CAT dengan metode Aebi [ 28 ]; aktivitas GPx dengan metode Lawrence dan Burk [ 29 ]; tingkat GSH dengan metode Sedlak dan Lindsay [ 30 ]; dan tingkat MDA dengan metode Placer et al. [ 31 ]. Kandungan protein total jaringan hati dianalisis dengan metode Lowry et al. [ 32 ].
2.6 PCR Waktu Nyata (RT-PCR)
Total RNA diisolasi dari jaringan hati tikus menggunakan QIAzol Lysis Reagent (79306; Qiagen). Kemudian, cDNA disintesis dari RNA dengan iScript cDNA Synthesis Kit (1708891, Bio-Rad). cDNA yang diperoleh dianalisis untuk mengetahui Nuclear factor kappa B (NF-κB), Toll-like receptor 4 (TLR-4), Tumor necrosis factor-alpha (TNF-α), Interleukin-1 beta (IL-1β), Receptors for advanced glycation end products (RAGE), NLR family pyrin domain containing 3 (NLRP3), Cysteine-aspartic proteases-3 (Casp-3), Cysteine-aspartic proteases-6 (Casp-6), Cysteine-aspartic proteases-9 (Casp-9), BCL2 Associated X (Bax), B-cell lymphoma 2 (Bcl-2), matrix metalloproteinase-2 (MMP-2), dan matrix metalloproteinase-9 (MMP-9) primer dan iTaq Universal SYBR Green Supermix (172-5121, BIO-RAD) dicampur dan direaksikan dalam Rotor-Gene Q (Qiagen). Setelah siklus reaksi selesai, gen dinormalisasi menjadi β-Actin denganmathematical equationmetode [ 33 ]. Urutan semua gen disajikan pada Tabel 1 .
Tabel 1. Urutan primer.
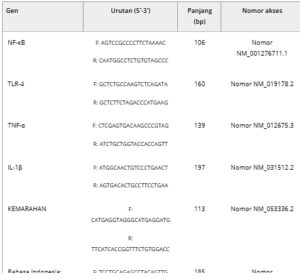
2.7 Pewarnaan Hematoksilin dan Eosin
Sampel jaringan hati disimpan dalam larutan formalin 10% selama 72 jam untuk fiksasi. Sampel jaringan dilewatkan melalui seri alkohol dan xilena menggunakan prosedur pemrosesan jaringan standar dan tertanam dalam blok parafin. Kemudian, preparat diperoleh dengan mengambil irisan setebal lima mikron menggunakan mikrotom. Preparat diwarnai dengan hematoksilin-eosin (H&E), dan jaringan yang diwarnai dievaluasi dan difoto menggunakan mikroskop cahaya (Olympus Cx43; Jepang). Penilaian histopatologi semikuantitatif dilakukan dengan mengevaluasi tiga kriteria: piknosis, kongesti vaskular, dan infiltrasi sel mononuklear di jaringan hati. Hasilnya dievaluasi sebagai negatif (0), ringan (1), sedang (2) dan berat (3) menggunakan metode buta menurut perubahan histopatologi di bawah mikroskop cahaya [ 34 , 35 ].
2.8 Analisis Imunohistokimia
Potongan setebal tiga mikrometer yang diambil dari jaringan hati disiapkan untuk pewarnaan setelah melewati rangkaian xilena dan alkohol. Pengambilan antigen dilakukan dengan menyimpan potongan tersebut dalam penyangga asam tetra asetat etilen diamina (EDTA). Kemudian, potongan tersebut disimpan dalam hidrogen peroksida 3% selama 10 menit. Potongan tersebut, yang aktivitas peroksidase endogennya dihambat, dicuci dengan garam penyangga fosfat (PBS) dan kemudian diperlakukan dengan blok protein selama 10 menit. Antibodi primer (beclin-1; Invitrogen, PA1-16857) yang diencerkan dengan PBS diteteskan ke potongan tersebut dan disimpan dalam lemari es (+4°C) semalaman. Kemudian, setelah dicuci dengan PBS tiga kali selama 5 menit, potongan tersebut diperlakukan dengan antibodi sekunder dan Strepto Biotin, masing-masing. Setelah setiap prosedur, larutan 3,3ʹ-diaminobenzidina (DAB) diteteskan pada potongan yang dicuci dengan PBS dan ditunggu hingga muncul warna cokelat. Potongan-potongan tersebut diperlakukan dengan Harris Hematoxylin selama 5 menit dan dicuci lagi dengan PBS. Jaringan disimpan dalam alkohol 96% selama 5 menit, dalam alkohol absolut dua kali selama 5 menit, dan dalam xylene dua kali selama 5 menit dan kemudian ditutupi dengan entellan. Potongan-potongan tersebut dievaluasi sebagai negatif (0), ringan (1), sedang (2) dan parah (3) menurut imunitas positifnya. Kriteria sel positif < 10% (1), sel positif 10%–50% (2) dan sel positif > 50% (3) digunakan dalam penilaian [ 36 , 37 ]. Lima potongan dipilih secara acak dari setiap kelompok dan intensitas pewarnaan dievaluasi dengan perangkat lunak ImageJ (Image J, versi 1.46a, NIH, Bethesda, MD, AS).
2.9 Analisis Statistik
Perangkat lunak SPSS 20.0 (IBM, Chicago, IL) digunakan untuk analisis data. Hasil analisis statistik dinyatakan sebagai mean ± simpangan baku. Uji post hoc Tukey dan analisis varians satu arah (ANOVA) digunakan untuk beberapa perbandingan data. Tingkat signifikansi ditentukan pada tiga tingkat yang berbeda ( p < 0,05, p < 0,01, dan p < 0,001).
3 Hasil
3.1 Hasil Tes Fungsi Hati
Aktivitas ALT, AST, dan ALP ditentukan dari jaringan hati untuk menentukan tingkat fungsi hati (Tabel 2 ). Pemberian ACR meningkatkan aktivitas ALT, AST, dan ALP ( p < 0,001). Ketika CHR diberikan bersama dengan ACR, ia menurunkan aktivitas ALT, AST, dan ALP pada kedua dosis ( p < 0,001), yang memengaruhi efek ACR dalam arah yang berlawanan. CHR lebih efektif pada dosis 50 mg/kg ketika perbandingan dosis dilakukan ( p < 0,001).
Tabel 2. Efek CHR pada penanda serum hati dan biomarker stres oksidatif pada hepatotoksisitas yang diinduksi ACR.
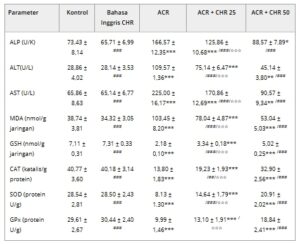
Catatan: Signifikansi statistik (kontrol vs. yang lain: * p < 0,05, ** p < 0,01, *** p < 0,001, ACR vs. yang lain: ## p < 0,01, ### p < 0,001, ACR + CHR 25 vs. ACR + CHR 50: ✩✩✩ p < 0,001) dianalisis menggunakan ANOVA Satu Arah.
3.2 Hasil Stres Oksidatif
Kadar MDA sebagai oksidan, kadar GSH sebagai antioksidan, dan aktivitas SOD, CAT, dan GPx ditentukan dalam jaringan hati (Tabel 2 ). Pemberian ACR meningkatkan kadar MDA dan menurunkan antioksidan (GSH, SOD, CAT, dan GPx) ( p < 0,001). Ketika CHR diterapkan bersama dengan ACR, kadar MDA oksidan berkurang, sedangkan kadar antioksidan meningkat. Perubahan ini adalah p < 0,001 pada MDA, GSH dan SOD, p < 0,01 pada CAT, dan tidak signifikan pada GPx pada kelompok CHR25. Pada kelompok CHR50, perubahan pada semua parameter berada pada tingkat signifikansi p < 0,001. Ketika perbandingan dosis CHR dilakukan, dosis 50 mg/kg lebih efektif pada semua parameter ( p < 0,001).
3.3 Hasil Peradangan
Tingkat transkripsi mRNA NF-κB, TLR-4, TNF-α, dan IL-1β ditentukan dari jaringan hati untuk menentukan tingkat kerusakan inflamasi (Gambar 1 ). ACR meningkatkan semua parameter inflamasi ini ( p < 0,001). Ketika CHR diberikan bersamaan dengan ACR, ia menurunkan parameter inflamasi pada kedua dosis ( p < 0,001), yang memengaruhi efek ACR dalam arah yang berlawanan. Dalam perbandingan dosis, CHR 50 mg/kg ditentukan lebih efektif (NF-κB dan IL-1β: p < 0,05; TNF-α: p < 0,001, TLR-4: tidak ada perbedaan).
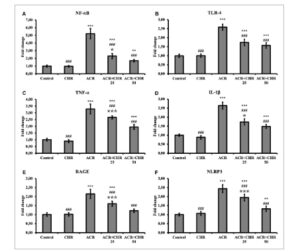
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Efek pemberian ACR dan CHR pada tingkat transkripsi mRNA NF-κB (A), TLR-4 (B), TNF-α (C), IL-1β (D), RAGE (E) dan NLRP3 (F) pada jaringan hati tikus. Nilai diberikan sebagai mean ± SD. Kontrol versus yang lain: * p < 0,05, ** p < 0,01, *** p < 0,001, ACR versus yang lain: # p < 0,05, ## p < 0,01, ### p < 0,001, ACR + CHR 25 versus ACR + CHR 50: ✩ p < 0,05, ✩✩ p < 0,01, ✩✩✩ p < 0,001.
3.4 Hasil Inflammasome
Tingkat transkripsi mRNA RAGE dan NLRP3 ditentukan dalam jaringan hati untuk mendeteksi tingkat inflammasome (Gambar 1 ). ACR meningkatkan tingkat RAGE dan NLRP3 ( p < 0,001). Pengobatan CHR melemahkan efek ACR dan menurunkan tingkat RAGE dan NLRP3 (kedua dosis: p < 0,001). Dalam perbandingan dosis, CHR 50 mg/kg ditentukan lebih efektif.
3.5 Hasil Apoptosis
Tingkat transkripsi mRNA apoptosis Casp-3, Casp-6, Casp-9, dan Bax serta antiapoptotik Bcl-2 ditentukan untuk menentukan tingkat kerusakan apoptosis pada jaringan hati (Gambar 2 ). ACR meningkatkan tingkat apoptosis dan menurunkan tingkat antiapoptotik Bcl-2 ( p < 0,001). Karena CHR diterapkan bersama dengan ACR, CHR menurunkan tingkat apoptosis dan meningkatkan tingkat antiapoptotik Bcl-2 ( p < 0,001). Dalam perbandingan dosis, CHR 50 mg/kg ditentukan lebih efektif (Casp-3 dan Casp-6: p < 0,001; Casp-9: p < 0,05; Bcl-2; p < 0,01, Bax: tidak ada perbedaan).
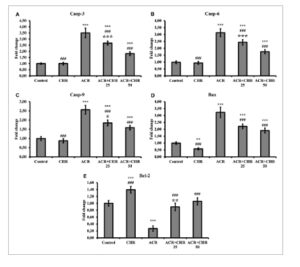
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Efek pemberian ACR dan CHR pada tingkat transkripsi mRNA Casp-3 (A), Casp-6 (B), Casp-9 (C), Bax (D), dan Bcl-2 (E) di jaringan hati tikus. Nilai diberikan sebagai mean ± SD. Kontrol versus yang lain: * p < 0,05, ** p < 0,01, *** p < 0,001, ACR versus yang lain: # p < 0,05, ## p < 0,01, ### p < 0,001, ACR + CHR 25 versus ACR + CHR 50: ✩ p < 0,05, ✩✩ p < 0,01, ✩✩✩ p < 0,001.
3.6 Hasil Migrasi Sel
Tingkat transkripsi mRNA MMP-2 dan MMP-9 ditentukan untuk migrasi sel dalam jaringan hati (Gambar 3 ). Tingkat transkripsi mRNA MMP-2 dan MMP-9 meningkat pada kelompok yang diobati dengan ACR ( p < 0,001). Efek ACR ini dibalikkan dengan pemberian CHR dan CHR menurunkan kadar MMP-2 dan MMP-9 ( p < 0,001). Dalam perbandingan dosis, CHR 50 mg/kg ditentukan lebih efektif (MMP-2: p < 0,001; MMP-9: p < 0,05).

Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Efek pemberian ACR dan CHR pada tingkat transkripsi mRNA MMP-2 dan MMP-9 di jaringan hati tikus. Nilai diberikan sebagai mean ± SD. Kontrol versus yang lain: * p < 0,05, ** p < 0,01, *** p < 0,001, ACR versus yang lain: # p < 0,05, ## p < 0,01, ### p < 0,001, ACR + CHR 25 versus ACR + CHR 50: ✩ p < 0,05, ✩✩ p < 0,01, ✩✩✩ p < 0,001.
3.7 Hasil H&E
Pemeriksaan histologis tidak menunjukkan perbedaan histologis antara kelompok kontrol dan CHR. Oleh karena itu, kelompok kontrol diambil sebagai dasar dan evaluasi dilakukan sebagaimana mestinya. Ketika jaringan hati dari kelompok kontrol dan kelompok CHR saja diperiksa, diamati bahwa hepatosit dengan batas sel halus yang memanjang dari vena sentral dan lobulus hati klasik diamati (Gambar 4A,B ). Pada kelompok ACR, hepatosit dengan nuklei piknotik dan degenerasi hidropik dicatat. Selain itu, pemberian ACR menyebabkan infiltrasi sel mononuklear, dilatasi sinusoidal dan kongesti pada pembuluh darah dan sinusoid (Gambar 4C ). Pada kelompok eksperimen yang diberi CHR bersama dengan ACR, perubahan histologis yang mencolok terdeteksi secara paralel dengan peningkatan dosis. Kongesti ringan terdeteksi pada pembuluh darah interstisial pada kelompok ACR + CHR25 dan ACR + CHR 50 (Gambar 4D,E ). Hasilnya, hati terlindungi secara signifikan pada kelompok yang diobati dengan CHR dibandingkan dengan kelompok yang diobati dengan ACR. Temuan histopatologi dirangkum dalam Tabel 3 .
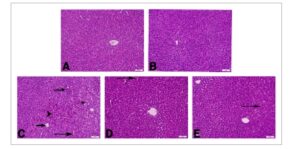
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Pemeriksaan histopatologi jaringan hati tikus yang diobati dengan ACR dan CHR. Penampakan histologis reguler jaringan hati yang diobati dengan kontrol (A) dan CHR (B). Penampakan sel hepatosit dengan nukleus piknotik yang diwarnai eosinofilik (kepala panah), kongesti vena sentral (panah tebal), kongesti sinusoidal (panah tipis), infiltrasi sel mononuklear (panah melengkung), dilatasi sinusoidal (bintang) di hati tikus yang diobati dengan ACR (C). Kelompok ACR + CHR 25 (D) dan ACR + CHR 50 (E) menunjukkan kongesti ringan di pembuluh sinusoidal (panah tipis), H&E, Bar: 50 μm.
Tabel 3. Temuan dan skor histopatologi dan imunohistokimia pada jaringan hati tikus.
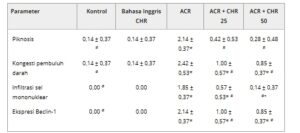
Catatan: Data adalah rata-rata ± SD. *( p < 0,05) dibandingkan dengan kelompok kontrol, # ( p < 0,05) dibandingkan dengan kelompok ACR, + ( p < 0,05) dibandingkan dengan kelompok ACR + CHR 25.
3.8 Hasil Imunohistokimia
Ketika jaringan hati tikus dievaluasi secara imunohistokimia, ekspresi beclin-1 terlihat negatif di hati kelompok kontrol dan kelompok yang hanya diberi CHR (Gambar 5A,B ). Peningkatan ekspresi beclin-1 terdeteksi di hepatosit di jaringan hati hanya pada kelompok yang diobati dengan ACR (Gambar 5C ). Pada kelompok ACR + CHR25 dan ACR + CHR50, ekspresi beclin-1 ringan ditemukan di hepatosit (Gambar 5D,E ). Temuan imunohistokimia dirangkum dalam Tabel 3 .
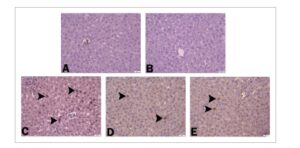
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Ekspresi Beclin-1 negatif pada jaringan hati kelompok kontrol (A) dan CHR (B). Ekspresi beclin-1 meningkat pada kelompok ACR (C) (kepala panah). Ekspresi beclin-1 ringan pada kelompok ACR + CHR 25 (D) dan ACR + CHR 50 (E) (kepala panah). IHC-P, Bar: 20 μm.
4 Diskusi
Menurut temuan penelitian ini, ACR ditemukan bersifat toksik pada jaringan hati tikus. Pengobatan CHR melemahkan efek toksik yang ditimbulkan ACR pada jaringan hati tikus. Efek CHR ini diwujudkan dengan memodulasi fungsi dan struktur hati, stres oksidatif, peradangan, apoptosis, dan parameter dalam jalur penting yang terlibat dalam struktur dan aktivitas sel.
Pergeseran keseimbangan antara ROS dan antioksidan dalam jaringan yang mendukung ROS menyebabkan stres oksidatif [ 38 ]. ROS berinteraksi dengan lipid, protein, dan DNA dalam sel, merusak strukturnya dan akhirnya menyebabkan kerusakan atau kematian sel [ 39 , 40 ]. Stres oksidatif mungkin merupakan mekanisme utama kerusakan jaringan [ 41 ]. Peroksidasi lipid terjadi pada tingkat zat yang bereaksi dengan asam tiobarbiturat dan hidroperoksida. Di sisi lain, produk oksidasi yang disebabkan oleh beberapa protein seperti protein karbonilasi juga merupakan indikator kerusakan stres oksidatif [ 10 ]. MDA, produk peroksidasi lipid, merupakan indikator signifikan stres oksidatif [ 42 , 43 ]. SOD, CAT, dan GPx adalah enzim antioksidan signifikan yang berkontribusi pada kapasitas antioksidan [ 44 ]. GSH adalah antioksidan nonenzim dan menunjukkan aktivitas antioksidan dengan menghancurkan ROS dan mendetoksifikasi xenobiotik [ 45 ]. Dalam penelitian ini, pada kelompok yang diobati dengan ACR, kadar MDA meningkat dan kapasitas oksidan meningkat, kadar GSH dan aktivitas SOD, CAT, dan GPx menurun dan kapasitas antioksidan menurun dan kerusakan stres oksidatif terjadi pada jaringan hati. CHR mencoba melindungi jaringan hati terhadap kerusakan stres oksidatif dengan membalikkan efek ini. Mirip dengan penelitian ini, telah dilaporkan bahwa ACR secara signifikan meningkatkan kadar MDA oksidan di hati, sambil menurunkan kadar antioksidan GSH, CAT, dan SOD dalam berbagai penelitian [ 11 ]. Mirip dengan penelitian saat ini, Şimşek et al. [ 22 ] melaporkan bahwa CHR mengurangi kapasitas oksidan dengan menurunkan kadar MDA di berbagai jaringan, meningkatkan kapasitas antioksidan dengan meningkatkan kadar GSH dan aktivitas SOD, CAT, dan GPx dan sebagai hasilnya, menunjukkan sifat pelindung terhadap kerusakan stres oksidatif. Temuan ini menunjukkan bahwa CHR dapat memberikan efek perlindungan dengan meningkatkan sistem pertahanan antioksidan seluler melalui peningkatan regulasi SOD, CAT, GPx, dan GSH, sehingga menetralkan ROS dan mengurangi kerusakan oksidatif. Selain itu, CHR dapat menghambat peroksidasi lipid dengan mengurangi kadar MDA, mencegah destabilisasi membran dan disfungsi seluler. Mekanisme pengaturan ini kemungkinan berkontribusi untuk memulihkan homeostasis redoks dan mengurangi cedera stres oksidatif yang disebabkan ACR pada jaringan hati.
NF-κB adalah regulator utama dalam penyakit inflamasi [ 46 ]. Peningkatan jumlah ROS mengaktifkan NF-κB, dan setelah diaktifkan, NF-κB terdisosiasi dari IκB untuk bergerak menuju nukleus [ 47 ]. Setelah diangkut ke nukleus, ia memicu stimulasi sitokin pro-inflamasi yang signifikan seperti NF-κB, IL-1β, dan TNF-α [ 48 ]. Satu studi melaporkan bahwa NF-κB yang diinduksi toksikan terdisosiasi dari IκB dan meningkatkan pelepasan sitokin pro-inflamasi seperti IL-1β, TNF-α, dan IL-6 setelah diangkut ke nukleus [ 49 ]. TLR4 diketahui berperan dalam aktivitas pronosiseptif bersama dengan RAGE [ 50 ]. Dalam penelitian saat ini, ACR menyebabkan kerusakan inflamasi dengan meningkatkan level transkripsi mRNA NF-κB, IL-1β, TNF-α, dan TLR4 di jaringan hati. CHR melindungi terhadap kerusakan inflamasi yang diinduksi ACR dengan menurunkan level transkripsi mRNA NF-κB, IL-1β, TNF-α, dan TLR4 di jaringan hati. Mirip dengan penelitian saat ini, Cerrah et al. [ 51 ] melaporkan bahwa ACR menyebabkan kerusakan inflamasi dengan mengaktifkan jalur NF-κB di jaringan hati. Di sisi lain, penelitian telah melaporkan bahwa CHR menunjukkan sifat penyembuhan terhadap kerusakan inflamasi yang disebabkan oleh agen toksik yang berbeda di jaringan hati dengan memperlambat jalur NF-κB [ 22 , 52 , 53 ]. Temuan ini menunjukkan bahwa CHR dapat memberikan efek perlindungannya dengan menghambat jalur pensinyalan NF-κB, sehingga mengurangi transkripsi sitokin pro-inflamasi dan menekan respons inflamasi yang dimediasi TLR4. Mekanisme ini mungkin memainkan peran penting dalam meringankan cedera hati akibat ACR.
Selain itu, peningkatan ROS juga dapat mengganggu aktivitas protein pascatranslasi [ 54 ]. Peningkatan NF-κB juga memengaruhi pelepasan RAGE, yang memainkan peran aktif dalam regulasi banyak mekanisme signifikan seperti proliferasi sel, pembaruan dan apoptosis, stres oksidatif, dan imunitas [ 52 ]. NLRP3 juga diaktifkan oleh stimulasi faktor eksogen, yang menyebabkan pelepasan sitokin pro-inflamasi [ 55 ]. Dalam penelitian saat ini, tingkat transkripsi mRNA RAGE dan NLRP3 meningkat pada kelompok yang diobati dengan ACR, meningkatkan interaksi jalur kerusakan yang berbeda dalam jaringan dan menyebabkan kerusakan jaringan hati. CHR, di sisi lain, memberikan sifat pelindung dalam jaringan hati dengan memengaruhi efek ACR ini ke arah yang berlawanan. Konsisten dengan temuan penelitian saat ini, penelitian telah melaporkan bahwa CHR melemahkan inflammasome dengan mengurangi aktivasi RAGE/NLRP3 [ 22 , 56 , 57 ]. Temuan ini menunjukkan bahwa CHR dapat memberikan efek perlindungan dengan menghambat sumbu pensinyalan RAGE/NLRP3, sehingga mengatur aktivasi inflammasome dan mengurangi kerusakan inflamasi. CHR dapat mencegah aktivasi NF-κB yang berlebihan dan kaskade pro-inflamasi terkait dengan mengurangi ekspresi RAGE dan pada akhirnya mengurangi stres oksidatif dan apoptosis. Selain itu, penekanan aktivasi NLRP3 oleh CHR dapat mengurangi kerusakan jaringan yang disebabkan oleh inflamasi, yang mungkin mengganggu pematangan dan pelepasan sitokin pro-inflamasi. Interaksi mekanistik ini menyoroti peran potensial CHR dalam memulihkan homeostasis seluler dan melindungi jaringan hati dari kerusakan yang disebabkan oleh ACR.
Protein matriks di luar sel didegradasi dengan cepat oleh metaloproteinase (MMP). Gelatinase MMP-2 dan MMP-9 adalah enzim yang signifikan di antara enzim-enzim ini. Peningkatan kadar MMP-2 dan MMP-9 berhubungan langsung dengan inflamasi [ 58 ]. MMP dapat distimulasi secara langsung oleh TNF-α dan IL-1β. MMP juga terlibat dalam proliferasi sel, angiogenesis, dan apoptosis [ 59 ]. MMP-2, yang secara spesifik disekresikan dari sel stellate hati dan sel Kupffer, memberikan sifat protektif dalam homeostasis vaskular hati. MMP-9 adalah enzim yang terlibat dalam penghancuran regenerasi hati [ 60 ]. Dalam penelitian ini, kadar transkripsi mRNA MMP-2 dan MMP-9 meningkat pada kelompok yang diobati dengan ACR. CHR melemahkan efek ACR ini dan menurunkan kadar transkripsi mRNA MMP-2 dan MMP-9, sehingga melindungi jaringan hati terhadap kerusakan seperti inflamasi dan apoptosis melalui jalur ini. Mirip dengan penelitian ini, Yang et al. [ 61 ] melaporkan bahwa CHR menunjukkan sifat penyembuhan dengan mengurangi kadar MMP-2 dan MMP-9. Temuan ini menunjukkan bahwa CHR melindungi jaringan hati dengan mengatur peradangan yang dimediasi MMP dan remodeling jaringan. Peningkatan MMP-2 dan MMP-9 yang diinduksi ACR kemungkinan berkontribusi terhadap peradangan berlebihan, apoptosis, dan kerusakan jaringan. Dengan mengurangi ekspresinya, CHR membantu mempertahankan struktur hati, mencegah degradasi matriks ekstraseluler yang berlebihan, dan mendukung perbaikan jaringan. Hal ini menunjukkan bahwa CHR dapat mengurangi cedera hati yang diinduksi ACR dengan menyeimbangkan aktivitas MMP.
Apoptosis, yang menyediakan kematian terprogram dalam sel, adalah jalur kematian yang efektif dalam penghancuran sel-sel yang perlu dikeluarkan dari tubuh. Peningkatan TNF-α juga dapat memicu apoptosis [ 62 ]. Apoptosis ditandai dengan aktivasi famili caspase [ 63 ]. Apoptosis juga menghasilkan stres seluler atau kerusakan seluler ketika terjadi secara berlebihan pada sel-sel sehat [ 64 ]. Di dalam sel, ROS mengganggu membran mitokondria, meningkatkan fluiditas dan permeabilitas [ 65 ]. Ketika keseimbangan antara Bax dan Bcl-2, dua parameter penting dalam jalur mitokondria, bergeser mendukung Bax, sitokrom C dilepaskan dari mitokondria ke dalam stasis dan aktivasi caspase dimulai [ 66 ]. Terutama peningkatan ROS meningkatkan aktivasi Casp-3 [ 67 ]. Casp-3 adalah caspase yang paling signifikan dan dikenal sebagai caspase eksekutor. Casp-3 adalah titik kunci ireversibel dalam kematian sel [ 68 ]. Casp-9 adalah anggota keluarga caspase yang mengaktifkan Casp-3 [ 69 ]. Dalam sebuah penelitian yang dilakukan dengan agen toksik yang berbeda, dilaporkan bahwa jumlah sitokrom C meningkat di jaringan hati sebagai akibat dari keseimbangan Bax/Bcl-2 yang terganggu dengan meningkatnya stres oksidatif dan apoptosis terjadi sebagai akibat dari aktivasi Casp-3 [ 70 ]. Dalam penelitian ini, pemberian ACR mengganggu keseimbangan Bax/Bcl-2 yang mendukung Bax, yang menyebabkan aktivasi Casp-6, Casp-9, dan Casp-3 dan akibatnya kerusakan apoptosis. CHR membalikkan situasi ini dan melindungi jaringan hati terhadap kerusakan apoptosis yang diinduksi ACR. Temuan ini menunjukkan bahwa CHR dapat memberikan efek perlindungannya dengan mengatur jalur apoptosis intrinsik (mitokondria). Dengan memulihkan keseimbangan Bax/Bcl-2 yang mendukung Bcl-2, CHR dapat menghambat aktivasi kaskade caspase, mungkin mencegah ketidakstabilan membran mitokondria dan pelepasan sitokrom c. Penekanan aktivasi Casp-9 dan Casp-3 oleh CHR menunjukkan perannya dalam mencegah sinyal apoptosis yang berlebihan dan menjaga integritas sel. Selain itu, sifat antioksidan CHR dapat berkontribusi untuk mengurangi disfungsi mitokondria yang dimediasi ROS dan selanjutnya melemahkan apoptosis.
Apoptosis jaringan yang diinduksi ACR juga melibatkan autofagi seluler [ 71 ]. Beclin-1 adalah salah satu indikator penting autofagi. Beclin-1 aktif dalam penekanan tumor dan dalam pengembangan sistem imun [ 72 ]. Dalam penelitian ini, aktivitas beclin-1 diperiksa secara imunohistokimia, dan peningkatan jaringan hati yang diinduksi ACR diamati. CHR melindungi jaringan hati terhadap kerusakan autofagik yang diinduksi ACR dengan menurunkan aktivitas beclin-1. Triningsih dkk. [ 71 ] melaporkan bahwa ACR meningkatkan kadar beclin-1 seluler. Di sisi lain, Tuncer dkk. [ 73 ] melaporkan bahwa CHR menunjukkan sifat perbaikan terhadap kerusakan autofagik dengan mengurangi ekspresi Beclin-1 yang diinduksi oleh agen yang berbeda. Temuan ini menunjukkan bahwa CHR dapat memberikan efek perlindungannya dengan memodulasi jalur autofagik melalui penurunan regulasi ekspresi Beclin-1. Peningkatan kadar beclin-1 yang disebabkan oleh ACR menunjukkan respons autofagi yang berlebihan atau tidak teratur, yang dapat menyebabkan stres seluler dan kerusakan jaringan hati. Kemampuan CHR untuk mengurangi aktivitas beclin-1 menunjukkan peran potensial dalam memulihkan keseimbangan autofagi, mencegah apoptosis berlebihan yang terkait dengan autofagi, dan mempertahankan homeostasis seluler. Mekanisme ini menyoroti pengaruh regulasi CHR pada interaksi antara autofagi dan apoptosis pada cedera hati yang disebabkan oleh ACR.
Aktivitas ALT, AST, dan ALP merupakan penanda fungsi hati [ 74 ]. Ketika toksisitas hati memburuk, gagal hati dapat terjadi dan akibatnya, transplantasi hati mungkin diperlukan [ 75 ]. Cedera toksik mengakibatkan kerusakan pada hepatosit dan aktivasi sel Kupffer dan sel pembunuh alami, yang mengakibatkan reaksi inflamasi [ 76 ]. Dalam penelitian saat ini, ACR merusak fungsi hati dan menyebabkan peningkatan aktivitas ALT, AST, dan ALP. Ketika CHR diberikan bersama dengan ACR, aktivitas ALT, AST, dan ALP terbalik dan CHR memberikan sifat pelindung. Konsisten dengan penelitian saat ini, penelitian [ 12 , 51 ] melaporkan bahwa ACR meningkatkan aktivitas ALT dan AST di jaringan hati. Hal ini ditunjukkan dalam pencitraan H&E jaringan hati. Pada gambaran jaringan hati dari kelompok yang diobati dengan ACR, nekrosis berat, degenerasi hidropik, infiltrasi sel mononuklear, dilatasi sinusoidal, hiperemia berat, dan hemoragi pada pembuluh darah dan sinusoid diamati pada hepatosit. Pada kelompok eksperimen di mana CHR diberikan bersama dengan ACR, ditentukan bahwa CHR menunjukkan sifat protektif yang signifikan terhadap kerusakan yang disebabkan oleh ACR pada jaringan hati. Kandemir dkk. [ 53 ] melaporkan bahwa CHR mengurangi peningkatan aktivitas ALT, AST, dan ALP yang diakibatkan oleh toksisitas hati yang disebabkan oleh berbagai agen toksik dan mengurangi kerusakan jaringan.
5 Kesimpulan
Sebagai kesimpulan, efek toksik ACR, yang umumnya kita dapatkan dari berbagai sumber makanan dalam kehidupan sehari-hari, pada jaringan hati tikus dan efek perlindungan CHR ditentukan oleh berbagai metode dan jalur kerusakan yang berbeda. CHR menunjukkan sifat perlindungan dengan mengurangi stres oksidatif yang disebabkan ACR, kerusakan DNA, peradangan, apoptosis, autofagi, dan gangguan pada fungsi dan struktur jaringan pada jaringan hati tikus.

