
ABSTRAK
Tujuan
Dengan meningkatnya prevalensi diabetes melitus di seluruh dunia, memastikan kinerja uji HbA1c menjadi sangat penting. Kontrol kualitas internal (IQC) dan penilaian kualitas eksternal (EQA) berfungsi sebagai komponen penting dari sistem jaminan kualitas dan memberikan penilaian kinerja yang komprehensif. Kami bertujuan untuk mengevaluasi variasi intra-laboratorium dan antar-laboratorium uji HbA1c menggunakan data EQA dan IQC.
Metode
Sebanyak 326 laboratorium yang terus berpartisipasi dalam program HbA1c EQA dari tahun 2020 hingga 2023 diikutsertakan, di mana 168 laboratorium melaporkan data IQC secara sukarela. Tingkat penerimaan dan bias dievaluasi pada tiga tingkat: per sampel, per tahun, dan per produsen. Variasi intra-laboratorium dan antar-laboratorium dinilai menurut kriteria variasi biologis (BV) dan pedoman klinis.
Hasil
Tingkat penerimaan rata-rata untuk 20 sampel EQA adalah 48,5%, 77,8%, 86,7% dalam kriteria BV minimum yang optimal dan diinginkan. Tingkat penerimaan rata-rata tahunan meningkat dari 91,8% menjadi 96,9% berdasarkan kriteria EQA. Bias spesifik produsen absolut bervariasi dari 0,02% hingga 4,1%. Pada tahun 2023, variasi antar-laboratorium secara keseluruhan menurun secara signifikan menjadi 2,1%–2,6%. Variasi intra-laboratorium median berkurang dari 1,6% menjadi 1,4% pada tingkat QC rendah dan dari 1,2% menjadi 1,0% pada tingkat QC tinggi. 58,9% dan 79,8% laboratorium mencapai CV intra-laboratorium < 1,5% untuk tingkat QC rendah dan tinggi, masing-masing.
Kesimpulan
Variasi pengukuran HbA1c antar-laboratorium dan intra-laboratorium telah menurun secara signifikan selama bertahun-tahun. Namun, perbedaan antar-produsen masih ada, dan upaya berkelanjutan diperlukan untuk sepenuhnya mematuhi persyaratan pedoman klinis.
Ringkasan
Spesifikasi kinerja ketidaktepatan dan kesalahan total untuk HbA1c berdasarkan data variasi biologis ditetapkan.
Data HbA1c IQC dari 168 laboratorium dikumpulkan untuk analisis variasi intra-laboratorium.
CV intra-laboratorium dan antar-laboratorium dari uji HbA1c dianalisis menurut pedoman klinis dari berbagai produsen.
1 Pendahuluan
Diabetes telah menjadi masalah kesehatan kritis karena prevalensinya yang tinggi dan kecacatan serta kematian yang terkait dengannya [ 1 ]. Pada tahun 2021, prevalensi global diperkirakan sekitar 537 juta, dengan proyeksi yang menunjukkan peningkatan menjadi 783 juta pada tahun 2045 [ 2 ]. Tiongkok, dengan populasinya yang besar, memiliki jumlah orang dewasa penderita diabetes terbesar yang berusia 20–79 tahun. Namun, diperkirakan sekitar 45% individu di seluruh dunia dengan diabetes masih belum terdiagnosis [ 2 ].
Pengenalan HbA1c dalam diagnosis diabetes pertama kali diusulkan dan diterapkan pada tahun 2009 [ 3 ]. Pengujian HbA1c menawarkan beberapa keuntungan teknis dibandingkan pengujian glukosa, termasuk peningkatan stabilitas pra-analitik, penurunan variabilitas biologis, dan persiapan pasien yang lebih mudah (yaitu, puasa tidak diperlukan) [ 4 ]. Pada tahun 2011, Organisasi Kesehatan Dunia merekomendasikan bahwa HbA1c dapat digunakan sebagai uji diagnostik untuk diabetes, asalkan pengujian tersebut distandarisasi dengan kriteria yang selaras dengan nilai referensi internasional [ 5 ]. Pedoman Tiongkok untuk Diabetes Tipe 2, yang diterbitkan pada tahun 2020, juga menyatakan bahwa HbA1c dapat digunakan sebagai kriteria diagnostik tambahan untuk diabetes dengan metode standar dan jaminan kualitas yang ketat.
Pedoman terbaru yang diterbitkan oleh American Diabetes Association (ADA) dan Association for Diagnostics and Laboratory Medicine (ADLM) menekankan kriteria kinerja analitis yang ketat untuk pengukuran HbA1c, yang bertujuan untuk koefisien varians (CV) intra-laboratorium < 1,5% dan CV antar-laboratorium < 2,5%, idealnya tanpa bias yang terukur [ 6 ]. Laboratorium sering menggunakan prosedur pengendalian mutu internal (IQC) untuk memantau validitas hasil pemeriksaan yang sedang berlangsung terhadap kriteria yang ditentukan, dengan demikian memastikan tercapainya mutu yang dimaksudkan yang berkaitan dengan pengambilan keputusan klinis. Tujuan utama IQC adalah untuk mengevaluasi ketidaktelitian proses analitis dan mendeteksi kesalahan yang penting secara klinis [ 7 ]. Program penilaian mutu eksternal (EQA) adalah alat yang diterima secara luas untuk memantau dan meningkatkan kinerja metode di laboratorium klinis, yang memainkan peran penting dalam mencapai harmonisasi [ 8 ]. Data EQA merupakan sumber yang berguna untuk analisis komparatif dan evaluasi CV antar-laboratorium [ 9 ]. Zhejiang Center for Clinical Laboratories (ZJCCL) telah menyediakan program EQA selama kurang lebih 40 tahun di Tiongkok. Tujuan dari program EQA HbA1c adalah untuk menilai dan membandingkan harmonisasi hasil yang diperoleh dari berbagai jenis pengujian. Peserta dalam program EQA HbA1c juga didorong untuk memberikan data IQC bulanan secara sukarela. Tujuan dari penelitian ini adalah untuk menilai CV intra-laboratorium dan antar-laboratorium pengujian HbA1c di Provinsi Zhejiang menurut berbagai kriteria kinerja menggunakan data EQA dan IQC, dan untuk menyelidiki setiap peningkatan CV dari tahun 2020 hingga 2023.
2 Bahan dan Metode
2.1 Desain Penelitian
Data HbA1c EQA dan IQC ditinjau secara retrospektif. Laboratorium yang berpartisipasi terus-menerus dalam program EQA dan IQC dari tahun 2020 hingga 2023 disertakan dalam analisis. Program EQA, yang dilakukan setahun sekali pada bulan Maret, menggunakan lima sampel kontrol cair berdasarkan darah utuh manusia, yang diperoleh dari Laboratorium Bio-Rad (Hercules, CA, AS). Homogenitas dan stabilitas bahan kontrol diuji per ISO 13528:2022 [ 10 ]. Hasil EQA diserahkan secara elektronik melalui platform EQA ( http://zjccl.hospitalstar.com:9096 ) yang dikembangkan oleh ZJCCL. Data IQC bulanan dikumpulkan secara sukarela setiap bulan Maret, termasuk bahan kontrol kualitas (dua tingkat QC), metode, produsen instrumen, reagen dan kalibrator, mean dan deviasi standar (SD) data IQC bulanan dari setiap tingkat QC. Setiap laboratorium diinstruksikan untuk mengecualikan hasil QC yang tidak terkendali dari analisis lebih lanjut sesuai dengan aturan dan rentang QC internal. Konsentrasi HbA1c dinyatakan dalam satuan Program Standardisasi Glikohemoglobin Nasional (NGSP).
2.2 Spesifikasi Kinerja
Menurut Pernyataan Konsensus Federasi Kimia Klinis Internasional, kriteria kualitas berdasarkan variasi biologis (BV) dibagi menjadi tiga tingkat kinerja: minimum, diinginkan, dan optimum [ 11 ]. Data variasi intra-individu (CV I ) dan variasi antar-subjek (CV G ) terbaru dari HbA1c diperoleh dari situs web Federasi Kimia Klinis dan Kedokteran Laboratorium Eropa, yang masing-masing adalah 1,2% dan 5,4% dalam unit NGSP [ 12 ]. Tiga tingkat ketidaktepatan yang dibolehkan (CV a ) dan kesalahan total yang dibolehkan (TE a ) ditetapkan menurut rumus berikut [ 11 ]:
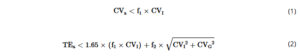 di mana f 1 = 0,75, 0,5, 0,25 dan f 2 = 0,375, 0,25, 0,125 masing-masing untuk tujuan minimum, tujuan yang diinginkan, dan tujuan optimum.
di mana f 1 = 0,75, 0,5, 0,25 dan f 2 = 0,375, 0,25, 0,125 masing-masing untuk tujuan minimum, tujuan yang diinginkan, dan tujuan optimum.
Akibatnya, tiga tingkat kriteria mutu BV untuk CV a ditetapkan pada 0,9%, 0,6%, dan 0,3%, sedangkan TEa ditetapkan pada 3,6%, 2,4%, dan 1,2%. Batas penerimaan sebesar 6% digunakan untuk mengevaluasi hasil dalam program EQA. Selain itu, CV intra-laboratorium maksimum sebesar 1,5% dan CV antar-laboratorium sebesar 2,5% diterapkan untuk menilai variasi menurut pedoman klinis
2.3 Analisis Statistik
Perhitungan statistik dilakukan dengan menggunakan Microsoft Excel 2010 dan GraphPad Prism 9. Statistik nonparametrik digunakan karena distribusi mayoritas data tidak normal, seperti yang dikonfirmasi oleh uji Shapiro–Wilk. Algoritma robust A digunakan untuk analisis data EQA menurut pedoman ISO 13528 [ 10 , 13 ]. Rata-rata robust keseluruhan dihitung dengan memanfaatkan hasil dari semua partisipan sebagai nilai target untuk setiap sampel EQA. Nilai perbedaan dihitung dengan membandingkan hasil pengujian dengan nilai target untuk setiap laboratorium, dan tingkat penerimaan dihitung menurut empat kriteria TEa (3,6%, 2,4%, 1,2% dan 6%) untuk 20 sampel EQA. Nilai perbedaan absolut rata-rata dari lima sampel EQA per tahun dihitung untuk memperkirakan bias untuk setiap laboratorium.
Selain itu, rata-rata robust grup dihitung untuk produsen yang dipekerjakan oleh lebih dari 20 laboratorium di setiap putaran EQA: Tosoh (Tosoh Corporation, Tokyo, Jepang), Medconn (Medconn Diagnostics, Shanghai, Cina), Bio-Rad (Bio-Rad Laboratories, Hercules, AS), dan Primus (Primus Diagnostics, Kansas, AS). Dari keempat produsen, Primus menggunakan kromatografi afinitas, dan yang lainnya menggunakan kromatografi cair kinerja tinggi (HPLC). Bias khusus produsen ditentukan dengan mengurangi nilai target dari rata-rata robust grup untuk setiap produsen. CV antar-laboratorium keseluruhan untuk 326 laboratorium ditentukan dengan membagi SD robust keseluruhan dengan rata-rata robust keseluruhan. Demikian pula, CV khusus produsen dihitung menggunakan hasil khusus produsen.
Untuk analisis data IQC, CV intra-laboratorium dihitung dengan membagi SD dengan hasil QC rata-rata untuk setiap laboratorium; diagram kotak dibuat untuk menyajikan distribusi CV secara visual dari tahun 2020 hingga 2023. Tingkat penerimaan dihitung berdasarkan empat kriteria CVa (0,9%, 0,6%, 0,3%, dan 1,5%) untuk kedua tingkat QC.
Perbedaan bias dan CV antar tahun dan produsen dinilai dengan uji Mann–Whitney U atau uji Kruskal-Wallis. Signifikansi statistik selanjutnya ditentukan melalui analisis berpasangan post hoc dengan menerapkan uji perbandingan ganda Dunn. p < 0,05 dianggap signifikan secara statistik.
3 Hasil
326 laboratorium (terutama laboratorium berbasis rumah sakit) terus-menerus menyerahkan hasil EQA selama periode studi empat tahun, yang mana 168 laboratorium secara bersamaan menyediakan data IQC. Jumlah laboratorium yang mengajukan empat produsen bervariasi dari waktu ke waktu sebagai berikut: Tosoh (menurun dari 104 menjadi 96), Medconn (menurun dari 51 menjadi 50), Bio-Rad (menurun dari 37 menjadi 35), dan Primus (menurun dari 33 menjadi 28).
3.1 Tingkat Penerimaan Sampel EQA
Ke-20 spesimen EQA mencakup konsentrasi HbA1c dari 5,3% hingga 14,7%. Gambar 1 mengilustrasikan tren temporal dalam tingkat penerimaan (2020–2023) menurut empat spesifikasi kinerja. Tingkat penerimaan rata-rata untuk ke-20 sampel adalah 48,5%, 77,8%, 86,7%, dan 95,5% dalam kriteria optimum (1,2%), diinginkan (2,4%), minimum (3,6%), dan EQA (6%), masing-masing. Diamati bahwa sampel dengan konsentrasi yang lebih rendah menghasilkan kepatuhan yang relatif berkurang berdasarkan kriteria BV; namun, tren ini tidak terlihat ketika mempertimbangkan kriteria EQA.
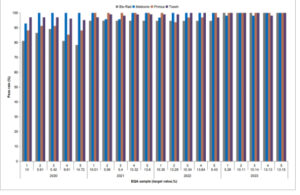
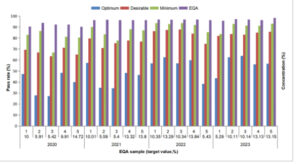 Analisis tahunan dari lima sampel menunjukkan tren peningkatan dalam pencapaian kriteria optimum (1,2%), meningkat dari 38,2% (2020) menjadi 56,6% (2023). Kepatuhan kriteria EQA (6%) juga meningkat dari 91,8% menjadi 96,9% selama periode studi. Peningkatan yang konsisten dalam tingkat penerimaan rata-rata diamati di empat produsen (Gambar 2 ), khususnya untuk Bio-Rad, yang meningkat dari 83,2% menjadi 100% dari waktu ke waktu. Pada tahun 2020, Medconn memiliki tingkat kelulusan rata-rata tertinggi, sedangkan Bio-Rad memiliki yang terendah. Pada tahun 2023, baik Bio-Rad maupun Primus mencapai kepatuhan maksimal (100% di seluruh lima spesimen).
Analisis tahunan dari lima sampel menunjukkan tren peningkatan dalam pencapaian kriteria optimum (1,2%), meningkat dari 38,2% (2020) menjadi 56,6% (2023). Kepatuhan kriteria EQA (6%) juga meningkat dari 91,8% menjadi 96,9% selama periode studi. Peningkatan yang konsisten dalam tingkat penerimaan rata-rata diamati di empat produsen (Gambar 2 ), khususnya untuk Bio-Rad, yang meningkat dari 83,2% menjadi 100% dari waktu ke waktu. Pada tahun 2020, Medconn memiliki tingkat kelulusan rata-rata tertinggi, sedangkan Bio-Rad memiliki yang terendah. Pada tahun 2023, baik Bio-Rad maupun Primus mencapai kepatuhan maksimal (100% di seluruh lima spesimen).
 GAMBAR 2
GAMBAR 2
Buka di penampil gambar
Presentasi PowerPoint
Tingkat penerimaan 20 sampel EQA menurut kriteria EQA di empat produsen.
3.2 Analisis Bias untuk Laboratorium dan Produsen
Estimasi bias untuk laboratorium, yang diukur melalui deviasi absolut rata-rata tahunan di lima spesimen EQA, mengungkapkan pengurangan yang signifikan secara statistik pada tahun 2023 relatif terhadap garis dasar 2020–2021 (uji Kruskal-Wallis H, p < 0,001), dengan bias maksimal menurun dari 14,0% menjadi 8,9%.
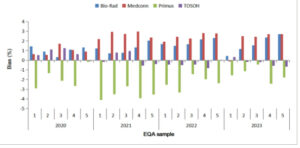
Distribusi bias khusus produsen dirinci dalam Gambar 3. Bias absolut bervariasi dari 0,02% hingga 4,1%. Tosoh paling mendekati nilai target dalam 15 dari 20 sampel. Medconn menunjukkan bias positif dalam 19 spesimen (14 memiliki nilai tertinggi). Primus menunjukkan bias negatif yang konsisten di seluruh 20 sampel, sedangkan Bio-Rad menunjukkan tren yang berlawanan. Primus menyumbang 11/20 kejadian bias absolut maksimum.
 3.3 Analisis CV Antar Laboratorium
3.3 Analisis CV Antar Laboratorium
CV antar-laboratorium secara keseluruhan dan khusus produsen digambarkan pada Gambar 4. Khususnya, penurunan bertahap dalam CV antar-laboratorium secara keseluruhan diamati, menurun dari > 2,5% (2020–2021) menjadi 2,1%—2,6% pada tahun 2023. CV khusus produsen menunjukkan tren penurunan yang serupa, khususnya untuk Bio-Rad—awalnya melebihi CV keseluruhan tetapi konvergen menjadi < 2,5% pada titik akhir. Perbedaan dalam CV antar-laboratorium di antara produsen secara bertahap berkurang dan menjadi tidak signifikan pada tahun 2023.
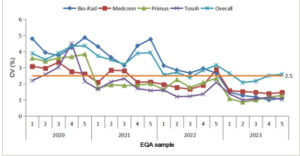
3.4 Analisis CV Intra Laboratorium
Analisis IQC mencakup rentang konsentrasi rendah (4,3%–6,5%) dan tinggi (7,2%–12,5%). CV QC rendah secara signifikan melampaui kadar QC tinggi (pengurangan median: 1,6% hingga 1,4% vs. 1,2% hingga 1,0%; p < 0,0001). Penurunan longitudinal dalam CV intra-laboratorium mencapai signifikansi statistik untuk kedua kadar QC ( p = 0,0192 [rendah], p = 0,006 [tinggi]; Gambar 5 ).

GAMBAR 5
Buka di penampil gambar
Presentasi PowerPoint
Analisis diagram kotak untuk CV intra-laboratorium. (A) dan (B) adalah CV intra-laboratorium untuk tingkat QC rendah dan tinggi, masing-masing. Laboratorium secara keseluruhan, kelompok Bio-Rad, Medconn, Primus, dan Tosoh dicantumkan dari atas ke bawah. * p < 0,05.
Demikian pula, perbedaan CV intra-laboratorium antar tahun dibandingkan untuk setiap produsen. Dibandingkan dengan tahun 2020, CV intra-laboratorium median pada tahun 2023 menurun pada kedua level QC, kecuali untuk Primus pada level QC rendah. Khususnya, penurunan tersebut signifikan secara statistik untuk Medconn pada level QC tinggi ( p = 0,0169) dan Bio-Rad pada level QC rendah ( p = 0,0072). Perbandingan berpasangan lebih lanjut mengungkapkan bahwa CV intra-laboratorium Medconn pada tahun 2023 lebih rendah dibandingkan dengan tahun 2021 ( p = 0,0444), dan CV intra-laboratorium Bio-Rad pada tahun 2022 lebih rendah dibandingkan dengan tahun 2020 ( p = 0,0498).
Perbandingan CV intra-laboratorium pada tahun 2023 menunjukkan bahwa CV intra-laboratorium terendah diamati di Tosoh dan CV tertinggi terlihat di Primus pada kedua level QC. Perbedaan antar produsen signifikan pada level QC rendah ( p = 0,0051). Perbandingan berpasangan lebih lanjut menunjukkan bahwa CV intra-laboratorium Tosoh lebih rendah daripada Medconn ( p = 0,0233) dan Primus ( p = 0,0448).
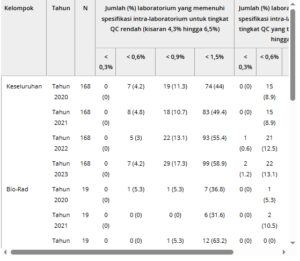
Seperti yang ditunjukkan pada Tabel 1 , tingkat kepatuhan dengan kriteria presisi berbasis BV (0,9%, 0,6%, 0,3% dan 1,5%) menunjukkan peningkatan yang berkelanjutan. Menurut sasaran BV minimum, tingkat penerimaan melampaui 30% pada level QC tinggi sejak 2021, sedangkan tingkat penerimaan tetap di bawah 20% pada level QC rendah. Pada tahun 2023, 58,9% (QC rendah) dan 79,8% (QC tinggi) laboratorium mencapai CV intra-laboratorium < 1,5%, dengan Tosoh menunjukkan kepatuhan maksimal (84,9% dan 96,2%) dibandingkan kinerja Primus yang kurang optimal (30,8% dan 53,8%).
TABEL 1. Jumlah laboratorium yang memenuhi empat spesifikasi kinerja dari tahun 2020 hingga 2023.
4 Diskusi
Kuantifikasi HbA1c yang akurat dan tepat sangat penting untuk diagnosis dan pemantauan rutin pasien diabetes. Banyak metode komersial yang tersedia untuk pengukuran rutin HbA1c, termasuk immunoassays, enzymatic assays, ion-exchange chromatography, dan afinity chromatography [ 14 ]. Studi ini menganalisis kinerja pengujian HbA1c dari laboratorium yang berpartisipasi dalam program EQA selama empat tahun berturut-turut, dengan fokus pada empat produsen utama, yang sebagian besar menggunakan metode HPLC. Dari tahun 2020 hingga 2023, jumlah laboratorium yang menggunakan sistem pengukuran dari keempat produsen utama ini menurun. Alasan utama penurunan ini adalah bahwa beberapa laboratorium baru-baru ini beralih ke produsen dalam negeri, seperti Mindray (Mindray Bio-Medical Electronics, Shenzhen, China) dan Lifotronic (Lifotronic Technology, Shenzhen, China); produsen ini tidak memenuhi kriteria untuk menyerahkan lebih dari 20 hasil EQA per tahun dan oleh karena itu tidak disertakan dalam studi ini.
Pemantauan tren dalam hasil EQA dan pemberian umpan balik kepada masing-masing laboratorium dan produsen diperlukan. Dari tahun 2020 hingga 2023, tingkat penerimaan meningkat di keempat kriteria, dengan tingkat penerimaan untuk sampel berdasarkan kriteria EQA sebesar 6% berkisar antara 95,7% hingga 97,2% pada tahun 2023. Data survei GH5 College of American Pathologists tahun 2023 menunjukkan bahwa tingkat kelulusan untuk sampel berkisar antara 96,9% hingga 98,2% [ 15 ], sedikit melampaui hasil kami. Peningkatan tingkat penerimaan dapat dikaitkan dengan dua faktor. Pertama, melalui partisipasi dalam program EQA, laboratorium dapat memperoleh umpan balik tentang kinerja mereka dan mengidentifikasi apakah diperlukan perbaikan [ 16 ]. Kedua, sejak tahun 2021, ZJCCL telah menyelenggarakan investigasi terhadap kinerja EQA yang tidak dapat diterima, seperti kesalahan transkripsi dan kegagalan instrumen. Langkah-langkah termasuk panduan di tempat, pelatihan personel, dan penyediaan sampel EQA tambahan telah diterapkan untuk peningkatan berkelanjutan.
Menetapkan tujuan mutu telah menjadi usaha global yang berkelanjutan, dan ‘Perjanjian Konsensus’ Stockholm yang diperbarui menyederhanakan hierarki menjadi tiga model [ 17 ]: (1) berdasarkan pengaruh kinerja analitis pada hasil klinis; (2) berdasarkan komponen BV dari besaran ukur; (3) berdasarkan keadaan terkini. Studi ini menetapkan spesifikasi kinerja optimum, diinginkan, dan minimum menggunakan data BV terbaru. Standar mutu harus ditetapkan sesuai dengan tujuan khusus. Untuk tujuan perbaikan EQA, akan lebih baik jika spesifikasi ditetapkan ke tingkat yang dapat dicapai oleh sebagian besar laboratorium. Oleh karena itu, tingkat mutu yang dapat dicapai oleh ~80% laboratorium telah ditetapkan sebagai spesifikasi kinerja yang sesuai [ 18 ]. Hasil kami menunjukkan tingkat penerimaan rata-rata untuk 20 sampel masing-masing adalah 48,5%, 77,8% dan 86,7%, yang menunjukkan bahwa kriteria minimum akan lebih sesuai. Demikian pula, Cha et al. menganalisis uji HbA1c di Korean Association of External Quality Assessment Service, melaporkan tingkat penerimaan rata-rata dalam kriteria optimum, diinginkan, dan minimum sebesar 22,9%, 42,9%, dan 67,5% [ 19 ]. Studi mereka merekomendasikan bahwa kriteria minimum mungkin cocok untuk HbA1c.
Analisis CV antar-laboratorium dari hasil EQA di antara berbagai uji HbA1c memfasilitasi penyelidikan harmonisasi yang dicapai. Sejak tahun 2022, penurunan yang nyata dalam CV antar-laboratorium telah diamati, dengan semua CV khusus produsen dalam 2,5% pada tahun 2023. Namun, perbedaan yang terus-menerus antar produsen tetap terlihat, karena CV keseluruhan untuk dua dari lima sampel melebihi 2,5%. Sebagai perbandingan, hasil yang dipublikasikan dari studi CAP GH5 mengungkapkan CV keseluruhan berkisar antara 2,4% hingga 3,0% [ 15 ], dengan CV khusus metode bervariasi antara 0,7% dan 3,9%, yang sedikit lebih tinggi dari nilai yang kami amati. Studi ini menilai sejauh mana setiap produsen menyimpang dari rata-rata keseluruhan, menunjukkan bahwa Tosoh menunjukkan kedekatan terdekat dengan nilai target. Jumlah laboratorium yang menggunakan instrumen produsen tertentu secara langsung memengaruhi kontribusinya terhadap kalkulasi nilai target. Hal ini dapat mengakibatkan bias yang diremehkan bagi produsen seperti Tosoh dan berpotensi melebih-lebihkan bias bagi produsen lain. Primus menunjukkan deviasi negatif terbesar, sementara Medconn menunjukkan deviasi positif tertinggi. Perbedaan substansial antara kedua produsen ini harus diperhatikan saat menerapkan pengukuran HbA1c dalam diagnosis diabetes praktis.
IQC memainkan peran penting bagi laboratorium klinis untuk mengevaluasi ketidaktepatan dengan memantau CV dari data IQC [ 20 ]. Dalam studi ini, pengurangan signifikan dalam CV intra-laboratorium untuk HbA1c diamati dari tahun 2020 hingga 2023, yang menunjukkan peningkatan presisi secara keseluruhan. Namun, sebagian besar peserta gagal memenuhi tujuan berdasarkan kriteria BV yang ketat. Menurut persyaratan pedoman klinis, lebih dari separuh laboratorium mencapai nilai CV di bawah 1,5% pada tahun 2023, dengan tingkat kelulusan yang mengesankan hampir 80% untuk tingkat QC yang tinggi. CV intra-laboratorium tertinggi diamati di Primus pada kedua tingkat QC. Hal ini sebagian dapat dikaitkan dengan jumlah laboratorium yang lebih sedikit dalam kelompok Primus, yang dapat membahayakan stabilitas dan keandalan evaluasi CV. CV bervariasi tergantung pada konsentrasi HbA1c, menunjukkan kinerja yang lebih unggul pada konsentrasi yang lebih tinggi dibandingkan dengan konsentrasi yang lebih rendah. Baik Primus maupun Medconn memiliki tingkat penerimaan di bawah 50% pada tingkat QC yang rendah. Upaya lebih lanjut diperlukan untuk meningkatkan presisi pada konsentrasi rendah, khususnya mendekati ambang batas diagnostik 5,7% untuk pradiabetes dan 6,5% untuk diabetes.
Studi ini memiliki beberapa keterbatasan. Karena terbatasnya jumlah laboratorium yang berpartisipasi, kami mengevaluasi dan membandingkan kinerja berbagai produsen, bukan jenis instrumen. Meskipun CV instrumen individual relatif kecil, perbedaan antara jenis instrumen dapat memperkuat CV keseluruhan. Selain itu, laboratorium yang berpartisipasi dalam EQA selama empat tahun berturut-turut sebagian besar adalah lembaga medis tingkat menengah atau lebih tinggi. Laboratorium dengan praktik yang lebih baik sering kali lebih cenderung melaporkan data, khususnya dalam program IQC sukarela, yang berpotensi mewakili laboratorium berkinerja tinggi.
5 Kesimpulan
Sebagai kesimpulan, penelitian ini menunjukkan bahwa tingkat kelulusan EQA untuk HbA1c telah meningkat secara bertahap berdasarkan kriteria BV dan EQA, dan variasi antar-laboratorium dan intra-laboratorium telah menurun secara signifikan. Namun, perbedaan antar-produsen masih ada, dan upaya berkelanjutan diperlukan untuk sepenuhnya mematuhi persyaratan pedoman klinis, terutama untuk spesimen dengan konsentrasi rendah.

