
ABSTRAK
Penelitian ini bertujuan untuk menyelidiki mekanisme perlindungan deksmedetomidin (Dex) dan trombopoietin (TPO) terhadap cedera miokardium yang disebabkan oleh hipoksia/reoksigenasi (H/R). Sel kardiomiosit manusia AC16 mengalami kondisi hipoksia dan diobati dengan Dex dan TPO. Respons seluler, termasuk proliferasi, apoptosis, dan autofagi, dinilai. Pengurutan RNA dan analisis bioinformatika dilakukan untuk mengidentifikasi gen yang diekspresikan secara berbeda, diikuti oleh analisis pengayaan jalur fungsional. Hasilnya menunjukkan bahwa Dex dan TPO secara signifikan meningkatkan proliferasi sel, mengurangi apoptosis dan autofagi, dan menghambat aktivitas caspase-3 dan ekspresi rantai ringan 3B (LC3B). Analisis pengayaan jalur mengungkapkan keterlibatan jalur pensinyalan mitogen-activated protein kinase (MAPK), transforming growth factor beta (TGF-β), dan tumor necrosis factor (TNF). Meskipun kedua pengobatan menunjukkan efek yang tumpang tindih, mereka juga menunjukkan mekanisme regulasi gen yang berbeda. Temuan ini menunjukkan bahwa Dex dan TPO dapat mengurangi cedera miokard yang disebabkan oleh H/R melalui mekanisme pengaturan gen yang kompleks, menyoroti potensinya sebagai strategi terapi untuk cedera iskemia-reperfusi miokard (MIRI).
1 Pendahuluan
Cedera iskemia-reperfusi miokard (MIRI) adalah kondisi patofisiologis yang kompleks dan multifaktorial yang terjadi ketika aliran darah dipulihkan ke suatu organ setelah periode iskemia, yang menyebabkan kerusakan sel dan jaringan lebih lanjut (Sagris et al. 2024 ). Selama iskemia, sel-sel miokard mengalami kekurangan oksigen dan gangguan metabolisme, yang menyebabkan disfungsi metabolisme energi dan cedera seluler (Yellon dan Hausenloy 2007 ). Setelah reperfusi, oksigen masuk kembali ke jaringan iskemik, memicu produksi spesies oksigen reaktif (ROS), yang memperburuk stres oksidatif dan respons inflamasi, yang menyebabkan aktivasi proses apoptosis dan autofagik (Wang et al. 2025 ). Peristiwa ini berkontribusi pada cedera lebih lanjut, memperburuk kerusakan iskemik awal, terutama untuk pasien yang menjalani pencangkokan pintas arteri koroner, intervensi koroner perkutan, transplantasi jantung, dan terapi trombolisis (Huang et al. 2018 ). Meskipun ada kemajuan dalam intervensi bedah ini, terapi farmakologis yang efektif untuk mengurangi MIRI dan meningkatkan hasil pasien masih terbatas, sehingga memerlukan penyelidikan lebih lanjut terhadap strategi terapi baru (Li et al. 2024 ).
Dexmedetomidine (Dex), agonis reseptor α2-adrenergik selektif, telah digunakan secara luas dalam praktik klinis sebagai anestesi dan sedatif (Lee 2019 ). Dalam beberapa tahun terakhir, terdapat bukti yang berkembang yang menunjukkan bahwa Dex memberikan efek kardioprotektif yang signifikan, khususnya dalam konteks cedera iskemia-reperfusi (Gao et al. 2017 ; Ibacache et al. 2012 ). Preconditioning dengan Dex telah terbukti mengurangi cedera miokard dengan melemahkan stres oksidatif, memodulasi jalur inflamasi, dan menghambat apoptosis (Ji et al. 2013 ; Yi et al. 2018 ). Mekanisme perlindungan Dex melibatkan aktivasi jalur pensinyalan pro-survival, seperti jalur mitogen-activated protein kinase (MAPK) dan phosphatidylinositol-3-kinase/protein kinase B (PI3K/Akt), meskipun mekanisme molekuler yang tepat masih belum jelas (Jiang et al. 2024 ). Memahami cara kerja Dex pada tingkat molekuler dapat memberikan wawasan tentang potensi terapeutiknya untuk MIRI.
Trombopoietin (TPO), yang terutama dikenal karena perannya dalam produksi trombosit, juga muncul sebagai sitokin penting yang terlibat dalam perbaikan dan perlindungan jaringan (Baker et al. 2015 ). Studi terbaru telah menunjukkan bahwa TPO menawarkan perlindungan langsung terhadap cedera iskemia-reperfusi di berbagai organ, termasuk jantung dan otak (Baker et al. 2008 ; Zhou et al. 2011 ). TPO mengaktifkan beberapa jalur pensinyalan intraseluler, termasuk JAK/STAT, MAPK, dan PI3K/Akt, yang terlibat dalam pengaturan apoptosis, peradangan, dan proliferasi sel (Bhat et al. 2018 ). TPO juga telah terbukti memperbaiki pembentukan sel endotel neuronal (Varghese et al. 2017 ). Meskipun temuan ini menjanjikan, mekanisme perlindungan spesifik TPO dalam kardiomiosit, terutama dalam kondisi hipoksia/reoksigenasi miokard (H/R), masih kurang dipahami. Oleh karena itu, menyelidiki potensi manfaat terapeutik TPO untuk MIRI sangatlah menarik.
Penelitian ini bertujuan untuk mengevaluasi efek perlindungan Dex dan TPO terhadap cedera miokardium yang diinduksi H/R pada sel kardiomiosit AC16, model in vitro MIRI yang banyak digunakan. Dengan memanfaatkan RNA-sequencing (RNA-seq) dan analisis bioinformatika, kami memeriksa profil ekspresi gen diferensial dan mengidentifikasi jalur pensinyalan utama yang diatur oleh Dex dan TPO. Penelitian ini berupaya memberikan wawasan yang lebih mendalam tentang mekanisme molekuler yang digunakan agen-agen ini untuk mengurangi cedera yang diinduksi H/R, yang berkontribusi pada pengembangan strategi terapi potensial untuk MIRI.
2 Metode
2.1 Kultur Sel dan Pengelompokan Percobaan
Lini sel kardiomiosit manusia AC16 dibeli dari Shanghai Cell Bank di Akademi Ilmu Pengetahuan Tiongkok (Shanghai, Tiongkok). Sel dikultur dalam medium Eagle yang dimodifikasi Dulbecco (DMEM) yang dilengkapi dengan 1% (v/v) penisilin-streptomisin (Beyotime Biotech., Shanghai, Tiongkok) dan 10% serum sapi janin (FBS, Gibco BRL, NY, AS) pada kepadatan 1 × 105 sel /sumur dalam pelat 96-sumur. Kultur dipertahankan pada suhu 37°C dalam inkubator yang dilembabkan (Mode: MCO-15 AC-SC, Sanyo, Tokyo, Jepang) dengan 5% CO 2 selama 24 jam. Setelah inkubasi ini, sel diobati dengan Dex (Jiangsu Hengrui Medicine Co. Ltd., Jiangsu, Tiongkok) yang dilarutkan dalam DMSO, atau TPO (PeproTech, NJ, AS) selama 30 menit.
Sel-sel dibagi menjadi tiga kelompok: Kontrol (CNTL), Dex, dan TPO. Dalam kelompok Dex, enam subkelompok diobati dengan peningkatan konsentrasi Dex (0,1, 0,3, 1,0, 3,0, 10,0, dan 30 nM). Kelompok TPO juga dibagi menjadi enam subkelompok, dengan konsentrasi 0,1, 0,3, 1,0, 3,0, 10,0, dan 30 ng/mL TPO. Setiap kondisi eksperimen dilakukan dalam rangkap tiga.
Untuk cedera H/R, sel AC16 dikultur dalam DMEM bebas glukosa yang dilengkapi dengan Dex atau TPO selama 30 menit. Selanjutnya, sel-sel tersebut mengalami kondisi hipoksia (95% nitrogen dan 5% CO 2 ) pada suhu 37°C selama 5 jam, diikuti oleh reoksigenasi di bawah 5% CO 2 selama 16 jam.
2.2 Uji Proliferasi Sel
Laju proliferasi sel AC16 dievaluasi menggunakan Cell Counting Kit-8 (CCK-8, Cat# 96992, Sigma-Aldrich, AS) sesuai dengan petunjuk pabrik pembuatnya. Secara singkat, sel AC16 dikultur dalam pelat 96-sumur (Corning, NY, AS) pada kepadatan 6000 sel/sumur dan diobati dengan berbagai konsentrasi Dex atau TPO. Setelah terpapar pada kondisi H/R, sel dikultur selama 0, 12, dan 24 jam. Larutan CCK-8 ditambahkan ke setiap sumur, dan inkubasi dilanjutkan selama 4 jam. Kepadatan optik diukur pada 450 nm dengan pembaca mikroplat (Thermo Fisher Scientific, MA, AS). Laju proliferasi sel (%) dihitung sebagai persentase penghambatan relatif terhadap kelompok CNTL.
2.3 Uji Apoptosis
Apoptosis pada sel AC16 dalam kondisi H/R dievaluasi dengan flow cytometry, pewarnaan Hoechst 33342, dan aktivitas caspase-3.
Untuk pewarnaan Hoechst 33342, sel difiksasi dalam formaldehida 4% (Sangon Biotech Co. Ltd., Shanghai, Tiongkok) pada suhu 4°C selama 10 menit, lalu diinkubasi dengan Hoechst 33342 (Cat# C1022, Beyotime Biotech.) pada konsentrasi akhir 5 μg/mL dalam gelap selama 10 menit. Sel AC16 yang diwarnai diperiksa di bawah mikroskop konfokal pemindai laser (Nikon A1R, Tokyo, Jepang) dengan eksitasi pada 350 nm dan emisi pada 460 nm.
Apoptosis diukur menggunakan Annexin V-PE/7-AAD Flow Cytometry Kit (Cat#559763, BD Biosciences, NJ, AS) untuk mengevaluasi laju apoptosis mengikuti petunjuk pabrik pembuatnya. Sel dicuci tiga kali dengan buffer D-Hanks (Beyotime Biotech.) pada suhu 4°C selama 5 menit dan disesuaikan dengan kepadatan 1 × 106 sel /mL. Selanjutnya, 7-AAD (5 μL) dan Annexin V-PE (1 μL) ditambahkan ke 100 μL suspensi sel per sumur, diikuti dengan inkubasi pada suhu ruangan selama 10 menit dalam gelap. Setelah menambahkan buffer pengikat (450 μL), sel dianalisis menggunakan FACSCalibur flow cytometer (BD Biosciences). Sel apoptosis diidentifikasi berdasarkan pewarnaan Annexin V-PE dan 7-AAD.
Aktivitas Caspase-3 dievaluasi menggunakan Caspase-3 Fluorometric Assay Kit (Cat# K105-25, BioVision, CA, AS). Sel-sel dikeluarkan dari pelat dengan pencernaan menggunakan tripsin (Cat# C0201, Beyotime Biotech.) dan dikumpulkan dengan sentrifugasi pada 600x g selama 5 menit. Sel-sel dilisiskan di atas es selama 15 menit, dan serpihan sel dipeletkan dengan sentrifugasi pada 20.000x g selama 15 menit pada suhu 4°C. Supernatan dikumpulkan untuk mengevaluasi aktivitas caspase-3 sesuai dengan petunjuk pabrik pembuatnya.
2.4 Pengukuran Ekspresi Rantai Ringan 3B (LC3B)
Autofagi dinilai dengan mengukur ekspresi LC3B dalam sel AC16. Sel disemai pada slide penutup dengan kepadatan 1 × 105 sel /slide dan dikultur selama 24 jam. Setelah pengobatan dengan Dex atau TPO, sel dicuci dengan garam penyangga fosfat (PBS, Beyotime Biotech.), diawali dengan 4% paraformaldehida (Beyotime Biotech.) selama 15 detik, dan kemudian dipermeabilisasi dengan metanol dingin (Sinopharm Chemical Reagent Co. Ltd., Shanghai, Tiongkok) pada suhu -20°C selama 10 menit. Slide yang telah disiapkan dicuci dengan PBS dan dikeringkan dengan udara pada suhu 24°C. Slide diinkubasi dengan anti-LC3B kelinci manusia (1:1000, Cat# ab168831, Abcam, Cambridge, Inggris) semalaman pada suhu 4°C. Kaca objek dicuci terus-menerus tiga kali dengan PBS selama 5 menit dan diinkubasi dengan antibodi antikelinci yang terkonjugasi fluorescein isothiocyanate (1:800, Cat# A0562, Beyotime Biotech) pada suhu 37°C selama 30 menit. Kaca objek yang diwarnai diamati di bawah mikroskop fluoresensi (Mode: H600L, Nikon, Tokyo, Jepang). Jumlah titik positif LC3B dievaluasi dan dihitung menggunakan perangkat lunak FV10-ASW 3.0 Image (Olympus, Tokyo, Jepang).
2.5 Isolasi RNA
Sel AC16 awalnya dikultur dalam tabung T25 dengan Medium Pertumbuhan Miosit Siap Pakai (Cat# C-22060, PromoCell GmbH, Heidelberg, Jerman) yang ditambah dengan 20% FBS (PromoCell GmbH) selama 24 jam. Medium sel diganti dengan DMEM yang mengandung 17% medium 199 (Cat# 11150059, Gibco BRL), 10% serum kuda (Gibco BRL), 5% FBS (Gibco BRL), dan 0,5% penisilin–streptomisin (Beyotime Biotech.). Setelah praperawatan dengan Dex atau TPO selama 30 menit, sel AC16 mengalami kondisi hipoksia pada suhu 37°C selama 5 jam dan kemudian dioksigenasi ulang dalam 5% CO 2 selama 16 jam. Total RNA diekstraksi menggunakan reagen TRIzol (Cat#R0016, Beyotime Biotech.) sesuai dengan petunjuk pabrik. Total RNA diukur menggunakan spektrofotometer (Mode: UV754N, Shanghai Aucy Sci. Ins. Ltd., Shanghai, Tiongkok). Integritas dan kemurnian RNA dinilai menggunakan RNA 6000 Nano LabChip Kit (Cat# 5067-1511) dan Bioanalyzer (Mode: Agilent 2100, Agilent Technologies, CA, AS). Angka integritas RNA adalah ≥ 9 dan rasio 260/280 adalah ≥ 2,0 untuk semua sampel.
2.6 Pengurutan RNA
RNA-seq dilakukan seperti yang dijelaskan sebelumnya (Florea et al. 2013 ) dengan sedikit modifikasi. cDNA untai pertama dan kedua disintesis menggunakan primer acak 6-basa, dNTP, RNase H, dan DNA polimerase I (Thermo Fisher Scientific). cDNA dimurnikan dan dicuci menggunakan QIAQuick PCR Purification Kit (Cat# 28104, Qiagen, Hilden, Jerman) sebelum menjalani perbaikan akhir, adenilasi 3′, dan ligasi adaptor sekuensing menggunakan TruSeq RNA Sample Preparation Kit (Cat# RS-122-2503, Illumina, San Diego, CA, AS). cDNA yang dimurnikan dipulihkan dengan elektroforesis gel agarosa, dan PCR dilakukan untuk mendapatkan pustaka seluruh transkriptom. Akhirnya, sampel diurutkan menggunakan protokol PE150. Kedalaman sekuensing ditetapkan pada 30–50 juta pembacaan ujung berpasangan per sampel, dengan panjang pembacaan minimum 75–100 pasangan basa yang diperlukan untuk memastikan cakupan yang memadai dan identifikasi yang akurat terhadap peristiwa penyambungan alternatif, serta deteksi tingkat ekspresi gen yang andal.
2.7 Analisis Komputasional dan Anotasi Fungsional Gen
Data sekuens mentah diproses menggunakan FastQC (Versi 0.11.9) untuk menilai kualitas pembacaan, diikuti dengan pemangkasan sekuens berkualitas rendah dan penghapusan sekuens adaptor menggunakan Trim Galore (Versi 0.6.5) dengan parameter berikut: panjang pembacaan minimum 50 bp dan ambang batas skor kualitas 30. Pembacaan berkualitas tinggi kemudian diselaraskan dengan genom referensi manusia (GRCh38) menggunakan HISAT2 (Versi 2.1.0) dengan pengaturan default. Analisis ekspresi diferensial dilakukan pada data yang diselaraskan menggunakan paket EdgeR (versi 3.28.1), yang menggunakan model berbasis Poisson untuk menilai varians data RNA-seq.
Anotasi analisis fungsional gen dilakukan menggunakan Database for the Annotation, Visualization and Integrated Discovery (DAVID, Versi 6.7) untuk ontologi gen (GO) dan analisis pengayaan Kyoto Encyclopedia of Genes and Genomes (KEGG). Istilah GO dianggap diperkaya ketika nilai p -nya < 0,05. Untuk analisis KEGG, jalur KEGG dengan false discovery rate (FDR) < 0,05 dianggap diperkaya secara signifikan. Semua parameter dan metode yang digunakan dalam analisis ini telah dijelaskan sebelumnya (Herrer et al. 2014 ; Kanehisa et al. 2016 ; Paquette and Tokuyasu 2010 ).
2.8 Analisis Penyambungan Alternatif
Penyambungan alternatif adalah proses yang mengubah prekursor mRNA menjadi beberapa isoform mRNA melalui penyambungan diferensial atau situs penyambungan yang berbeda (Florea et al. 2013 ). Metode pemetaan OLego dan jalur Quantas diterapkan pada data RNA-seq untuk mengidentifikasi potensi kejadian penyambungan alternatif menurut alur kerja yang dipublikasikan sebelumnya (Wu et al. 2013 ).
2.9 Analisis Variasi Gen
Varian gen, termasuk polimorfisme nukleotida tunggal (SNP) dan insersi/delesi (InDels), diidentifikasi menggunakan Samtools dengan membandingkan data RNA-seq yang selaras dengan genom referensi (Li et al. 2009 ). Distribusi dan frekuensi varian ini dianalisis, dengan hasil yang dibandingkan dengan data yang dipublikasikan sebelumnya tentang variasi gen sebagai respons terhadap perawatan (Boland et al. 2013 ).
2.10 Analisis Statistik
Analisis statistik dilakukan menggunakan perangkat lunak SPSS 20.0 (SPSS Inc., Chicago, IL, AS). Normalitas dinilai menggunakan uji Shapiro–Wilk, dan homogenitas varians diuji dengan uji Levene. Data direpresentasikan sebagai mean ± simpangan baku (SD). Untuk perbandingan antara lebih dari dua kelompok, analisis varians satu arah (ANOVA) digunakan, diikuti oleh uji post hoc Tukey untuk mengidentifikasi perbedaan berpasangan. Untuk perbandingan dua kelompok, uji t Student diterapkan. Setiap percobaan dilakukan dengan setidaknya tiga replikasi biologis independen. Nilai p < 0,05 dianggap signifikan secara statistik.
3 Hasil
3.1 Dex dan TPO Meningkatkan Proliferasi pada Sel AC16 yang Diobati H/R
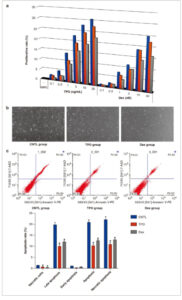
Sel AC16 berhasil dikultur, dan efek Dex atau TPO dievaluasi setelah cedera H/R dengan menggunakan uji CCK-8. Dibandingkan dengan kelompok CNTL, laju proliferasi sel AC16 yang diobati dengan TPO meningkat secara signifikan dalam cara yang bergantung pada dosis (Gambar 1a , p < 0,05). Pada konsentrasi TPO yang diindikasikan, laju proliferasi menurun dengan meningkatnya waktu kultur berkisar antara 0 hingga 24 jam (Gambar 1a , p < 0,05). Laju proliferasi sel AC16 yang diobati dengan Dex juga meningkat secara serupa dalam cara yang bergantung pada dosis (Gambar 1a , p < 0,05) dan menurun dengan meningkatnya waktu kultur (Gambar 1a , p < 0,05). Laju proliferasi sel AC16 yang diobati dengan H/R dalam kelompok TPO secara signifikan lebih tinggi daripada yang ada dalam kelompok Dex (Gambar 1a , p < 0,05). Hal ini menunjukkan bahwa TPO dan Dex dapat melindungi sel AC16 dari cedera H/R. Berdasarkan hasil uji CCK-8, 10 ng/mL TPO dan 10 nM Dex digunakan dalam percobaan berikutnya.
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Dex dan TPO meningkatkan proliferasi dan menghambat apoptosis sel AC16. (a) Efek Dex dan TPO pada proliferasi sel AC16. (b, c) Efek Dex dan TPO pada apoptosis sel AC16. * p < 0,05 untuk perbandingan dengan kelompok CNTL. CNTL, kontrol; Dex, deksmedetomidin; TPO, trombopoietin.
3.2 Dex dan TPO Menghambat Apoptosis dan Aktivitas Caspase-3 pada Sel AC16 yang Diobati H/R
Dex dan TPO secara signifikan memperbaiki morfologi sel AC16 yang diobati dengan H/R dengan mengurangi penyusutan sel dan memulihkan bentuk sel normal (Gambar 1b ). Persentase sel nekrotik, sel apoptosis awal, dan sel apoptosis akhir dievaluasi dengan flow cytometry. Persentase sel nekrotik, sel apoptosis awal, sel apoptosis akhir, dan total sel apoptosis pada kelompok Dex dan TPO menurun secara signifikan dibandingkan dengan kelompok CNTL (Gambar 1c , semua p < 0,05). Proporsi sel nekrotik dan apoptosis pada kelompok Dex secara signifikan lebih tinggi daripada kelompok TPO (Gambar 1c , p < 0,05).
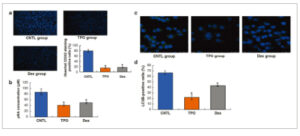
Pewarnaan Hoechst 33342 pada kelompok Dex dan TPO menurun secara signifikan dibandingkan dengan kelompok CNTL (Gambar 2a , p < 0,05). Aktivitas caspase-3 yang ditunjukkan oleh konsentrasi p-nitroaniline pada kelompok Dex dan TPO juga menurun secara signifikan dibandingkan dengan kelompok CNTL (Gambar 2b , p < 0,05). Hasil ini menunjukkan bahwa TPO dan Dex dapat memperbaiki kematian sel yang disebabkan oleh cedera H/R.
 GAMBAR 2
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Dex dan TPO mengurangi aktivitas caspase-3 dan autofagi pada sel AC16 dengan cedera H/R. (a, b) Efek Dex dan TPO pada aktivitas caspase-3. (c, d) Efek Dex dan TPO pada autofagi. * p < 0,05 untuk perbandingan dengan kelompok CNTL. CNTL, kontrol; Dex, deksmedetomidin; TPO, trombopoietin.
3.3 Dex dan TPO Mengurangi Autophagy pada Sel AC16 yang Diobati H/R
Autophagy adalah jenis kematian sel terprogram, yang biomarker spesifiknya adalah LC3B (Song et al. 2017 ). Dibandingkan dengan kelompok CNTL, jumlah sel positif LC3B dalam kelompok Dex dan TPO menurun secara signifikan (Gambar 2c,d , p < 0,05). Hasil ini menunjukkan bahwa Dex dan TPO dapat menghambat autophagy yang disebabkan oleh H/R.
3.4 Dex dan TPO Menginduksi Ekspresi Gen Diferensial pada Sel AC16
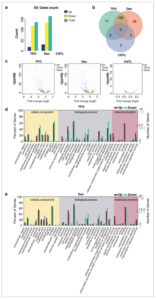
Dibandingkan dengan kelompok CNTL, 31 gen yang mengalami peningkatan regulasi dan 134 gen yang mengalami penurunan regulasi diidentifikasi dalam kelompok Dex, sementara kelompok TPO menunjukkan 19 gen yang mengalami peningkatan regulasi dan 118 gen yang mengalami penurunan regulasi (Gambar 3a ). Yang penting, sementara tidak ada gen yang diekspresikan secara berbeda secara signifikan (DEG) antara kelompok Dex dan TPO, analisis tersebut mengungkapkan bahwa kedua perlakuan tersebut memiliki 120 DEG yang sama, yang menunjukkan beberapa respons molekuler yang sama. Selain itu, ada 17 DEG unik dalam kelompok TPO dan 45 DEG unik dalam kelompok Dex (Gambar 3b ), yang menyoroti mekanisme molekuler berbeda yang dipengaruhi oleh setiap perlakuan. Plot gunung berapi dan diagram Venn gen (Gambar 3c ) selanjutnya menggambarkan distribusi tingkat ekspresi gen dan signifikansi statistik yang sama antara kelompok Dex dan TPO, yang memperkuat pengamatan DEG yang sama dan unik.
 GAMBAR 3
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
Dex dan TPO menginduksi ekspresi gen yang berbeda pada sel AC16 dengan cedera H/R. (a) Jumlah gen yang diekspresikan secara berbeda pada sel AC16. (b) Tumpang tindih gen yang diekspresikan secara berbeda pada kelompok yang berbeda. (c) Plot gunung berapi gen yang diekspresikan secara berbeda pada kelompok yang berbeda. (d) Analisis fungsional GO dari gen yang diekspresikan secara berbeda pada kelompok TPO. (e) Analisis fungsional GO dari gen yang diekspresikan secara berbeda pada kelompok Dex. CNTL, kontrol; DE, diekspresikan secara berbeda; Dex, deksmedetomidin; TPO, trombopoietin.
3.5 Analisis Fungsional GO
Analisis fungsional GO mengungkapkan bahwa ada 12 gen yang terkait dengan komponen seluler (CC), 19 gen yang terkait dengan proses biologis (BP), dan 9 gen yang terkait dengan fungsi molekuler (MF) dalam kelompok TPO (Gambar 3d ). Sebagai perbandingan, kelompok Dex menunjukkan 13 gen untuk CC, 20 gen untuk BP, dan 9 gen untuk MF (Gambar 3e ). Kedua kelompok menunjukkan istilah GO, jumlah gen, dan persentase gen yang serupa, yang menunjukkan bahwa efek TPO dan Dex pada regulasi gen memiliki beberapa kesamaan. Di antara DEG, gen yang paling signifikan diubah adalah gen bagian sel dalam kategori CC, gen proses seluler dalam kategori BP, dan gen pengikat dalam kategori MF (Gambar 3d,e ).
3.6 Analisis Pengayaan GO
Analisis pengayaan GO mengidentifikasi istilah-istilah yang diperkaya untuk protein-protein yang diatur secara berbeda yang unik untuk kelompok TPO dan kelompok Dex. Istilah-istilah yang diperkaya untuk kelompok TPO mencakup regulasi negatif proses metabolisme seluler, diferensiasi sel, dan regulasi negatif proses metabolisme. Istilah-istilah yang diperkaya untuk kelompok Dex mencakup regulasi perkembangan organisme multiseluler, proses perkembangan, dan regulasi negatif proses organisme multiseluler. Hal ini menunjukkan bahwa perlakuan TPO menyebabkan perubahan dalam diferensiasi sel dan proses metabolisme, sedangkan perlakuan Dex menyebabkan perubahan dalam pertumbuhan dan perkembangan sel.
3.7 Analisis Pengayaan Jalur KEGG
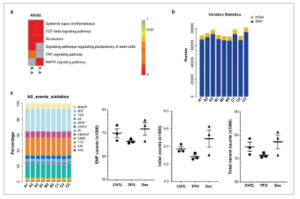
Kami melakukan analisis pengayaan jalur KEGG untuk mengidentifikasi jalur biologis yang terkait dengan pengobatan TPO dan Dex. Kami mengidentifikasi lima jalur KEGG yang diperkaya berdasarkan gen-gen unik yang terganggu fungsinya dalam kelompok TPO, termasuk lupus eritematosus sistemik, jalur pensinyalan TGF-β, alkoholisme, dan jalur pensinyalan (Gambar 4a ). Empat jalur KEGG menunjukkan pengayaan DEG yang signifikan dalam kelompok Dex, termasuk jalur pensinyalan MAPK, alkoholisme, lupus eritematosus sistemik, dan jalur pensinyalan TGF-β (Gambar 4a ). Lupus eritematosus sistemik, jalur pensinyalan TGF-β, dan alkoholisme adalah jalur KEGG yang umum. Jalur pensinyalan yang mengatur pluripotensi sel punca dan jalur pensinyalan TNF adalah jalur KEGG yang unik dalam kelompok TPO. Khususnya, kelompok Dex secara unik melibatkan jalur pensinyalan MAPK (Gambar 4a ).
 GAMBAR 4
GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
(a) Analisis pengayaan jalur KEGG dalam kelompok Dex dan TPO pada sel AC16. (b) Dex dan TPO tidak memiliki efek pada peristiwa penyambungan pada sel AC16 dengan cedera H/R. (c) Efek Dex dan TPO pada jumlah SNP, InDel, dan total peristiwa. KEGG, Ensiklopedia Gen dan Genom Kyoto; SNP, polimorfisme nukleotida tunggal.
3.8 Efek Dex dan TPO pada Penyambungan Alternatif Sel AC16 yang Terpapar H/R
Tidak ada perbedaan dalam kejadian penyambungan alternatif dan jumlah penyambungan alternatif antara kelompok CNTL, Dex, dan TPO (Gambar 4b , p > 0,05). Oleh karena itu, pengobatan Dex dan TPO tidak menghasilkan penyambungan alternatif pada sel AC16.
3.9 Efek Dex dan TPO pada Mutasi SNP, InDel, dan Total pada Sel AC16 yang Terpapar H/R
Tidak ada perbedaan signifikan dalam frekuensi varian gen, termasuk SNP, InDel, dan total mutasi, di antara kelompok CNTL, Dex, dan TPO (Gambar 4c , p > 0,05). Baik pengobatan Dex maupun TPO tidak memengaruhi distribusi frekuensi mutasi SNP (Gambar 5a , p > 0,05). Tidak ada perbedaan signifikan dalam panjang InDel antara kelompok CNTL, Dex, dan TPO (Gambar 5b , p > 0,05). Secara bersama-sama, Dex dan TPO tidak menyebabkan perubahan dalam frekuensi mutasi gen pada sel AC16 yang terpapar H/R
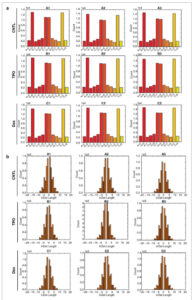 GAMBAR 5
GAMBAR 5
Buka di penampil gambar
Kekuatan Gambar
Dex dan TPO tidak memiliki efek pada distribusi frekuensi mutasi SNP (a) atau panjang InDel (b) pada sel AC16 dengan cedera H/R. CNTL, kontrol; Dex, deksmedetomidin; TPO, trombopoietin.
4 Diskusi
Dalam penelitian ini, kami menunjukkan bahwa Dex dan TPO mendorong proliferasi sel AC16 yang mengalami cedera H/R dengan cara yang bergantung pada konsentrasi. Perlindungan terhadap cedera yang disebabkan H/R ini konsisten dengan laporan sebelumnya yang menunjukkan efek kardioprotektif dari Dex (Ammar et al. 2016 ; Jia et al. 2017 ; Yang et al. 2017 ) dan TPO (Baker et al. 2015 ; Bethel et al. 2015 ). Kedua pengobatan tersebut secara signifikan menekan apoptosis dan autofagi pada sel AC16 yang terpapar H/R, suatu hasil yang kemungkinan besar disebabkan oleh penghambatan aktivitas caspase-3, penanda utama apoptosis.
Penggunaan model H/R pada sel AC16 sangat relevan untuk mempelajari MIRI. MIRI adalah proses kompleks yang terjadi ketika suplai darah ke jantung dipulihkan setelah periode iskemia. Pengenalan kembali oksigen menyebabkan stres oksidatif, kerusakan sel, dan apoptosis, menjadikannya model yang ideal untuk menyelidiki strategi kardioprotektif. Sel AC16, sebagai garis sel kardiomiosit yang berasal dari manusia, menawarkan sistem in vitro yang relevan untuk meniru kondisi patofisiologis ini (Huang et al. 2023 ). Temuan kami memberikan wawasan berharga tentang bagaimana Dex dan TPO mengurangi kerusakan yang disebabkan oleh cedera tersebut, yang menunjukkan potensinya sebagai agen terapeutik untuk MIRI.
Untuk menjelaskan mekanisme yang mendasari Dex dan TPO dalam cedera H/R, kami melakukan analisis bioinformatika menggunakan RNA-seq. Meskipun tidak ada DEG antara kelompok Dex dan TPO, kami mengidentifikasi 120 DEG bersama antara kedua perawatan. Gen-gen umum ini, dikombinasikan dengan analisis fungsi GO, menunjukkan bahwa Dex dan TPO berbagi mekanisme aksi yang sama pada tingkat transkripsi, khususnya dalam mengatur CC, BP, dan MF. Namun, analisis tersebut juga mengungkapkan tanda tangan gen yang unik untuk setiap perawatan, yang menunjukkan bahwa Dex dan TPO memiliki tindakan molekuler yang berbeda. Misalnya, perawatan Dex diperkaya dalam gen yang terkait dengan “perkembangan organisme multiseluler,” yang konsisten dengan penelitian sebelumnya (Kuter 2013 ; Lupia et al. 2012 ). Sebaliknya, TPO secara unik mengatur gen yang terlibat dalam fungsi trombosit dan aktivasi faktor transkripsi, termasuk glikoprotein trombosit manusia 6, keluarga faktor transkripsi mamalia terkait forkhead 1, dan faktor transkripsi keluarga GATA dengan mengaktifkan proses demetilasi (Kanaji et al., 2005 ; Tanaka et al., 2001 ), yang menunjukkan perannya dalam hematopoiesis dan peradangan.
Anotasi fungsional lebih lanjut dari DEG menggunakan analisis pengayaan jalur KEGG mengungkapkan jalur bersama dan unik yang dimodulasi oleh Dex dan TPO. Kedua perawatan memperkaya jalur yang terkait dengan lupus eritematosus sistemik, pensinyalan TGF-β, dan alkoholisme. Menariknya, sementara kelompok TPO secara unik memperkaya jalur yang terkait dengan regulasi pluripotensi sel punca dan pensinyalan TNF, jalur pensinyalan MAPK secara unik diperkaya dalam kelompok yang diobati dengan Dex. Jalur MAPK terkenal karena perannya dalam kelangsungan hidup sel, peradangan, dan apoptosis. Penelitian sebelumnya telah menunjukkan bahwa Dex dapat mengaktifkan jalur MAPK untuk melindungi kardiomiosit dari cedera iskemia/reperfusi (Li et al. 2019 ). Hal ini menunjukkan bahwa jalur MAPK memainkan peran penting dalam efek perlindungan Dex terhadap cedera yang diinduksi H/R.
Pengayaan jalur TGF-β pada kedua kelompok Dex dan TPO sangat penting. TGF-β adalah sitokin pleiotropik yang terlibat dalam berbagai proses seluler seperti diferensiasi sel, proliferasi, dan apoptosis (Liu et al. 2018 ; Zhang et al. 2014 ). Keterlibatannya dalam kedua pengobatan menunjukkan peran utamanya dalam memediasi efek kardioprotektif Dex dan TPO. Selain itu, pengayaan unik jalur pensinyalan TNF dalam kelompok yang diobati dengan TPO, yang mencakup molekul kunci seperti faktor nuklir κB (NF-κB) dan PI3K/Akt, menunjukkan bahwa TPO dapat memodulasi jalur peradangan dan kelangsungan hidup sel untuk meningkatkan kardioproteksi (Abdelwahid et al. 2016 ; Chen dan Goeddel 2002 ; Foulquier et al. 2018 ; Jackman et al. 2009 ; Li et al. 2017 ; Zhu et al. 2018 ). Temuan ini memberikan pemahaman yang lebih dalam tentang peran Dex dan TPO yang berbeda namun saling melengkapi dalam mengurangi cedera H/R.
Selain itu, hasil kami menunjukkan bahwa Dex dan TPO tidak memengaruhi laju penyambungan alternatif atau mutasi gen secara signifikan pada sel AC16 yang mengalami cedera H/R, yang menunjukkan bahwa efek perlindungannya kemungkinan tidak dimediasi oleh perubahan tingkat DNA. Pengamatan ini sejalan dengan penelitian sebelumnya yang telah menunjukkan bahwa Dex dan TPO terutama bekerja melalui jalur pensinyalan seluler daripada melalui mutasi genetik atau peristiwa penyambungan alternatif (Fu et al. 2025 ; Sun et al. 2024 ).
Dibandingkan dengan penelitian sebelumnya, studi kami lebih jauh menjelaskan potensi tumpang tindih dan perbedaan dalam mekanisme Dex dan TPO. Sementara kedua agen memiliki jalur yang sama seperti TGF-β dan lupus eritematosus sistemik, mereka juga menunjukkan tindakan molekuler yang unik, khususnya dalam jalur MAPK untuk Dex dan regulasi sel induk dan jalur TNF untuk TPO. Perbandingan ini menggarisbawahi potensi agen-agen ini dalam menargetkan beberapa jalur seluler untuk memberikan perlindungan terhadap cedera iskemia/reperfusi. Studi lebih lanjut diperlukan untuk memvalidasi temuan ini pada lini sel lain dan model hewan MIRI.
Sebagai kesimpulan, Dex dan TPO menawarkan strategi yang menjanjikan untuk pengobatan MIRI dengan meningkatkan proliferasi sel, menghambat apoptosis, dan mengurangi autofagi. Analisis bioinformatika menunjukkan bahwa efek perlindungan Dex dan TPO dimediasi melalui jalur molekuler yang kompleks, saling tumpang tindih, dan berbeda. Penelitian lebih lanjut harus mengeksplorasi bagaimana jaringan pensinyalan ini berinteraksi secara in vivo dan apakah Dex dan TPO dapat diubah menjadi terapi klinis untuk MIRI. Lebih jauh, temuan penelitian ini menyoroti keuntungan penggunaan Dex dalam anestesi klinis, khususnya dalam konteks operasi jantung, di mana meminimalkan cedera miokardium sangat penting.

