ABSTRAK
Dihidroartemisinin (DHA) adalah turunan artemisinin, yang memengaruhi peradangan, stres oksidatif, dan regulasi imun. Namun, mekanisme yang mendasari efeknya sebagian besar masih belum diketahui. Studi ini bertujuan untuk mengeksplorasi mekanisme yang digunakan DHA untuk memengaruhi cedera paru akibat radiasi (RILI), sehingga memberikan wawasan baru untuk radioterapi paru. Untuk menjelaskan mekanisme kerjanya, tikus C57BL/6 J diradiasi dengan 15 Gy di seluruh dada. RILI dievaluasi dengan qRT-PCR, ELISA, histologi, analisis Western blot, imunohistokimia, dan studi kaskade pensinyalan RILI. Selain itu, RNA pengganggu kecil digunakan untuk merobohkan protein cGAS dalam jalur pensinyalan cGAS-STING dalam garis sel epitel bronkial manusia (BEAS-2B). Eksperimen In Vivo dan Vitro dilakukan untuk menyelidiki mekanisme spesifik yang digunakan DHA untuk meredakan RILI. Kami mengamati aktivasi jalur cGAS-STING, bersama dengan fosforilasi target hilir NF-κB dan peningkatan kadar faktor inflamasi pada model tikus setelah paparan radiasi. Dalam model sel, iradiasi juga memicu aktivasi jalur pensinyalan cGAS-STING dan target hilirnya, yang menyebabkan peningkatan kadar faktor inflamasi. Khususnya, pengurangan cGAS menggunakan RNA pengganggu kecil dalam sel BEAS-2B secara signifikan mengurangi RILI dalam model sel. Studi kami menjelaskan mekanisme DHA yang mengurangi RILI melalui jalur pensinyalan cGAS/STING/NF-κB, dan mengungkapkan bahwa sumbu GAS/STING/NF-κB mungkin merupakan target terapi potensial untuk RILI.
Singkatan
CCK-8
Kit Penghitungan Sel-8
CVF
fraksi volume kolagen
Asam lemak tak jenuh (DHA)
dihidroartemisinin
DIA
hematoksilin dan eosin
Posyandu
imunohistokimia
IR
penyinaran
RILI
cedera paru akibat radiasi
RT
radioterapi
siRNA
RNA pengganggu kecil
WB
Western bercak
1 Pendahuluan
Radioterapi (RT) merupakan salah satu pilihan pengobatan utama untuk kanker toraks. Namun, paru-paru merupakan organ pembatas dosis utama di toraks karena merupakan organ yang rentan terhadap radiasi pengion (Hanania et al. 2019 ). Kualitas hidup pasien dipengaruhi oleh kerusakan paru-paru akibat radiasi (RILI), yang menyebabkan toksisitas molekuler dan seluler dini dan lanjut, beberapa di antaranya tidak dapat dipulihkan (Curras-Alonso et al. 2023 ).
Kerusakan DNA langsung dan produksi spesies oksigen reaktif adalah proses utama yang menyebabkan RILI. Peristiwa ini memicu pensinyalan intraseluler dan menyebabkan pelepasan berbagai molekul dan sitokin untuk meningkatkan peradangan dan respons imun (Abratt et al. 2004 ; Azzam et al. 2012 ). Setelah iradiasi, sel menghasilkan molekul DAMP, yang membantu menarik neutrofil, makrofag, leukosit, dan limfosit (Ryter et al. 2007 ). Banyak sitokin, termasuk interleukin 3 (IL-3), interleukin 6 (IL-6), interferon-γ, transforming growth factor β (TGF-β), tumor necrosis factor α (TNF-α), dan HMGB1, terbentuk di jaringan paru-paru yang rusak sebagai akibat dari transmigrasi sel imun. Melalui berbagai jalur pensinyalan, kejadian ini memicu respons inflamasi yang mengakibatkan pneumonitis akut dan fibrosis paru persisten (Barker et al. 2015 ). Tiga jalur pensinyalan utama RILI meliputi jalur pensinyalan TGF-β/SMAD, jalur pensinyalan HMGB1/TLR4, dan jalur pensinyalan Nrf2/ARE (Ning et al. 2024 ).
Selain itu, jalur pensinyalan terkait kerusakan, seperti ROS/spesies nitrogen reaktif dan cGAS-STING, berkontribusi pada proses awal cedera paru-paru, dengan cGAS yang diaktifkan memicu imunitas bawaan dengan melepaskan siklik GMP-AMP (cGAMP), yang mengikat dan mengaktifkan STING (Benmerzoug et al. 2018 ; Chen et al. 2016 ). Pengatur utama respons inflamasi, NF-κB, telah dikaitkan dengan sintesis berbagai sitokin dan kemokin inflamasi, termasuk TNF-α, IL-1β, dan IL-6 (Zhong et al. 2024 ). Patofisiologi RILI sebagian besar dimediasi oleh sitokin ini (Carvalho et al. 2019 ). Meskipun demikian, sedikit yang diketahui tentang proses yang mendasari inflamasi paru pada penginderaan dsDNA abnormal melalui jalur cGAS-STING setelah RT toraks.
Artemisinin berasal dari herba tahunan Artemisia annua L., yang telah digunakan sebagai obat tradisional selama lebih dari 2000 tahun. Dihidroartemisinin (DHA) adalah turunan generasi pertama dari senyawa ini. Artemisinin dan turunannya (ART) telah menyembuhkan lebih dari satu juta pasien malaria (Dai et al. 2021 ). Rumus molekul DHA adalah C 15 H 24 O 5 dan berat molekulnya adalah 284,35 (Gambar S1 . Gambar dari basis data PubChem). Artemisinin secara tradisional digunakan untuk mengobati malaria, penelitian terbaru telah menemukan bahwa turunannya juga menunjukkan efek antiinflamasi, antifibrotik, dan imunoregulasi (Li et al. 2006 ; Xu et al. 2007 ), dan beberapa penelitian telah menunjukkan bahwa ia memainkan peran penting dalam stres oksidan dalam patogenesis kanker (Dai et al. 2021 ). Dalam penelitian kami sebelumnya, pengobatan DHA ditemukan dapat melemahkan RILI pada tikus (Ning et al. 2024 ). Hal ini menunjukkan bahwa DHA memiliki beberapa efek perlindungan pada RILI. Namun, peran spesifiknya dalam RILI masih belum dipahami dengan baik. Untuk mengatasi hal ini, penelitian kami menyelidiki apakah efek perlindungan DHA terkait dengan aktivasi jalur cGAS/STING/NF-κB dan apakah DHA dapat mengurangi RILI dengan menghambat jalur ini. Kami menilai efek perlindungan DHA pada RILI dengan memaparkan sel BEAS-2B dan tikus C57BL/6 ke DHA bersama dengan dosis radiasi yang diindikasikan. Penelitian ini bertujuan untuk membangun landasan teoritis yang kuat untuk pencegahan dan pengobatan RILI.
2 Bahan dan Metode
2.1 Hewan
Tikus jantan C57BL/6 (usia 6–8 minggu, berat 18–22 g) disediakan oleh Pusat Percobaan Hewan Universitas Kedokteran Guangxi, Tiongkok. Tikus dipelihara di lingkungan berventilasi dengan pemberian makan dan minum sepuasnya pada suhu konstan 24°C ± 1°C. Komite Etik Institusional Universitas Kedokteran Guangxi memberikan persetujuannya terhadap penelitian ini (No. KY-2023-505).
2.2 Iradiasi Hewan
Pemodelan RILI diinformasikan oleh literatur yang ada pada model tikus RILI dan penelitian dasar yang telah divalidasi sebelumnya pada model yang berhasil (Ning et al. 2024 ; Wang et al. 2023 ). Tikus dibius dengan injeksi intraperitoneal 1% natrium pentobarbital (50 mg/kg). Setelah anestesi, tikus diiradiasi dengan iradiasi toraks vertikal tunggal dengan sinar-X dari akselerator linier 6 MV (Elekta, Versa HD, Swedia) pada dosis tunggal 15 Gy (jarak sumber ke sumbu 100 cm dan laju dosis 600 MU/menit).
2.3 Manajemen Obat
Dalam percobaan awal penelitian ini, kami memilih dosis 10, 50, 100, dan 200 mg/kg/hari untuk menguji efek perlindungan DHA (71939-50-9, Aladdin, Shanghai, Cina, kemurnian 98%) terhadap RILI. Tikus diberi DHA secara gavage sekali sehari selama 30 hari dimulai pada hari kedua penyinaran. Kemudian, kami membagi tikus ke dalam kelompok dosis sederhana dengan konsentrasi obat yang berbeda (10, 20, 50, dan 100 mg/kg/hari) tanpa pengobatan penyinaran, dan diberi DHA secara gavage setiap hari selama 30 hari. Spesimen jaringan paru-paru dikumpulkan pada hari ke-30 untuk pewarnaan HE. Berdasarkan literatur yang ada (Li, Sun, et al. 2019 ; Li, Zhou, et al. 2019 ) dan hasil percobaan awal kami, dosis 50 mg/kg/hari dipilih dalam penelitian ini untuk menguji efek perlindungan DHA terhadap RILI. Dalam percobaan ini, kami membagi tikus secara acak menjadi tiga kelompok: kelompok kontrol, kelompok iradiasi, kelompok iradiasi + DHA. Selain kelompok kontrol, dua kelompok tikus lainnya juga menjadi sasaran pemodelan RILI. Sejak hari kedua iradiasi, baik kelompok kontrol maupun iradiasi diberi plasebo. Kelompok iradiasi + DHA menerima DHA melalui gavage lambung harian (50 mg/kg). Perawatan dilakukan selama 30 hari berturut-turut. Rencana percobaan ditampilkan dalam (Gambar 1A ).
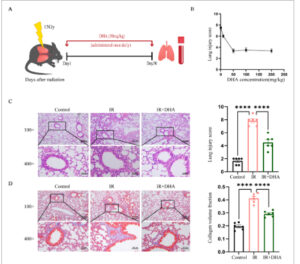
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
DHA secara signifikan mengurangi cedera paru-paru akibat radiasi pada C57BL/6. (A) Skema studi pengobatan DHA. (B) Kurva dosis-efek untuk dosis DHA dan skor patologi HE. (C) Pewarnaan H&E representatif dan skor cedera paru-paru; skala: 200 μm (×100) dan 20 μm (×400). (D) Pewarnaan trikrom Masson representatif dan perbandingan fraksi volume kolagen pada setiap kelompok; skala: 200 μm (×100) dan 20 μm (×400). DHA, dihidroartemisinin; H&E, hematoksilin dan eosin; IR, iradiasi; IR + DHA, iradiasi + DHA. * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001.
2.4 Sampel Jaringan Tikus
Pengambilan sampel jaringan dilakukan pada Hari ke-30 setelah penyinaran. Darah diambil dari jantung dan dibiarkan pada suhu kamar selama 2 jam sebelum disentrifugasi selama 15 menit (4°C, 665 RCF). Serum yang dihasilkan disimpan pada suhu -80°C dalam lemari pembeku. Jaringan paru segar diambil dari kedua sisi, diawetkan pada suhu -80°C untuk analisis WB, dan direndam dalam paraformaldehida 4% (b/v) untuk imunohistokimia (IHC), pewarnaan trikrom Masson, dan hematoksilin dan eosin (H&E).
2.5 Kultur Sel dan Knockdown cGAS
Sel-sel garis sel epitel bronkial manusia (BEAS-2B) diperoleh dari Bank Sel Akademi Sains Tiongkok. Sel-sel ditumbuhkan dalam medium DMEM (Gibco, New York, AS) yang mengandung 10% FBS dalam inkubator 37°C, 5% CO 2. Sel-sel tersebut ditransplantasikan tiga kali seminggu sesuai dengan protokol eksperimen yang ditetapkan.
Sel BEAS-2B disemai dalam pelat enam sumur dan dibiarkan mencapai konfluensi 70% setelah 24 jam. Sel ditransfeksi dengan plasmid untuk si-cGAS, dan kontrol negatif (20 uM, Gen) menggunakan reagen Lipofectamine 3000 dengan mengikuti panduan pengguna. Sel dipanen untuk ekstraksi RNA dan ekstraksi protein masing-masing 48 jam setelah transfeksi. SiRNA berikut digunakan:
cGAS-homo-774, 5′-GGAGCUACUAUGAGCACGUTT-3′
cGAS-homo-1054, 5′-CCCUGCUGUAACACUUCUUTT-3′
cGAS-homo-1266, 5′-GGCUAUCCUUCUCUCACAUT-3′
cGAS-homo-1460, 5′-GCCUUCUUUCACGUAUGUATT-3′
2.6 RNA-Seq
Sampel tikus C57BL/6 digunakan untuk analisis RNA-Seq oleh Majorbio (Shanghai, Cina). Singkatnya, setelah penipisan RNA ribosomal, pustaka mRNA, lncRNA, dan circRNA dibuat menggunakan Total RNA-seq (H/M/R) Library Prep Kit (Illumina). Setelah selesainya pembuatan pustaka RNA dan pengujian kualitas menggunakan Agilent 2100 Bioanalyzer, pengurutan throughput tinggi dilakukan untuk mengambil bacaan mentah pada Illumina HiSeq X10 PE150 (Illumina, San Diego, CA). Setelah penghapusan data berkualitas rendah, pembacaan sekuens gabungan, dan pembacaan dengan banyak sekuens N dari pembacaan mentah, pembacaan bersih dipilih. Selain itu, pembacaan efektif diperoleh setelah sekuens RNA ribosomal dihilangkan. Setelah menghilangkan sekuens berkualitas rendah dan yang mengandung penghubung dari data sekuens asli, kami mendapatkan pembacaan bersih. Basis data NCBI menyediakan genom referensi, yang kemudian diselaraskan menggunakan program Tophat. Gen dengan ekspresi diferensial disaring menggunakan program DESeq. 2 R, dan gen dengan ekspresi diferensial dikarakterisasi sebagai FDR < 0,05 dan FC > 2. Alat clusterProfiler untuk analisis pengayaan KEGG (ensiklopedia gen dan genom Kyoto) juga digunakan dalam penelitian ini. Pengaturan parameter analisis mengadopsi pengaturan default perangkat lunak, opsi spesifisitas jaringan adalah sedang, dan hasilnya ditunjukkan saat p < 0,05.
2.7 Histologi Paru dan IHC
Mengikuti protokol normal, jaringan paru-paru difiksasi dalam larutan paraformaldehida 4% (b/v), ditanamkan dalam parafin, diiris pada 5 µm, dan diwarnai dengan trikrom Masson dan H&E. Untuk IHC, irisan parafin diinkubasi semalam pada suhu 4°C dengan antibodi primer terhadap cGAS (1:1000, Teknologi Pensinyalan Sel), STING (1:1000, Teknologi Pensinyalan Sel), TGF-β (1:100, Servicebio), IL-6 (1:500, Servicebio) dan TNF-α (1:500, Servicebio), dilanjutkan dengan inkubasi pada suhu 37°C selama 60 menit dengan antibodi sekunder tikus (1:200; Servicebio). Metode penilaian Szapiel digunakan untuk menilai tingkat keparahan luka fibrosis paru dan alveolitis. Kepadatan optik dinilai menggunakan Image Pro Plus (Media Cybernetics). Image Pro Plus digunakan untuk analisis semi-kuantitatif cGAS, STING, TNF-α, TGF-β, dan IL-6 dan fraksi volume kolagen (CVF) untuk setiap bidang dihitung sebagai berikut: CVF = area kolagen di lapangan/total area lapangan ×100.
2.8 Western blot
Jaringan paru-paru atau sel ditambahkan ke inhibitor protease dan lisat RIPA, dan jaringan tersebut kemudian digiling. Sampel dilisiskan sepenuhnya pada suhu 4 ◦ C selama 30 menit dan disentrifugasi pada 12.000 g selama 15 menit. Setelah SDS-PAGE, 20 mikrogram alikuot protein lisat dipindahkan ke Membran Polivinilidena Difluorida 0,22 μm dan diobati dengan antibodi primer; Antibodi primer yang berasal dari kelinci berikut digunakan: β-aktin (1:1000, Teknologi Pensinyalan Sel), cGAS (1:1000, Teknologi Pensinyalan Sel), STING (1:1000, Teknologi Pensinyalan Sel), p65 (1:1000, Teknologi Pensinyalan Sel), p-p65 (ser 536, 1:1000, Teknologi Pensinyalan Sel). Membran tersebut kemudian diinkubasi dengan antibodi sekunder fluoresen IgG antikelinci (1:30.000, Cell Signaling Technology) pada suhu ruangan selama 1 jam. Dan pencitraan dilakukan menggunakan pencitra fluoresen. Pita diperiksa dan dievaluasi menggunakan perangkat lunak Image J (National Institutes of Health, Bethesda, Maryland, AS).
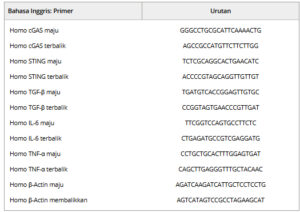
Tabel 1. Daftar primer yang digunakan dalam penelitian ini.
2.9 Reaksi Rantai Polimerase Kuantitatif Real-Time (qPCR)
Reagen TRIzol (Takara) digunakan untuk mengekstraksi total RNA dari sel sesuai dengan petunjuk pabrik. cDNA disintesis menggunakan Kit reagen PrimeScriptTM FAST RT dengan gDNA Eraser (Takara Bio, Jepang) dan analisis qPCR dilakukan menggunakan TB green Premix Ex Taq Ⅱ (Tli RNaseH Plus) (Takara Bio, Jepang) dalam sistem deteksi waktu nyata (qTOWER3G, Jerman).
Teknik ini digunakan untuk menstandardisasi tingkat ekspresi relatif mRNA terhadap kontrol endogen β-aktin. Urutan primer yang ditunjukkan di bawah ini ditemukan pada Tabel 1 dan Tabel S3 .
2.10 Uji Viabilitas Sel
Sel BEAS-2B dikulturkan dalam pelat 96-sumur, masing-masing sebanyak lima kali pengulangan. Setiap sumur menerima 100 µL larutan Cell Counting Kit-8 (CCK-8) (Meilunbio, Tiongkok), yang kemudian diinkubasi selama 2 jam pada suhu 37°C. Pembaca multi-pelat (infinite-M200, Austria) digunakan untuk mengukur nilai kerapatan optik pada 450 nm. Eksperimen diulang tiga kali.
2.11 Uji Imunosorben Terkait Enzim (ELISA)
Kadar TGF-β1, IL-6, dan TNF-α dalam supernatan sel, serum, atau homogenat jaringan paru-paru diukur menggunakan kit Elisa tergantung pada instruksi pabrik (Elabscience, Wuhan, Cina).
2.12 Docking Molekuler
Simulasi Autodock menggunakan perangkat lunak Autodock 4.2. Pertama, protein cGAS (ID Uniprot: Q8C6L5) diunduh dari basis data Uniprot. Struktur tiga dimensi molekul kecil DHA diperoleh dari basis data PubChem (ID PubChem: 3000518). Kemudian protein ditetapkan sebagai reseptor, dan molekul kecil DHA ditetapkan sebagai ligan. Perangkat lunak AutodockTools 1.5.6 digunakan untuk hidrogenasi, pengecekan dan penghitungan muatan, serta pembuatan kotak grid docking dari struktur protein. Selain itu, ligan molekul kecil memilih ikatan reversibel ligan di AutodockTools. Terakhir, baik struktur protein maupun format ligan molekul kecil harus dikonversi ke format PDBQT menggunakan perangkat lunak AutoDockTools untuk docking lebih lanjut. Setelah melakukan docking dengan Vina, skor protein dan kombinasi docking molekul kecil dihitung, dan analisis gaya serta visualisasi sudut tiga dimensi dan dua dimensi dilakukan menggunakan PyMOL 2.5 dan perangkat lunak Discovery Studio.
2.13 Analisis Statistik
Rata-rata ± simpangan baku digunakan untuk menampilkan semua data. GraphPad Prism 9 (AS) digunakan untuk melakukan analisis statistik. Uji t tak berpasangan digunakan untuk perbandingan dua kelompok. Analisis varians satu arah digunakan untuk membandingkan beberapa kelompok. Analisis statistik nonparametrik digunakan untuk memeriksa data yang terdistribusi tidak normal ini. Setiap percobaan dilakukan tiga kali sendiri-sendiri. p < 0,05 diterima sebagai signifikan secara statistik.
3 Hasil
3.1 DHA Mengurangi RILI di C57BL/6
Kami menggunakan iradiasi paru-paru tunggal 15 Gy untuk membuat model RILI tikus. Kami kemudian menilai cedera paru berdasarkan skor patologis yang dilaporkan pada Simposium American Thoracic Society (Matute-Bello et al. 2011 ). Dalam percobaan awal penelitian ini, kami membuat model tikus RILI dan memberikan dosis DHA yang berbeda setiap hari melalui gavage oral selama 30 hari. Kurva dosis-efek kemudian diplot menurut dosis obat dan skor patologi HE dan ID50 . Hasil penelitian menunjukkan bahwa skor HE menurun seiring dengan peningkatan dosis, yang menunjukkan bahwa DHA memiliki efek mitigasi pada cedera paru radiologis dengan ID50 sekitar 10,72 mg/kg (Gambar 1B ). Selain itu, kami selanjutnya membagi tikus ke dalam kelompok dosis konsentrasi obat yang berbeda tanpa pengobatan iradiasi. Pewarnaan H&E tidak menunjukkan kerusakan patologis, seperti infiltrasi sel inflamasi di semua kelompok (Gambar S2 ). Dalam percobaan ini, hasil HE menunjukkan bahwa tikus dalam kelompok kontrol memiliki struktur alveolus normal, tekstur paru-paru yang jelas, dan tidak ada tanda-tanda yang terlihat dari ruptur atau pendarahan dinding alveolus. Dibandingkan dengan kelompok kontrol, tikus dalam kelompok iradiasi menunjukkan septa alveolus yang lebih tebal, arsitektur alveolus yang tidak teratur, dan eksudat dalam alveolinya. Banyak sel inflamasi terbukti hadir dalam rongga alveolus dan ruang interstisial. Kerusakan jaringan paru-paru dan infiltrasi sel inflamasi berkurang pada kelompok iradiasi + DHA dibandingkan dengan kelompok iradiasi (Gambar 1C ). Skor patologis kelompok iradiasi + DHA lebih rendah daripada kelompok iradiasi, sedangkan skor patologis kelompok iradiasi secara signifikan lebih tinggi daripada kelompok kontrol (Gambar 1C ). Pewarnaan trikrom Masson digunakan untuk mengamati deposisi kolagen paru-paru tikus. Hasil pewarnaan trikrom Masson menunjukkan bahwa tidak ada endapan serat kolagen yang jelas pada kelompok kontrol, tetapi endapan kolagen yang jelas terlihat pada kelompok penyinaran, dan berkurang secara signifikan pada kelompok perlakuan DHA (Gambar 1D ). Dapat diungkapkan bahwa DHA dapat meringankan sebagian peradangan paru-paru dan fibrosis paru-paru yang disebabkan oleh penyinaran.
Selain itu, kami mendeteksi tingkat ekspresi TGF-β, IL-6, dan TNF-α melalui uji IHC dan uji ELISA. Hasil uji IHC menunjukkan bahwa TGF-β, IL-6, dan TNF-α sebagian besar diekspresikan dalam sel epitel bronkial, dengan ekspresi yang lebih rendah diamati dalam parenkim paru. Tingkat TGF-β, IL-6, dan TNF-α meningkat pada kelompok iradiasi dibandingkan dengan kelompok kontrol, tetapi menurun pada kelompok iradiasi + DHA dibandingkan dengan kelompok iradiasi (Gambar 2A,B ). Menurut hasil uji ELISA, kelompok iradiasi memiliki tingkat TGF-β, IL-6, dan TNF-α yang secara signifikan lebih tinggi daripada kelompok kontrol. Sebaliknya, kelompok iradiasi + DHA memiliki tingkat zat-zat ini yang lebih rendah (Gambar 2C ), yang konsisten dengan hasil uji IHC. Hal ini menunjukkan bahwa DHA melemahkan kadar TGF-β, IL-6, dan TNF-α, sehingga mengurangi kerusakan paru-paru.
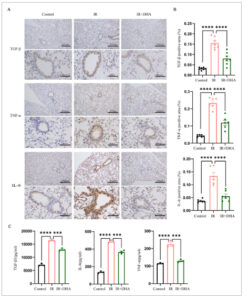
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
DHA menghambat ekspresi faktor inflamasi pada jaringan paru tikus. (A) Pewarnaan IHC TGF-β, IL-6, dan TNF-α representatif dan analisis semi-kuantitatif dilakukan pada jaringan paru tikus. skala: 200 μm (×100) dan 20 μm (×400). (B) Rasio area positif TGF-β, rasio area positif TNF-α, dan rasio area positif IL-6. (C) Kadar TGF-β, IL-6, dan TNF-α dalam serum dan homogenat paru tikus dideteksi dengan ELISA. DHA, dihidroartemisinin; IHC, imunohistokimia; IL-6, interleukin-6; IR, iradiasi; TGF-β, transforming growth factor-β; TNF-α, tumor necrosis factorα. * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001.
3.2 DHA Melemahkan RILI dengan Menghambat Sinyal cGAS/STING/NF-κB
Untuk lebih jauh mengeksplorasi mekanisme spesifik DHA yang melemahkan RILI, kami melakukan pengurutan transkriptom pada jaringan kelompok kontrol dan kelompok iradiasi, dan menemukan bahwa STING secara signifikan berbeda dan diperkaya dengan jalur NF-κB oleh KEGG (Gambar 3A,B ). Selain itu, yang menarik, analisis docking molekuler menunjukkan bahwa DHA memiliki afinitas yang kuat dengan protein cGAS melalui ikatan hidrogen (TYR, HIS), yang menunjukkan bahwa cGAS mungkin merupakan target utama untuk DHA sebagai pengobatan selektif untuk RILI (Gambar 3C ). Menurut data IHC, kelompok iradiasi memiliki tingkat ekspresi cGAS dan STING yang secara signifikan lebih tinggi, sedangkan kelompok perlakuan DHA memiliki tingkat yang secara signifikan lebih rendah daripada kelompok iradiasi (Gambar 3D ). Hasil WB menunjukkan bahwa, dibandingkan dengan kelompok kontrol, tingkat ekspresi cGAS, STING, dan p-NF-κB meningkat secara signifikan pada kelompok iradiasi, sedangkan tingkat NF-κB tidak menunjukkan perubahan yang signifikan; Sebaliknya, tingkat ekspresi cGAS, STING, dan p-NF-κB berkurang secara signifikan pada kelompok perlakuan DHA dibandingkan dengan kelompok iradiasi (Gambar 3E ). Sebagai kesimpulan, hasil kami menunjukkan bahwa DHA dapat menghambat jalur pensinyalan cGAS/STING/NF-κB, yang pada akhirnya melindungi tikus dari RILI.
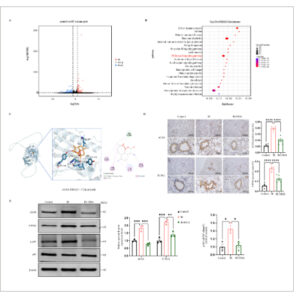
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
DHA menghambat ekspresi jalur pensinyalan cGAS/STING/NF-κB pada jaringan paru-paru. (A) Analisis transkriptom menunjukkan bahwa terdapat perubahan signifikan dalam ekspresi gen antara kelompok kontrol dan kelompok IR. (B) Dotplot menunjukkan entri jalur top20 representatif KEGG yang diperkaya pada jaringan paru-paru tikus. (C) Afinitas antara DHA dan cGAS diuji melalui docking molekuler; Afinitas ikatan-H (TYR-346, HIS-369) adalah -7,2 kkal/mol. (D) Pewarnaan IHC cGAS dan STING representatif serta analisis semi-kuantitatif dilakukan pada jaringan paru-paru tikus. Rasio area positif cGAS dan rasio area positif STING. skala: 200 μm (×100) dan 20 μm (×400). (E) Western blot protein cGAS, STING, NF-κB dan p-NF-κB. Kuantifikasi berbagai protein yang sesuai, dan β-aktin sebagai kontrol pemuatan. DHA, dihidroartemisinin; IR, iradiasi; RT, radioterapi. * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001.
3.3 DHA dapat Mengurangi Kerusakan Sel BEAS-2B
Pertama, analisis CCK8 dilakukan untuk menilai efek toksik dari berbagai konsentrasi (0, 5, 15, 25, dan 45 μM) DHA pada sel BEASB-2B. Nilai IC50 DHA pada sel BEASB-2B adalah 18,33, 12,06, dan 11,91 μM setelah 24, 48, dan 72 jam, berturut-turut (Gambar 4A ). Kami memilih dosis radiasi (0, 2, 4, 6, 8, dan 10 Gy) pada berbagai titik waktu (24, 48, dan 72 jam) dalam sel BEAS-2B untuk memperjelas sensitivitasnya terhadap radiasi. Hasil CCK8 menunjukkan bahwa ketika dosis radiasi meningkat menjadi 8 Gy, viabilitas sel menurun hingga 50% setelah 72 jam, yang menunjukkan kerusakan sel (Gambar 4B ). Oleh karena itu, 8 Gy kemudian dipilih sebagai dosis iradiasi. Selain itu, untuk lebih lanjut menyaring konsentrasi optimal yang dapat melindungi sel BEASB-2B dari kerusakan akibat radiasi, kami memberikan berbagai konsentrasi DHA (0, 3, 6, dan 9 μM) ke sel sebelum penyinaran. Hasil CCK8 menunjukkan bahwa viabilitas sel paling tinggi pada konsentrasi obat 6 μM setelah 48 jam penyinaran dibandingkan dengan kelompok kontrol dan IR (Gambar 4C ). Oleh karena itu, kami memilih 6 μM sebagai konsentrasi obat untuk percobaan berikutnya.
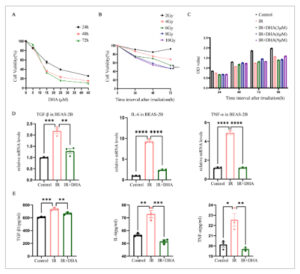
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
DHA dapat mengurangi kerusakan sel BEAS-2B. (A) Viabilitas sel BEAS-2B pada titik waktu yang berbeda (24,48,72 jam) pada konsentrasi obat 0, 5, 15, 25, dan 45 μM dideteksi oleh uji CCK-8. (B) Viabilitas sel BEAS-2B pada titik waktu yang berbeda setelah penyinaran dengan 0, 2, 4, 6, 8, dan 10 Gy dideteksi oleh CCK-8. (C) Nilai OD sel BEAS-2B pada konsentrasi obat yang berbeda dan titik waktu yang berbeda setelah penyinaran 8 Gy diukur oleh CCK-8. (D) Ekspresi mRNA relatif TGF-β, IL-6 dan TNF-α dalam sel BEAS-2B setelah penyinaran. (E) Kadar TGF-β, IL-6, dan TNF-α dalam media kultur sel BEAS-2B dideteksi dengan ELISA. CCK-8, Kit Penghitungan Sel-8; DHA, dihidroartemisinin; IL-6, interleukin-6; TGF-β, faktor pertumbuhan transformasi-β; TNF-α, faktor nekrosis tumorα; IR, iradiasi. * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001.
Untuk memverifikasi lebih lanjut efek DHA pada RILI, kami menggunakan uji qPCR untuk mendeteksi tingkat ekspresi gen TGF-β, IL-6, dan TNF-α dalam sel BEAS-2B. Hasil penelitian menunjukkan bahwa tingkat ekspresi gen TGF-β, IL-6, dan TNF-α meningkat secara signifikan pada kelompok iradiasi dibandingkan dengan kelompok kontrol, sementara tingkat ini menurun pada sel yang diobati dengan DHA dibandingkan dengan kelompok iradiasi (Gambar 4D ). Selain itu, kami menggunakan uji ELISA untuk mendeteksi tingkat TGF-β, IL-6, dan TNF-α dalam media kultur sel BEAS-2B. Uji ELISA lebih lanjut juga menunjukkan bahwa DHA mengurangi tingkat TGF-β, TNF-α, dan IL-6 (Gambar 4E ). Singkatnya, hasil kami menunjukkan bahwa DHA dapat mengurangi kerusakan radiasi pada sel.
3.4 DHA Mengurangi Kerusakan Sel Akibat Radiasi dengan Menghambat Jalur Sinyal cGAS/STING/NF-κB
Untuk menunjukkan efek DHA pada aktivasi jalur cGAS/STING/NF-κB yang diinduksi IR, sel BEAS-2B yang diobati terlebih dahulu dengan 6 μM DHA selama 2 jam kemudian diekspos pada iradiasi 8 Gy selama 48 jam, dan dideteksi ekspresi protein cGAS, STING, NF-κB, p-NF-κB. Hasil penelitian menunjukkan bahwa tingkat ekspresi protein cGAS, STING, dan p-NF-κB meningkat secara signifikan pada kelompok iradiasi dibandingkan dengan kelompok kontrol (Gambar 5A ). Pretreatment DHA dapat membalikkan peningkatan protein seperti cGAS, STING, dan p-NF-κB yang disebabkan oleh iradiasi (Gambar 5A ). Demikian pula, qPCR juga mengonfirmasi hasil ini (Gambar 5B ). Hal ini menunjukkan bahwa DHA dapat membalikkan inflamasi yang diinduksi IR dengan menghambat jalur cGAS/STING/NF-κB pada sel BEAS-2B.
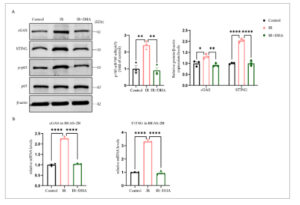
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
DHA menghambat ekspresi jalur pensinyalan cGAS/STING/NF-κB pada sel BEAS-2B. (A) Western blot protein cGAS, STING, NF-κB dan p-NF-κB. Kuantifikasi berbagai protein yang sesuai, dan β-aktin sebagai kontrol pemuatan. (B) Ekspresi mRNA relatif cGAS dan STING pada sel BEAS-2B setelah penyinaran. DHA, dihidroartemisinin; IR, penyinaran. * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001.
3.5 Menurunkan regulasi cGAS lebih lanjut meningkatkan efek pengurangan DHA pada RILI
Untuk menyelidiki mekanisme pengaturan jalur cGAS/STING/NF-κB pada peradangan yang diinduksi iradiasi, kami mentransfeksi sel BEAS-2B dengan siRNA. Hasil qPCR dan WB menunjukkan bahwa cGAS secara signifikan diturunkan setelah transfeksi siRNA, dengan penurunan pada situs 1266 menjadi yang paling menonjol (Gambar 6A,B ). Selanjutnya, percobaan dibagi menjadi kelompok iradiasi, kelompok iradiasi-si-cGAS, kelompok iradiasi+DHA dan kelompok iradiasi +DHA-si-cGAS. Hasil uji CCK8 menunjukkan bahwa viabilitas sel dari tiga kelompok lainnya meningkat secara signifikan dibandingkan dengan kelompok iradiasi (Gambar 6C ), yang menunjukkan bahwa penurunan cGAS dapat memainkan peran protektif dalam sel. Selain itu, dibandingkan dengan paparan iradiasi 8 Gy saja, ekspresi protein cGAS, STING, dan p-NF-κB pada kelompok lain menurun secara signifikan. Dibandingkan dengan kelompok iradiasi-si-cGAS, ekspresi protein cGAS, STING dan p-NF-κB dalam kelompok iradiasi +DHA-si-cGAS menurun secara signifikan (Gambar 6D ). Percobaan qPCR lebih lanjut juga sampai pada kesimpulan yang sama (Gambar 6E ). Pada saat yang sama, kami menggunakan kit ELISA untuk mendeteksi kadar TGF-β, IL-6, dan TNF-α dalam supernatan sel BEAS-2B, dan hasilnya menunjukkan bahwa kadar TGF-β, IL-6, dan TNF-α dalam kelompok iradiasi-si-cGAS berkurang secara signifikan dibandingkan dengan kelompok iradiasi (Gambar 6F ). Dan kadar TGF-β, IL-6 dalam kelompok iradiasi + DHA-si-cGAS berkurang secara signifikan dibandingkan dengan kelompok iradiasi + DHA (Gambar 6F ). Hasil-hasil ini menunjukkan bahwa si-cGAS menurunkan efek DHA dalam meringankan cedera paru-paru akibat radiasi.
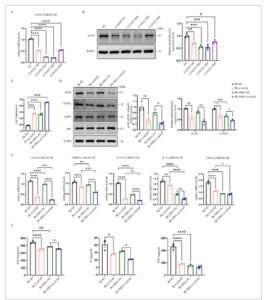
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
Menurunkan regulasi cGAS lebih jauh meningkatkan efek pengurangan DHA pada cedera paru-paru yang disebabkan oleh radiasi. (A) Ekspresi mRNA relatif dan (B) Western blot cGAS dalam sel BEAS-2B setelah transfeksi siRNA. (C) Viabilitas sel BEAS-2B yang ditransfeksi dengan siRNA setelah penyinaran 8 Gy dideteksi oleh CCK-8. (D) Western blot protein cGAS, STING, NF-κB dan p-NF-κB setelah transfeksi siRNA. Kuantifikasi berbagai protein yang sesuai, dan β-aktin sebagai kontrol pemuatan. (E) Ekspresi mRNA relatif cGAS, STING, TGF-β, IL-6 dan TNF-α dalam sel BEAS-2B setelah transfeksi siRNA. (F) Kadar TGF-β, IL-6 dan TNF-α dalam media kultur sel BEAS-2B setelah transfeksi siRNA dideteksi oleh ELISA. CCK-8, Kit Penghitungan Sel-8; DHA, dihidroartemisinin; IR, iradiasi; siRNA, RNA pengganggu kecil. * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001.
4 Diskusi
Gagal napas atau bahkan kematian dapat terjadi akibat cedera paru Grade IV yang tidak diobati atau ditunda setelah RILI (Käsmann et al. 2020 ). Perubahan degeneratif pada epitel alveolar dapat diblokir sebagian atau dibalik jika perawatan farmakologis diberikan segera setelah penyinaran (OASULLIVAN dan Levin 2003 ). Saat ini tidak ada pengobatan yang layak untuk RILI. Selain itu, RILI sekarang menjadi kendala yang menantang bagi kemanjuran RT toraks, dan mekanisme molekulernya yang unik sebagian besar tidak jelas. Dalam penelitian ini, kami membuat model tikus RILI dan model sel In Vitro untuk menemukan mekanisme yang digunakan DHA untuk mengurangi RILI melalui jalur cGAS/STING/NF-κB.
DHA adalah obat terkenal yang efektif melawan malaria. Menariknya, menurut penelitian terkini, DHA dapat mengurangi kerusakan paru-paru dengan mengurangi fibrosis dan peradangan di paru-paru (Yang et al. 2018 ; You et al. 2022 ). Namun, cara kerja DHA yang tepat dalam RILI tidak diketahui. Dalam model tikus RILI, kami menggunakan pewarnaan H&E dan Masson untuk mengamati kerusakan struktural dan deposisi fibrilar kolagen di dalam paru-paru. Selain itu, kami juga menggunakan uji IHC dan ELISA untuk mendeteksi ekspresi TGF-β, TNF-α, dan IL-6. Pengobatan dengan DHA dapat memperbaiki patologi ini. Konsisten dengan temuan eksperimen kami sebelumnya, hasil menunjukkan bahwa pemberian DHA efektif dalam memperbaiki perubahan patologis dan mengurangi ekspresi TGF-β, TNF-α, dan IL-6 di jaringan paru-paru (Ning et al. 2024 ).
Awalnya muncul bahwa jalur pensinyalan cGAS-STING mengaktifkan pertahanan bawaan terhadap infeksi mikroba dengan memantau DNA yang berbahaya. Bukti kuat mendukung gagasan bahwa aktivasi STING merupakan variabel penting dalam sejumlah kondisi inflamasi, termasuk steatohepatitis non-alkohol (Luo et al. 2018 ; Yu et al. 2019 ), cedera hati akut (Liu et al. 2022 ), disfungsi jantung terkait sepsis (Li, Sun, et al. 2019 ; Li, Zhou, et al. 2019 ), dan lainnya. dsDNA dikenali oleh cGAS dengan cara yang tidak bergantung pada urutan (Sun et al. 2013 ). Setelah mengikat DNA, fungsi enzimatiknya diaktifkan, mengkatalisis produksi cGAMP, molekul pembawa pesan kedua terkait hibrida unik yang mengikat dan mengaktifkan STING (Ablasser et al. 2013 ). Aktivasi STING selanjutnya memulai program transkripsi hilir yang sebagian besar melibatkan IFN, IRF3, dan NF-κB untuk meningkatkan IFN tipe I, sitokin pro-inflamasi, dan kemokin (Decout et al. 2021 ). Menurut laporan, kerusakan mitokondria dan aktivasi jalur cGAS-STING terkait erat dengan fibrosis ginjal, yang disebabkan oleh peradangan (Chung et al. 2019 ). Misalnya, pada penyakit hati akibat radiasi, dsDNA yang dilepaskan dari hepatosit dengan cepat memicu jalur cGAS-STING pada sel non-parenkim, yang menyebabkan sintesis dan sekresi interferon-I dan kematian hepatosit secara bersamaan (Du et al. 2022 ). Kami melakukan pengurutan transkriptom pada jaringan kelompok kontrol dan kelompok radiasi, dan menemukan bahwa STING secara signifikan berbeda dan diperkaya dengan jalur NF-KB. Percobaan kami menunjukkan bahwa kadar cGAS/STING/NF-κB meningkat secara signifikan setelah radiasi, dan penurunan regulasi cGAS dapat meringankan RILI, yang konsisten dengan hasil yang dilaporkan dalam literatur yang disebutkan di atas.
DHA memiliki banyak efek farmakologis pada infeksi virus (Fröhlich et al. 2018 ), inflamasi (Gao et al. 2020 ), dan proliferasi tumor (Malami et al. 2022 ). You et al. menemukan bahwa DHA dapat mengurangi inflamasi paru dan fibrosis pada tikus dengan menghambat pensinyalan JAK2/STAT3 (You et al. 2022 ). Selain itu, Gao et al. menemukan bahwa DHA dapat meningkatkan neuroinflamasi yang diinduksi LPS dengan menghambat jalur PI3K/AKT (Gao et al. 2020 ). Dan Huang et al. menemukan bahwa DHA mengurangi cedera paru akut yang diinduksi lipopolisakarida pada tikus dengan menghambat pensinyalan NF-κB dengan cara yang bergantung pada Nrf2 (Huang et al. 2019 ). Selain itu, Zhang et al. menunjukkan bahwa peningkatan penuaan neuronal setelah stroke iskemik melibatkan pemblokiran aktivasi cGAS-STING dengan menargetkan jalur JAK2-STAT3 (Zhang et al. 2023 ). Weng et al. menemukan bahwa pada pasien artritis reumatoid, perangkap ekstraseluler makrofag meningkatkan karakteristik biologis seperti tumor dari sinoviosit seperti fibroblas melalui jalur pensinyalan PI3K/Akt yang dimediasi cGAS (Weng et al. 2024 ). Oleh karena itu, dapat dilihat bahwa jalur yang terkait dengan aksi DHA saling terkait, yang meletakkan dasar teoritis untuk percobaan kami. Hasil percobaan kami menunjukkan bahwa penurunan regulasi cGAS dapat mengurangi ekspresi protein hilir STING dan p-NF-κB, menggemakan laporan di atas.
Terdapat beberapa keterbatasan pada penelitian saat ini. Pertama, dalam penelitian ini, verifikasi penyelamatan dilakukan pada hewan tanpa obat dan kami hanya menggunakan satu lini sel untuk verifikasi dalam percobaan. Selain itu, kami tidak mengeksplorasi lebih lanjut deteksi kerusakan DNA dengan uji komet. Selain itu, cGAS juga terkait dengan berbagai jenis kematian, dan kami tidak mengeksplorasi mekanisme kematian sel yang lebih dalam. Kami akan menyelidiki lebih lanjut mekanisme regulasi spesifik regulasi DHA terhadap cGAS/STING/NF-κB dan dengan demikian meringankan RILI.
Sebagai kesimpulan, penelitian ini menunjukkan bahwa DHA meringankan RILI dengan menghambat jalur pensinyalan cGAS/STING/NF-κB. Menargetkan cGAS-STING atau menghambat NF-κB hilir dapat menjadi strategi terapi yang menjanjikan untuk mencegah RILI. DHA dapat menjadi agen yang cocok untuk pencegahan dan pengobatan RILI, dan efek perlindungannya memerlukan uji klinis lebih lanjut.