Abstrak
Kanker prostat metastatik tidak dapat disembuhkan, dan target terapi dan obat baru sangat dibutuhkan. Infeksi virus dikaitkan dengan beberapa jenis kanker, tetapi hubungan antara virus dan onkogenesis prostat belum ditetapkan. Baru-baru ini, hubungan antara seropositifitas human cytomegalovirus (CMV) dan peningkatan risiko kematian akibat kanker prostat ditunjukkan. Di sini, kami menunjukkan bahwa infeksi CMV umum terjadi pada epitel prostat normal dan pada jaringan tumor prostat, dengan 70–92% tumor terinfeksi. Selain itu, kami melaporkan bahwa lini sel kanker prostat yang umum dipelajari terinfeksi CMV. Eksperimen kehilangan fungsi menunjukkan bahwa CMV meningkatkan kelangsungan hidup sel, proliferasi, dan pensinyalan reseptor androgen, mengidentifikasinya sebagai target terapi pada kanker prostat yang sensitif terhadap pengebirian dan yang resistan terhadap pengebirian. Beberapa senyawa farmasi anti-CMV dalam penggunaan klinis menghambat ekspansi sel dalam model kanker prostat baik secara in vitro maupun in vivo . Kami menyimpulkan bahwa CMV umum terjadi pada kanker prostat, meningkatkan program inti sel kanker prostat, dan dapat dihambat oleh obat-obatan yang ditoleransi dengan baik. Temuan ini memotivasi penyelidikan terhadap potensi manfaat klinis penghambatan CMV dalam pengobatan kanker prostat.
Singkatan
5α-DHT
5α-dihidrotestosteron
AR
Reseptor androgen
Bahasa Inggris AR-FL
Reseptor Androgen panjang penuh
Bahasa Indonesia: CMV
Virus sitomegalo manusia
CRPC
Kanker prostat yang resistan terhadap pengebirian
CSPC
Kanker prostat yang sensitif terhadap pengebirian
Bahasa Inggris: FAC
Penyortiran sel yang diaktifkan oleh fluoresensi
IKAN
Hibridisasi fluoresensi in situ
IC50
Konsentrasi penghambatan setengah maksimal
Bahasa Indonesia: IE1/2
Segera awal 1 dan 2
Posyandu
Imunohistokimia
Bahasa Inggris MBV
Maribavir
Bahasa Inggris
Metastasis dengan aktivitas AR tinggi
MetB
Metastasis dengan fenotipe yang terdiferensiasi
Mita
Mitramisin A
RNAi
Gangguan RNA
1 Pendahuluan
Kanker prostat adalah salah satu jenis tumor yang paling umum dengan lebih dari 350.000 kematian di seluruh dunia setiap tahunnya, menjadikan kanker prostat salah satu penyebab utama kematian akibat kanker. Hanya beberapa pendorong molekuler dari kanker prostat yang mematikan yang mungkin untuk ditargetkan secara terapeutik yang diketahui. Yang paling mapan dari ini adalah pensinyalan reseptor androgen (AR), yang mendorong proliferasi sel dan kelangsungan hidup pada kanker prostat yang belum pernah diobati. Terapi deprivasi androgen, yang telah menjadi standar perawatan untuk kanker prostat stadium lanjut selama beberapa dekade, menekan pensinyalan androgen dan pertumbuhan tumor, tetapi penyakit ini akhirnya berkembang menjadi kanker prostat yang resistan terhadap pengebirian (CRPC). Yang paling umum, pensinyalan AR yang dipulihkan mendorong pertumbuhan CRPC, dan penghambat pensinyalan AR generasi berikutnya seperti enzalutamide awalnya efektif. Resistensi pengobatan juga dapat muncul melalui mekanisme yang tidak bergantung pada AR, di mana pensinyalan AR rendah atau tidak ada, dan ini dikaitkan dengan hasil yang lebih buruk dan sedikit pilihan pengobatan [ [ 1 , 2 ] ]. Meskipun terapi baru yang memperpanjang hidup telah muncul dalam beberapa tahun terakhir, termasuk terapi target poli (ADP-ribosa) polimerase dan antigen membran spesifik prostat, kanker prostat metastatik masih belum dapat disembuhkan [ [ 3 ] ] dan penting untuk mengidentifikasi target terapi baru yang dapat ditindaklanjuti.
Infeksi virus kronis dapat menyebabkan kanker, mengubah perkembangan penyakit, dan merupakan target terapi yang potensial. Misalnya, human papillomavirus menyebabkan kanker serviks dan dapat ditargetkan dengan vaksinasi untuk menurunkan kejadian kanker [ [ 4 , 5 ] ], tetapi pada sebagian besar jenis kanker lain yang berasal dari epitel, termasuk kanker prostat, infeksi virus bukan merupakan pemicu penyakit yang mapan. Lebih jauh lagi, seropositif terhadap virus terkait kanker yang diketahui belum dikaitkan dengan kejadian kanker prostat. Laporan sporadis selama beberapa dekade menggambarkan potensi keberadaan virus DNA pada kanker prostat tetapi tidak ada hubungan yang jelas yang mengidentifikasi mereka sebagai agen penyebab tumor telah dibuat. Seropositif terhadap virus herpes human cytomegalovirus (CMV), yang tidak diklasifikasikan sebagai virus onkogenik, tidak dikaitkan dengan peningkatan risiko kejadian kanker prostat [ [ 6 , 7 ] ].
Di sisi lain, kami baru-baru ini melaporkan bahwa imunitas sel T lokal terhadap CMV pada pasien kanker prostat HLA-A*02:01 dikaitkan dengan peningkatan kekambuhan penyakit setelah prostatektomi [ [ 8 ] ] dan menemukan bahwa seropositifitas CMV dikaitkan dengan peningkatan mortalitas kanker prostat [ [ 6 ] ]. Hal ini menunjukkan bahwa CMV atau respons imun terhadap CMV dapat mendorong perkembangan kanker prostat, daripada perkembangan awalnya. CMV aktif dapat bereplikasi dalam sel epitel prostat dan menyebabkan prostatitis pada pasien dengan imunosupresi [ [ 9 ] ], yang menunjukkan tropisme prostat.
CMV adalah virus berukuran ~235 kbp dengan lebih dari 150 kerangka baca terbuka dengan produk gen yang mampu mengatur banyak proses seluler untuk meningkatkan penyebaran dan persistensi virus [ [ 10 ] ]. Meskipun CMV memiliki sifat pro-kanker dalam model kanker, mayoritas penelitian bergantung pada ekspresi ektopik gen CMV atau menganalisis hasil infeksi litik aktif [ [ 11 – 13 ] ], mungkin tidak mencerminkan biologi CMV in vivo dalam jaringan yang terinfeksi. Mayoritas manusia terinfeksi CMV secara persisten, ditunjukkan dengan 83% memiliki antibodi terhadap virus [ [ 14 ] ]. Ini mungkin merupakan perkiraan yang jauh lebih rendah dari proporsi populasi yang terinfeksi, karena DNA CMV umum dideteksi pada individu seronegatif [ [ 15 – 22 ] ], yang menunjukkan bahwa mereka terinfeksi tetapi tidak memiliki respons antibodi yang terdeteksi. Karakteristik infeksi laten terutama telah dipelajari dalam darah dan sumsum tulang, karena sudah diketahui dengan baik bahwa CMV bertahan dalam sel-sel garis keturunan hematopoietik [ [ 21 , 23 , 24 ] ]. Mirip dengan virus herpes lainnya, CMV dapat mempertahankan DNA-nya sebagai episom yang dapat direplikasi dan dipertahankan oleh protein sel dan virus [ [ 23 , 25 ] ]. Secara historis, latensi telah dipandang sebagai keadaan tidak aktif di mana hanya sekumpulan gen virus terbatas yang diekspresikan. Paradigma modern mendefinisikan latensi CMV sebagai keadaan persistensi virus di mana partikel virus tidak diproduksi tetapi CMV masih secara aktif mengganggu fungsi sel dan sekumpulan besar gen virus diekspresikan pada tingkat yang sangat rendah [ [ 26 – 30 ] ].
Namun, secara teknis sangat sulit untuk mendeteksi infeksi laten endogen, yang telah menghambat penelitian CMV pada jaringan sehat dan sakit serta menyebabkan data yang saling bertentangan [ [ 31 ] ]. Lebih dari 20 tahun yang lalu, kelenjar prostat jinak dan kanker, di antara organ dan penyakit lainnya, merupakan lokasi infeksi CMV yang disarankan [ [ 32 – 34 ] ], tetapi validitas temuan ini telah dipertanyakan karena penelitian lain tidak dapat mengidentifikasi CMV pada jaringan prostat [ [ 35 ] ].
Kami melaporkan bahwa infeksi CMV umum terjadi pada sel epitel prostat yang sehat serta pada kanker prostat. Kami menemukan bahwa lini sel kanker prostat yang umum dipelajari terinfeksi CMV, dan bahwa CMV meningkatkan kelangsungan hidup dan proliferasi sel, yang mengidentifikasi CMV sebagai target terapeutik pada kanker prostat yang sensitif terhadap pengebirian dan yang resistan terhadap pengebirian. Kami menunjukkan bahwa beberapa senyawa farmasi yang digunakan dalam praktik klinis yang menargetkan CMV menghambat perkembangan penyakit pada model kanker prostat.
2 Bahan dan Metode
2.1 Desain penelitian dan persetujuan etis terhadap penelitian pada manusia
Penelitian ini dilakukan sesuai dengan prinsip-prinsip Deklarasi Helsinki. Keberadaan dan karakteristik infeksi CMV dievaluasi dalam spesimen manusia dari beberapa kohort independen. Untuk analisis bahan dari pasien kanker prostat, eksperimen dilakukan dengan pemahaman dan persetujuan tertulis dari setiap subjek. Izin etis untuk studi sampel manusia dari donor postmortem diberikan oleh komite etik regional Swedia di Stockholm (2010/313–31/3). Sampel jaringan prostat dan darah dikumpulkan dari donor postmortem antara tahun 2015 dan 2020 melalui KI Donatum, Karolinska Institutet, Stockholm, Swedia, seperti yang dijelaskan dalam [ [ 6 , 8 ] ]. Riwayat medis diperoleh dari jurnal medis, keluarga terdekat, laporan polisi, dan registri pasien. Sesuai hukum Swedia, persetujuan lisan untuk donasi diberikan oleh kerabat sebelum dimasukkan dalam penelitian. Persetujuan yang diinformasikan didokumentasikan secara tertulis.
Kehadiran RNA CMV dievaluasi dalam kohort kanker prostat CPC-GENE, di mana jaringan tumor dari pasien yang menjalani prostatektomi radikal dikumpulkan dan diurutkan RNA-nya [ [ 36 ] ]. Analisis data sekuensing diizinkan oleh Otoritas Tinjauan Etika Swedia (2019–03086, 2020–01374). Jaringan FFPE kanker prostat yang dideidentifikasi dari spesimen prostatektomi diterima dari biobank Prostate Cancer Biorepository Network (PCBN) (nomor persetujuan #15–025). Izin etis untuk pengumpulan jaringan biobank diperoleh dari dewan peninjau kelembagaan lokal di Memorial Sloan Kettering Cancer Center, New York, AS. Rangkaian jaringan prostat manusia (kanker) (NBP2-30169; Novusbio, Centennial, CO, AS) digunakan untuk memeriksa hubungan antara CMV dan ekspresi protein reseptor androgen. Sampel metastasis tulang beku segar dan FFPE dari pasien dengan kanker prostat resistan pengebirian dikumpulkan di Rumah Sakit Universitas Umeå (kelompok yang dijelaskan dalam, misalnya, [ [ 37 ] ]). Pengumpulan dan analisis metastasis tulang disetujui oleh dewan peninjau etik lokal Universitas Umeå (Dnr 2016–332-32M).
Sebuah studi kohort prospektif berdasarkan data dari beberapa registri terkait populasi Denmark dilakukan [ [ 38 – 41 ] ]. Hukum Denmark tidak memerlukan persetujuan dari komite etik atau persetujuan dari pasien untuk melakukan studi berbasis registri.
2.2 Pengolahan jaringan dan darah donor postmortem
Kami mengumpulkan potongan melintang jaringan prostat yang dirancang untuk menyertakan bagian zona sentral, transisi, dan perifer kelenjar dari 41 donor postmortem pria berusia 19–89 tahun (Gbr. S1 ). Satu sisi prostat dibekukan pada suhu -80 °C, dan satu sisi mengalami fiksasi dan penanaman parafin. Serum dipisahkan dari produk darah lainnya dengan sentrifugasi pada 20 menit, 3500 rpm pada suhu 4°. Evaluasi histologis kanker prostat dinilai dalam slide prostat FFPE yang diwarnai H&E oleh ahli patologi terlatih. Kanker prostat insidental (skor Gleason 3 + 3) terdeteksi pada satu subjek, dan kanker prostat insidental yang diduga terdeteksi pada subjek lain tetapi sulit untuk dinilai lebih lanjut secara histologis karena efek postmortal pada jaringan. Keberadaan kanker divalidasi oleh kurangnya ekspresi protein p63 dengan imunohistokimia. Dua individu tambahan telah diobati untuk kanker prostat dengan radiasi lokal atau kemoterapi.
Titer IgG Anti-CMV dalam serum dianalisis menggunakan CMV IgG, uji CMIA (Architect, Abbott) atau dengan CMV IgG CLIA (chemiluminescence immunoassay) pada LIAISON®XL Analyzer di Laboratorium Mikrobiologi Klinis Rumah Sakit Universitas Karolinska.
2.3 Karakterisasi spesimen kanker prostat dan metastasis tulang
Dalam material yang dikumpulkan di PCBN, lokasi tumor diuraikan dalam irisan yang diwarnai H&E oleh seorang ahli patologi yang terkait dengan PCBN. Karakterisasi fenotipe metastasis tulang, dibagi menjadi MetA (aktivitas AR tinggi), MetB (terdiferensiasi, proliferasi meningkat), dan MetC (nonluminal, diperkaya EMT) telah dijelaskan sebelumnya [ [ 2 ] ]. Kohort metastasis tulang kami berisi MetA, dalam penelitian ini disebut didorong oleh AR, dan MetB, dalam penelitian ini disebut tidak didorong oleh AR.
Analisis data sekuensing RNA ultra-dalam CPC-GENE sebagian telah dijelaskan dalam [ [ 8 ] ]. Selain itu, pembacaan yang memetakan genom CMV (NC_006273.2), yang dirangkai dengan genom manusia, dieksplorasi ( n = 144). Parameter default dengan STAR digunakan untuk menyelaraskan pembacaan. Tidak ada hasil spesifik CMV yang terdeteksi saat menganalisis 173 gen CMV. Pembacaan kontaminan yang memetakan wilayah CMV Major Immediate Early ditemukan dalam 19 dari 144 sampel.
2.4 Kelompok populasi asiklovir
Kami melakukan studi kohort berdasarkan data dari registri Denmark berbasis populasi berikut: Registri Kanker [ [ 38 ] ], Registri Penyebab Kematian, Registri Resep Nasional Denmark [ [ 39 ] ], Registri Pasien Nasional Denmark [ [ 41 ] ], dan Sistem Registrasi Sipil Denmark [ [ 40 ] ]. Keterkaitan yang tidak ambigu antara registri Denmark dimungkinkan dengan menggunakan Nomor Registrasi Sipil Denmark yang diberikan kepada semua penduduk Denmark sejak 1968, saat lahir, atau saat berimigrasi ke negara tersebut [ [ 40 ] ]. Warga negara Denmark memiliki akses yang sama yang didukung pajak terhadap perawatan kesehatan yang disediakan oleh Layanan Kesehatan Nasional Denmark. Registri Kanker Denmark telah mencatat kasus insiden kanker secara nasional sejak 1943 dan telah terbukti memiliki kepastian kasus yang hampir lengkap. Diagnosis kanker dalam Registri Kanker dicatat menurut Klasifikasi Penyakit Internasional, versi 10, dan Klasifikasi Penyakit Internasional untuk onkologi untuk kode topografi dan morfologi. Kanker prostat didefinisikan dengan kode ICD-10 C61 dalam Cancer Registry. Kematian akibat kanker prostat tercatat dalam Cause of Death Registry dengan kode ICD-10 C61. Kami mengambil informasi yang tersedia tentang insiden kanker prostat dan kematian akibat kanker prostat dari tahun 1970 hingga 2020.
Registri Resep Nasional Denmark berisi informasi tentang semua resep yang diberikan di apotek komunitas di Denmark sejak 1995 [ [ 39 ] ]. Untuk setiap resep, Registri Resep mencatat tanggal dan deskripsi lengkap produk yang diberikan termasuk Kode Terapi Anatomi (ATC). Kami mengambil informasi yang tersedia dari Registri Resep dari tahun 1995 hingga 2020. Kami mengidentifikasi pria yang diberi resep asiklovir sistemik (asiklovir ATC J05AB01 atau valasiklovir ATC J05AB11) antara tahun 1996 dan 2020 dan menggunakan tanggal resep pertama sebagai awal tindak lanjut ( n = 313.072). Tindak lanjut dimulai satu tahun setelah dimulainya Registri Resep Nasional Denmark (masing-masing tahun 1996 dan 1995). Karena Registri Resep Nasional Denmark tidak ada sebelum tahun 1995, tidak diketahui apakah pria telah diberi resep asiklovir sistemik sebelum tahun ini. Hal ini dapat mengakibatkan kesalahan klasifikasi, dan kami mengurangi bias ini sebagian dengan melakukan tinjauan ulang setidaknya satu tahun untuk setiap peserta studi guna menemukan pengguna narkoba baru dan nonpengguna yang sesuai. Indikasi asiklovir sistemik meliputi herpes zoster (reaktivasi varicella zoster), profilaksis terhadap herpes genital (reaktivasi herpes simpleks 2) dan profilaksis terhadap reaktivasi CMV pada pasien dengan transplantasi organ atau sel punca.
Berikutnya, kami menerapkan beberapa kriteria eksklusi: laki-laki di bawah usia 40 tahun pada resep pertama mereka dikecualikan; n = 144.352 (46,1%). Pengguna asiklovir yang lazim (ditentukan dari tahun 1995 dan seterusnya) dikecualikan; n = 7.628 (2,4%). Laki-laki yang diresepkan dengan analog nukleotida lain sebelum dimulainya tindak lanjut dikecualikan; n = 460 (0,1%). Laki-laki dengan kanker prostat sebelum dimulainya tindak lanjut dikecualikan; n = 4.516 (1,4%). Oleh karena itu, kelompok akhir pengguna asiklovir terdiri dari 156.116 laki-laki. Kami juga mensyaratkan bahwa nonpengguna yang cocok tidak memiliki diagnosis kanker prostat dan tidak ada resep ATC J05AB (analog nukleotida termasuk asiklovir dan valasiklovir) sebelum tanggal indeks mereka (tanggal resep pertama untuk pengguna yang sesuai). Pengguna asiklovir dicocokkan 1:5 dengan nonpengguna asiklovir/valasiklovir sistemik dari populasi umum (selanjutnya didefinisikan sebagai nonpengguna asiklovir). Pengguna asiklovir dicocokkan dengan nonpengguna berdasarkan tahun lahir dan tahun kalender yang dikelompokkan berdasarkan interval empat tahun (Tabel S1 ). Secara keseluruhan, kelompok studi mencakup 780.580 nonpengguna asiklovir (Gbr. 4 ). Kelompok tahun kalender digunakan sebagai faktor pencocokan untuk memperhitungkan perbedaan skrining s-PSA seiring waktu.
Usia rata-rata untuk pengguna asiklovir adalah 61,5 (SD, 12,7; Tabel S1 ), dan peserta studi diikutsertakan sepanjang tahun 1996 hingga 2020 (tahun kalender, dikelompokkan menurut 4 tahun; Tabel S1 ). Median waktu tindak lanjut adalah 7,6 tahun (IQR, 3,5–12,8) dengan 1.324.582 tahun-orang untuk bukan pengguna asiklovir dan 6.744.409 tahun-orang untuk pengguna asiklovir (Tabel S1 ). Selama tindak lanjut, 36.428 pria (3,9%) didiagnosis dengan kanker prostat dan 8.366 pria meninggal karena kanker prostat (0,9% bukan pengguna asiklovir, 0,8% pengguna asiklovir) (Tabel S1 ). Pengguna asiklovir lebih mungkin memiliki indeks Komorbiditas Charlson yang tinggi (tiga atau lebih tinggi) (Tabel S1 ).
2.5 Pengayaan dan validasi CD14 + darah
Darah tepi dari donor postmortem dicampur dengan PBS-EDTA (EDTA 2 mm ) dan disentrifugasi pada 900 g selama 20 menit dalam tabung pemisah darah berisi 16 mL Lymphoprep™ (STEMCELL Technologies, Vancouver, BC, Kanada). Sel darah putih dipisahkan, dicuci dengan PBS-EDTA, dan disaring melalui filter 100 μm. Setelah disentrifugasi pada 1500 g selama 5 menit, pelet disuspensikan kembali dalam 1 mL buffer MACS (PBS-EDTA, 0,5% (b/b) BSA) dan diinkubasi dalam 1:20 CD14 MicroBeads (Miltenyi Biotec, Bergisch Gladbach, Jerman) selama 20 menit pada suhu 4 °C. Suspensi dicuci dalam buffer MACS, disentrifugasi, dan disuspensikan kembali dalam 1 mL buffer MACS. Sel CD14 + diperkaya menggunakan kolom LS (Miltenyi Biotec) pada pemisah manual MACS® (Miltenyi Biotec). Untuk memvalidasi pengayaan manik, sel diinkubasi dengan antibodi monoklonal anti-CD11b terkonjugasi fikoeritrin (PE) (1:20, BioLegend, klon ICRF44, San Diego, CA, AS) selama 30 menit pada suhu ruangan, disentrifugasi, dan disuspensikan kembali dalam buffer MACS. Sel yang diperkaya manik dan sel yang tidak diperkaya manik (flow-through) dianalisis dengan flow cytometry pada mesin INFLUX. FlowJo versi 10.5.3 digunakan untuk menganalisis plot penyortiran sel teraktivasi fluoresensi (FACS) dan memberikan statistik pada fraksi sel CD11b + , setelah mengeluarkan serpihan sel. Sel yang diperkaya manik disimpan dalam PBS pada suhu -80 °C hingga dilakukan analisis lebih lanjut.
2.6 Imunoblot sampel dan sel manusia
Jaringan prostat manusia yang dibekukan dipotong dalam irisan tipis 10–30 μm pada kriostat dan dimasukkan ke dalam tabung. Buffer lisis (20 mm Tris pH 7,5, 1% triton X-100, 150 mm NaCl , 5 mm EDTA , 10% gliserol, 10 mm NaF) dengan koktail inhibitor protease dan fosfatase Halt (78 440; Thermo Fisher, Waltham, MA, AS) ditambahkan ke sampel. Lisat prostat diolah dengan alu plastik. Lisat sel dan lisat prostat diaduk selama 30 detik dan kemudian disentrifugasi selama 10 menit pada 16,9 RCF pada suhu 4 °C, dan supernatan dikumpulkan. Konsentrasi protein diukur dengan Pierce BCA Protein Assay Kit (23 225; Thermo Fisher) sesuai dengan petunjuk pabrik pembuatnya. Sampel protein prostat (40 μg) dan sampel protein sel (10–20 μg) diinkubasi dalam buffer sampel NuPAGE LDS (NP0007; Thermo Fisher) dengan 10% β-merkaptoetanol sesuai dengan petunjuk pabrik. Sampel dimasukkan ke dalam NuPAGE 4 hingga 12%, Bis-Tris, 1,5 mm, Mini Protein Gel, 10-well (NP0335BOX, Thermo Fisher) dan elektroforesis dilakukan dalam buffer NuPAGE MOPS SDS (NP0001; Thermo Fisher) dengan antioksidan NuPAGE (NP0005; Thermo Fisher). BenchMark Pre-stained Protein Ladder (10 748 010; Thermo Fisher) atau PageRuler Prestained protein ladder (26 616; Thermo Fisher) digunakan sebagai protein ladder. Setelah elektroforesis, protein dipindahkan ke Trans-Blot Turbo Mini 0,2 μm PVDF Transfer Packs (1 704 156, Bio-Rad, Hercules, CA, AS) menggunakan sistem transfer turbo trans-blot (Bio-Rad). Membran diinkubasi dalam buffer pemblokiran Superblock di TBS (37 535; Thermo Fisher) dengan 0,05% tween-20 selama minimal 30 menit atau susu selama satu jam.
Antibodi primer diencerkan dalam buffer pemblokiran dan diinkubasi semalam pada suhu 4 °C. Antibodi primer yang digunakan: Cytomegalovirus US28 (1:2000, kelinci, PA5-102302, Thermo Fisher), Cytomegalovirus UL97 (1:2000, kelinci, PA5-99784, Thermo Fisher), Reseptor Androgen (1:2000, tikus, 411, sc-7305, Santa Cruz Biotechnology, Dallas, Texas, AS), dan Cytomegalovirus IE1/2 (1:2000, tikus, MAB810R, monoklonal, Millipore, Burlington, MA, AS). Sebagai kontrol tingkat protein endogen, β-aktin (1:5000, tikus, klon AC-74, A2228, Sigma-Aldrich, Saint Louis, MO, AS) digunakan dan diinkubasi selama satu jam. Membran dicuci dalam TBS dengan 1% tween-20 (TBS-T) dan diinkubasi dengan antibodi sekunder yang diencerkan dalam buffer pemblokiran selama 2 jam (1:5000, anti-mouse-HRP, NA931V; anti-rabbit-HRP, NA934V, GE Healthcare, Chigaco, Illinois, AS). Setelah dicuci dalam TBS-T, membran dikembangkan dengan substrat durasi diperpanjang SuperSignal west dura (Thermo Fisher) atau SuperSignal West Atto (Thermo Fisher) dan dicitrakan pada sistem pencitraan ChemiDoc MP (Bio-Rad). Blot protein non-CMV dikembangkan dengan ECL dan film. Pita imunoblot diukur dalam ImageJ64 dengan alat analisis gel menggunakan β-aktin sebagai kontrol pemuatan.
2.7 CMV IHC pada jaringan FFPE manusia
Jaringan difiksasi dalam formaldehida, ditanamkan dalam parafin (FFPE), dan dipotong menjadi slide dengan ketebalan 4 μm. Slide jaringan FFPE dideparafinisasi dan dihidrasi ulang dalam xylene dan gradien etanol. Setelah dicuci dalam dH 2 O, slide diinkubasi dalam 1× Antigen Unmasking Solution, Citric Acid Based (100×, H-3300, Vector Laboratories, Newark, CA, AS) selama 30 menit dalam steamer, didinginkan selama 10 menit, lalu dicuci dalam PBS. Slide kontrol positif CMV (CSC0925P, American MasterTech, Lodi, CA, AS) diinkubasi dalam larutan antigen unmasking selama 20 menit dalam steamer. Slide diinkubasi selama 10–15 menit dalam larutan pemblokiran BLOXALL (SP-6000, Vector Laboratories) atau 3% H 2 O 2 , dicuci dalam PBS, diinkubasi selama 20 menit dengan penghambat reseptor FC (Innovex Biosciences, Richmond, CA, AS), diinkubasi selama 45 menit dengan 10% serum keledai yang mengandung 0,5% triton, lalu diinkubasi dengan kit pemblokiran avidin/biotin (Vector Laboratories) sesuai dengan petunjuk pabrik.
Antibodi primer kemudian diencerkan dalam serum keledai 10% dan diinkubasi pada suhu kamar semalaman. Antibodi primer yang digunakan: Cytomegalovirus US28 (kelinci, 1:150, PA5-39864, poliklonal, Thermo Fisher), Cytomegalovirus pp65 (tikus, 1:50, klon CH12, sc-56 976, monoklonal, Santa Cruz Biotechnology), Cytomegalovirus pp71 (kambing, 1:200, klon vC-20, sc-33 323, poliklonal, Santa Cruz Biotechnology), Cytomegalovirus IE1 (tikus, 1:10, pp72, klon 6E1, sc-69 834, Santa Cruz Biotechnology), Cytomegalovirus IE1/2 (tikus, 1:150, MAB810R, monoklonal, Millipore), Chromogranin A (tikus, 1:100, LK2H10, MA5-13096, Thermo Fisher), keratin 5 (kelinci, 1:200, EP1601Y, ab52635, Abcam), keratin 18 (kelinci, 1:100, H-80, sc-28 264, Santa Cruz Biotechnology), TP63 (tikus, 1:100, klon 4A4, CM163A, Biocare Medical, Pacheco, CA, AS), Ki-67 (kelinci, 1:100–250, klon SP6, Thermo Fisher), sitokeratin spektrum luas (kelinci, 1:100, ab9377, abcam, Cambridge, Inggris), pan-keratin (tikus, 1:200, klon C11, #4545, Cell Signaling, Danvers, MA, AS), dan AR (kelinci, 1:50–100, klon SP107, Thermo Fisher).
Setelah dicuci dalam PBS, slide diinkubasi dengan antibodi sekunder yang dikonjugasikan dengan biotin (keledai anti-tikus biotin atau keledai anti-kelinci biotin, 1:500, laboratorium Jackson, Bar Harbor, Maine, AS) atau antibodi sekunder yang dikonjugasikan dengan fluorofor (keledai anti-tikus 488/cy3/cy5, keledai anti-kelinci 488/cy3/cy5, laboratorium Jackson). Jika diinkubasi dengan antibodi sekunder yang dikonjugasikan dengan biotin, slide kemudian diinkubasi dengan VECTASTAIN Elite ABC HRP Reagent, RTU (PK-7100, laboratorium Vector) 30 menit, setelah itu slide dicuci dalam PBS dan diinkubasi dengan ImmPACT DAB (Laboratorium Vector) atau TSA menggunakan kit Alexa Fluor 488 Tyramide SuperBoost (B40932, Thermo Fisher) sesuai dengan petunjuk pabrik pembuatnya. Untuk co-labelling, slide diperlakukan dengan hidrogen peroksida 3% selama 15 menit, diinkubasi dengan antibodi primer semalaman, dan kemudian dikembangkan dengan TSA Tyramide 555 atau Tyramide 647. Slide yang diwarnai DAB diwarnai dengan hematoxylin QS (Vector Laboratories) setelah dicuci dalam air, didehidrasi dalam serangkaian etanol dari 50% hingga 100%, diinkubasi dalam xilena, dikeringkan dengan udara, dan dipasang dengan media pemasangan pertex (Histolab). Slide yang diwarnai fluoresensi diwarnai dengan DAPI (1:5000, Sigma-Aldrich) dan dipasang dengan media pemasangan Prolong Gold Antifade (Thermo Fisher).
2.8 Hibridisasi DNA CMV in situ
Kaca jaringan prostat FFPE dideparafinisasi dan dihidrasi ulang dalam gradien xilena dan etanol. Hewan diperfusi dengan formaldehida 4% dan difiksasi ulang semalaman. Kelenjar prostat dan xenograft kanker prostat dibedah dan diinkubasi dalam sukrosa 30% b/b pada suhu 4 °C. Jaringan ditempatkan dalam OCT dan dipotong menjadi kaca slide pada kriostat dengan ketebalan 12 μm. Kaca slide jaringan disimpan pada suhu -20 °C. Kaca slide dihangatkan pada suhu 42 °C selama 1 jam. Setelah dicuci dalam dH 2 O, kaca slide FFPE diinkubasi dalam 1× RISH Retrieval (RI0209M, Biocare Medical) selama 15 menit dan kemudian didinginkan selama 10 menit. Semua slide diinkubasi dengan 3% H 2 O 2 dalam 30% metanol selama 5 menit dan dicuci dalam dH 2 O. Kemudian slide diperlakukan dengan RISHzyme (jaringan prostat FFPE 1:4; OCT prostat tikus 1:4; OCT xenograft 1:8) dalam buffer RISHzyme (Biocare Medical) selama 1 menit. Slide kemudian diinkubasi dengan RNAse, DNAse free (Roche, Sigma-Aldrich) 1:5 dalam buffer SSC 2× pada suhu 37 °C selama 30 menit. RNAse dicuci dan slide diinkubasi dengan probe RISH CMV berlabel digoxigenin (R10011T, Biocare Medical) pada suhu 95 °C selama 15 menit (jaringan prostat FFPE) atau 5 menit (prostat tikus dan xenograft) dan kemudian pada suhu 37 °C semalaman.
Slide yang dihibridisasi kemudian dikenakan pencucian dengan metode stringency. Slide dicuci dalam 4x SSC 5 menit ×2 pada suhu ruangan dan 0,01x SSC 5 menit ×2 pada suhu 80 °C. Slide diinkubasi dengan reagen sekunder dan reagen tersier per protokol (perangkat deteksi RISH HRP, Biocare Medical) setelah itu hibridisasi CMV dikembangkan dengan TSA yang digabungkan ke Cy3 (NEL744001KT, PerkinElmer, Waltham, MA, AS) atau menggunakan perangkat Alexa Fluor 488 tyramide SuperBoost (B40932, Thermo Fisher) sesuai dengan petunjuk pabrik. Untuk co-labeling FFPE, slide prostat diperlakukan dengan hidrogen peroksida 3% selama 15 menit. Setelah dicuci dalam PBS, slide diwarnai seperti yang dijelaskan untuk IHC. Pewarnaan IHC FFPE dikembangkan dengan TSA menggunakan Tyramide 555 atau Tyramide 647 atau dengan DAB (seperti yang dijelaskan untuk IHC). Untuk jaringan lain, slide diinkubasi dengan 10% NDS yang mengandung 0,5% triton selama 45 menit, setelah itu slide diinkubasi semalam dengan antibodi terhadap spektrum luas cytokeratin (1:100, kelinci, ab9377, abcam) yang diencerkan dalam 10% NDS. Setelah dicuci dalam PBS, slide diinkubasi dengan antibodi sekunder selama 1 jam (donkey anti-rabbit-488, 1:500, Jackson Laboratories), setelah itu slide diwarnai dengan DAPI (1:5000, sigma) dan dipasang dengan media pemasangan Prolong Gold (ProLong™ Gold Antifade Mountant, Thermo Fisher).
2.9 Imunofluoresensi pada sel dan jaringan tikus
Sel yang tumbuh dalam slide kultur 8-well (BD Bioscience, Milpitas, CA, AS) difiksasi dalam formaldehida 4% selama 10–15 menit dan dicuci dalam PBS. Tikus diperfusi dengan formaldehida 4% semalaman dan kemudian dicuci dalam PBS. Xenograft dan jaringan diinkubasi dalam sukrosa 30% dan kemudian ditanamkan dalam OCT dan dipotong pada bagian setipis 12 μm ke slide kaca dalam kriostat. Sel diinkubasi dengan 3% BSA dengan 0,3% triton atau 10% serum Donkey dengan 0,5% triton selama 20 menit pada suhu kamar. Jaringan dan xenograft diinkubasi dengan 10% serum Donkey dengan 0,5% triton selama 45 menit. Antibodi primer diencerkan dalam 1% BSA atau 10% serum donkey dan diinkubasi pada suhu kamar selama 3 jam atau semalaman pada 4 °C.
Antibodi primer yang digunakan: γ-H2AX (pS139) (kelinci, 1:500, ab2893, Abcam), Cleaved caspase-3 (kelinci, 1:250, klon D175, 9661S, Cell Signaling), Histone H3 (phospho S10) (kelinci, 1:500–1000, ab5176, Abcam), Ki-67 (kelinci, 1:250, klon SP6, Thermo Fisher), Ki-67 (tikus, 1:500–1000, klon SolA15, 14–5698-82, eBioscience, San Diego, CA, AS), Cytomegalovirus IE1/2 (tikus, 1:200, MAB810R, Millipore), Cytomegalovirus UL97 (kelinci, 1:100, hadiah dari Coen laboratorium, Universitas Harvard), SP1 (kelinci, 1:100, 5931S Cell Signaling), TOPIIB (kelinci, 1:100, ab72334, Abcam), dan pRB (S807/811) (kelinci, 1:250, D20B12, 8516, Cell Signaling).
Kemudian, slide dicuci dengan PBS dan diinkubasi dengan antibodi sekunder (Donkey anti-rabbit cy3, 1:1000, Jackson Laboratories), yang diencerkan dalam 1% BSA selama 45–60 menit. Untuk deteksi EdU, Click-it EdU Alexa Fluor 647 Imaging Kit atau Click-it Edu Plus Alexa Fluor 647 Imaging Kit (Thermo Fisher) digunakan sebelum pewarnaan antibodi. Slide dicuci dengan PBS dan diinkubasi dengan DAPI (1:5000, Sigma-Aldrich), dicuci dalam PBS, dan dipasang dengan ProLong Gold Antifade Mountant (Thermo Fisher).
2.10 Mikroskopi dan analisis gambar
CMV IHC dan hibridisasi in situ pada jaringan prostat manusia yang divisualisasikan dengan DAB dianalisis menggunakan mikroskop cahaya (CTR6000, Leica, Wetzlar, Jerman), dan gambar diambil menggunakan perangkat lunak LAS X (Leica) dengan lensa objektif 40x atau 20x. CMV IHC dan hibridisasi in situ yang divisualisasikan dengan fluoresensi dianalisis menggunakan mikroskop confocal Zeiss Imager Z2 atau Zeiss LSM 700. Gambar diambil menggunakan perangkat lunak ZEN 2012 SP1 (8.1) (Zeiss, Oberkochen, Jerman) dan gambar untuk publikasi diproses dalam ImageJ64 atau imagej v.1.52 dan photoshop. Ketika dianalisis dalam mikroskop fluoresensi, pan-keratin digunakan sebagai penanda untuk membedakan sel epitel dari jenis sel lainnya.
Untuk kuantifikasi kelimpahan CMV IHC, objektif 20x digunakan untuk menganalisis seluruh bagian jaringan prostat dan objektif 10x digunakan dalam analisis metastasis tulang. Ketika area dengan epitel terlihat, ini ditentukan sebagai positif atau negatif untuk sel epitel yang mengandung CMV. Area epitel positif CMV dapat sepenuhnya positif untuk CMV atau mengandung lebih sedikit sel positif CMV. Ketika dianalisis dalam mikroskop cahaya, tidak ada penanda untuk sel epitel yang digunakan, karena epitel terlihat jelas dengan hematoxylin. Untuk CMV-US28, berbagai jumlah sel dengan pewarnaan sitoplasma US28 yang sangat tinggi ditemukan di seluruh bagian jaringan, terlepas dari status serologi CMV. Ini dianggap sebagai sel yang diwarnai latar belakang dan tidak dipertimbangkan saat menentukan kelimpahan CMV di area epitel.
Intensitas dalam inti sel (DNA CMV, protein AR) dibandingkan dalam gambar confocal dengan ImageJ64 atau imagej v.1.52 menggunakan fungsi IntDen. Untuk kuantifikasi persentase sel yang positif terhadap penanda, jumlah sel dihitung secara manual atau dengan menggunakan fitur kuantifikasi sel dalam imagej menggunakan ambang batas untuk mengkuantifikasi jumlah sel. Untuk kuantifikasi jumlah fokus γH2AX per sel, 27–50 sel dianalisis per sumur dalam ImageJ64 dalam gambar yang diambil dengan objektif 40x atau 63x.
2.11 Ekstraksi DNA dan PCR CMV kuantitatif
Jaringan beku dipotong ke dalam tabung Eppendorf bebas DNase dalam kriostat bersih, pisau diganti dan kriostat dibersihkan dengan etanol di antara setiap spesimen, untuk mengurangi risiko kontaminasi. Jaringan dan pelet sel disimpan pada suhu -80 °C hingga ekstraksi DNA. DNA diekstraksi menggunakan DNeasy Blood and Tissue Kit (QIAGEN, Hilden, Jerman) menggunakan petunjuk pabrik termasuk penanganan sampel dengan RNAse A (QIAGEN). Konsentrasi DNA diukur pada nanodrop atau pada Qubit menggunakan Qubit dsDNA BR Assay Kit (Thermo Fisher) sesuai dengan petunjuk pabrik.
Kontrol DNA sitomegalovirus Amplirun (MBCO16, Vircell, Granada, Spanyol) digunakan sebagai kontrol positif. DNA kontrol positif dilarutkan kembali dalam 100 μL buffer sesuai petunjuk pabrik dan diencerkan 1:10 dalam dH2O. Dari jumlah ini, 1 μL digunakan per reaksi qPCR menggunakan campuran master cepat TaqMan (Thermo Fisher) dan primer/probe TaqMan yang dijelaskan di bawah ini. Enzim restriksi BsrI memiliki 387 situs restriksi pada galur CMV Merlin. 1000 ng DNA prostat atau 300–500 ng DNA metastasis tulang diinkubasi dalam reaksi 25 μL yang mengandung 1× NEBuffer 3.1 (NEB, Ipswich, MA, AS) dengan atau tanpa 0,2 μL enzim restriksi Bsr1 (10.000 unit·mL −1 ; NEB) pada suhu 65° selama 16 jam dan kemudian 85° selama 20 menit. Untuk sampel yang diobati dengan bsr1, 5 μL dimasukkan ke dalam satu reaksi qPCR. Jika tidak, jumlah DNA yang dimasukkan adalah 500 ng per reaksi untuk lini sel dan sampel DNA prostat postmortem dan 100–200 ng untuk sel CD14 + . Sampel dianggap positif jika kurva amplifikasi qPCR berhasil dihasilkan. Untuk lini sel dalam percobaan, 10 ng DNA digunakan. qPCR dilakukan pada pelat 96-well dan dijalankan pada sistem PCR Fast Real-Time 7500 (Applied Biosystems, Waltham, MA, AS) atau sistem CFX96 (Bio-Rad) dengan 60–70 siklus. Campuran master berikut digunakan: campuran master cepat TaqMan (Thermo Fisher); campuran master qPCR UL83, GoTaq Probe (Promega); Campuran Master Probe UL83, UL37, dan qRT-PCR Brilliant III dengan ROX (Agilent); UL32, UL36, UL38, UL87, UL97, UL122. Primer/probe TaqMan yang telah didesain sebelumnya GAPDH (Hs02786624_g1) digunakan. Beberapa primer/probe TaqMan kustom digunakan. Lihat Tabel S3 untuk urutan primer/probe.
Ukuran produk PCR divisualisasikan pada gel agarosa 3% dengan ladder 50 bp. Identitas produk PCR yang benar dalam jaringan prostat divalidasi dengan sequencing Sanger pada produk PCR yang dikloning ke dalam plasmid dengan TOPO TA Cloning Kit (K457501, Thermo Fisher).
2.12 Ekstraksi RNA dan RT-qPCR
Untuk pemeriksaan ekspresi gen CMV dalam lini sel, RNA diekstraksi dengan kit RNeasy Plus Mini (74 034, QIAGEN). Sebelum sintesis cDNA, RNA diperlakukan dengan enzim ezDNAse (Thermo Fisher) sesuai dengan petunjuk pabrik pembuatnya. Sintesis cDNA dilakukan dengan SuperScript IV First-Strand Synthesis System (Thermo Fisher) menggunakan input RNA 5 μg dengan oligo DT atau heksamer acak pada suhu 50 atau 65 °C. Dari pustaka cDNA, 2 μL digunakan sebagai input untuk setiap reaksi RT-qPCR. RT-qPCR dilakukan dengan menggunakan Premix Ex Taq (Probe qPCR) (RR390L; TAKARA; Kusatsu, Jepang) pada mesin qPCR CFX96 Real-Time System (Bio-Rad). Primer/probe TaqMan khusus untuk mendeteksi LUNA, UL97, dan UL122–UL123 digunakan.
Untuk percobaan sel, RNA diekstraksi dengan kit RNeasy Plus Mini (74 034, QIAGEN) dan cDNA dibuat dari RNA dengan kit sintesis cDNA SuperScript VILO (11 754 050, Thermo Fisher). RT-qPCR dilakukan menggunakan TaqMan Fast Advanced Master Mix (4 444 556, Thermo Fisher) dan primer/probe TaqMan. RT-qPCR dilakukan pada Sistem PCR Fast Real-Time 7500 (Thermo Fisher) atau Sistem Real-Time CFX96 (Bio-Rad). Primer/probe TaqMan ini digunakan: AR (Hs00171172_m1), KLK3 (Hs02576345_m1), TMPRSS2 (Hs01122322_m1), dan GAPDH (Hs02786624_g1). Primer/probe AR-V7 TaqMan dibuat khusus, lihat Tabel S4 untuk urutan primer/probe.
2.13 Kondisi kultur garis sel
LNCaP (RRID:CVCL_0395), DU145 (RRID:CVCL_0105), dan PC3 (RRID:CVCL_0035) dibeli dari ATCC dan dikulturkan dalam RPMI-1600 (Thermo Fisher) dengan 10% FBS dan 1% Penicillin–Streptomycin (PS). VCaP (RRID:CVCL_2235) dan MyC-CaP (RRID: CVCL_J703) dibeli dari ATCC dan dikulturkan dalam DMEM (Thermo Fisher) dengan 10% FBS dan 1% PS. WI-38 (RRID:CVCL_0579) dibeli dari ATCC dan dikulturkan dalam DMEM dengan GlutaMax (Thermo Fisher) dengan 10% FBS dan 1% PS. LAPC-4 (RRID:CVCL_4744) merupakan hadiah dari Robert Reiter, Universitas California, Los Angeles, AS. LAPC-4 dikulturkan dalam IMDM dengan 5% FBS dan 1% PS. LREX’ (RRID:CVCL_UD76) [ [ 42 ] ] merupakan hadiah dari Charles Sawyers, MSKCC, New York, AS. LREX’ dikulturkan dalam 20% FBS, dan 1 μM enzalutamide dan 1% PS. LNCaP-abl (RRID:CVCL_4793) [ [ 43 ] ] merupakan hadiah dari Helmut Klocker, Universitas Kedokteran Innsbruck, Austria. LNCaP-abl dikulturkan dalam RPMI-1600 dengan 10% FBS yang dilucuti arang dan 1% PS. Sejak kedatangannya di laboratorium kami, lini sel telah ditangani dan dikulturkan tanpa adanya CMV murni, sehingga meminimalkan risiko kontaminasi dari galur laboratorium. Semua percobaan dilakukan dengan sel yang bebas mikoplasma. Lini sel diautentikasi oleh Eurofins Genomics Cell Line Authentication Service (Ebersberg, Jerman) menggunakan AmpFlSTR Identifiler Plus PCR Amplification Kit (Thermo Fisher) dalam 3 tahun terakhir.
2.14 Transfeksi sel kanker prostat
Sel diperlakukan dengan interferensi RNA dengan reagen transfeksi Lipofectamine RNAiMax (Nomor Kat. 13778030, Thermo Fisher) sesuai dengan petunjuk pabrik. Untuk siRNA siluman, larutan stok siRNA digunakan pada 20 μ m , dan untuk siRNA silencer select, larutan stok siRNA pada 10 μ m digunakan. Sebagai kontrol, siRNA acak digunakan: Kontrol Negatif siRNA Stealth RNAi, Med GC (Thermo Fisher) atau Kontrol Negatif Silencer Select #1 siRNA (Thermo Fisher). SiRNA siluman terhadap SP1 dan TOPIIB digunakan. SiRNA Stealth yang dirancang khusus dan siRNA Silencer Select (Thermo) digunakan untuk menargetkan gen CMV. SiRNA Silencer Select digunakan terhadap CMV-IE1/2 (2) dengan sekuens yang digunakan dari [ [ 44 ] ]. Sekuens siRNA ditunjukkan pada Tabel S2 .
2.15 Pengobatan sel kanker prostat dengan senyawa
Obat-obatan berikut diberikan ke lini sel in vitro : 5-α DHT (5α-Androstane-17β-ol-3-one; A8380, Sigma-Aldrich), Aciclovir Hospira, konsentrat untuk infus intravena (25 mg·mL −1 asiklovir (111 mm ) , natrium hidroksida 4,6 mg·mL −1 , pH 11,3–11,5, Hospira, Pfizer), Cisplatin (2251; Tocris, Bristol, Inggris), Ellipticine (sc200878; Chemcruz, Santa Cruz Biotechnology), Etoposide (E1383; Sigma-Aldrich), Enzalutamide (Santa Cruz Biotechnology), Ganciclovir (Sigma-Aldrich), Letermovir (Cayman chemical, Ann Arbor, Michigan, AS), Maribavir (MedChemTronica), dan Mithramycin A (sc-200 909; Santa Cruz Biotechnology). EdU (Thermo Fisher) diberikan 1 jam sebelum fiksasi sel pada konsentrasi 10 μ m .
2.16 Uji viabilitas sel dan apoptosis
Sel-sel disemai dalam replikasi atau rangkap tiga. Viabilitas sel diukur dengan Uji Viabilitas Sel CellTiter-Glo 2.0 (G9242, Promega, Madison, Wisconsin, AS) sesuai dengan petunjuk pabrik pada alat pembaca luminesensi. IC50 relatif disesuaikan dengan kecocokan nonlinier dan dihitung dalam GraphPad Prism 8. Demikian pula, IC50 absolut dihitung, dengan 0% sebagai garis dasar dan 100% sebagai batasan atas. Untuk analisis apoptosis, digunakan Sistem Uji Caspase-Glo 3/7 (G8090, Promega). Induksi apoptosis ditentukan dengan membagi luminesensi apoptosis dengan luminesensi viabilitas sel. Nilai yang dihasilkan kemudian dibandingkan antara sel yang diobati dan sel kontrol untuk menentukan perubahan lipat dalam apoptosis.
2.17 Percobaan pada hewan
Percobaan pada hewan telah disetujui oleh Dewan Pertanian Swedia, Stockholm (aplikasi 6727–18, aplikasi N132/13 dengan amandemen N150/16 dan N170/16). Tikus SCID jantan berusia 8 minggu atau lebih (Tikus SCID® Fox Chase CB17/Icr-Prkdcscid/IcrIcoCrl, Laboratorium Charles River) digunakan. Hewan dipelihara dalam kondisi kandang standar dengan siklus terang:gelap 12:12 jam. Semua hewan memiliki akses tak terbatas ke makanan dan air. Sel DU145 dan PC3 ditanamkan secara subkutan. Ketika ukuran xenograft telah berkembang menjadi volume rata-rata 150 mm 3 , pengobatan dimulai. Hewan diberi 1) pembawa atau mithramycin A (750 μg·kg −1 ), 2) pembawa atau maribavir (100 mg·kg −1 ), 3) kontrol atau valasiklovir (25 mg·g makanan −1 ) dan volume tumor dievaluasi setiap minggu. Titik akhir percobaan adalah ukuran tumor 1000 mm 3 atau saat titik akhir manusiawi tercapai.
Untuk menentukan dosis asiklovir dan konsentrasi plasma, hewan jantan dewasa diberikan valasiklovir dalam makanan, setelah itu darah diambil dan konsentrasi asiklovir diukur. Kaplet Valasiklovir (VALTREX, GlaxoSmithKline) 500 mg digiling menjadi bubuk halus menggunakan alu dan lumpang. Bubuk Valasiklovir dicampur ke dalam 60–80 gram bubur sukrosa. Konsentrasi valasiklovir adalah 25 mg valasiklovir·g makanan -1 . Setelah tujuh – sembilan hari, darah diambil secara kardial peri-mortem selama sedasi kloral hidrat atau pentobarbital yang dalam. Darah dibiarkan menggumpal dan kemudian disentrifugasi selama 10 menit pada 1500 g . Serum dipindahkan ke tabung polipropilena 1,5 mL dan disimpan pada suhu -20 °C hingga dilakukan analisis. Konsentrasi asiklovir serum diukur menggunakan LC–MS/MS (rutin digunakan untuk mengukur kadar asiklovir dalam sampel serum klinis), yang dilakukan di Laboratorium Farmakologi Klinis, Rumah Sakit Universitas Karolinska, Huddinge, Swedia.
Tikus SCID jantan ditanamkan 1,5 × 106 sel PC3 atau 2,0 × 106 sel DU145 secara subkutan pada sisi punggung bawah dalam medium RPMI 1:1:matrigel (Corning Matrigel Matrix, bebas fenol merah, Corning, Corning, NY USA), dalam volume total 100 μL. Tumor diukur secara manual dengan jangka sorong menggunakan rumus (x*y 2 )/2. X dan y adalah dua ukuran lebar dengan x sebagai nilai terukur terbesar. Ketika tumor telah berkembang hingga volume rata-rata 150 mm 3 , hewan diberikan obat, setelah itu hewan ditimbang dan dipantau pertumbuhan tumornya setiap minggu. Mithramycin A (750 μg·kg −1 ) diberikan ip sekali sehari pada minggu ke-1. Pada minggu ke-2–3, mithramycin A diberikan empat kali dengan setidaknya jeda satu hari di antara dosis. Pada minggu ke-4, mithramycin A diberikan setiap hari. Pada minggu ke-5–6, jadwal yang sama seperti minggu ke-2–3 diikuti. Pada minggu ke-7, mithramycin A diberikan setiap hari. Valaciclovir (25 mg·g makanan −1 ) diberikan dalam makanan bubur dengan interval 5 hari dengan jeda 7 hari. Titik akhir percobaan adalah ukuran tumor 1000 mm 3 atau ketika titik akhir manusiawi tercapai. Maribavir (100 mg·kg −1 ) diberikan melalui gavage oral dua kali sehari setiap hari kerja.
Dalam percobaan xenograft asiklovir, tumor intradermal yang dalam dan tumor yang jauh lebih besar pada titik akhir daripada yang diantisipasi oleh pengukuran tumor manual dikeluarkan dari analisis.
2.18 Analisis statistik
Semua analisis statistik dilakukan di GraphPad prism 8.0. Semua plot juga dibuat di GraphPad prism 8.0. Uji-t tak berpasangan dua sisi dilakukan pada data numerik kontinu dengan distribusi normal. Kelompok dengan data numerik kontinu non-normal dianalisis dengan uji Mann-Whitney. Analisis korelasi pada data terdistribusi non-normal dilakukan dengan analisis korelasi Spearman, dan analisis korelasi pada data terdistribusi normal dilakukan dengan analisis korelasi Pearson dan dengan regresi linier jika sesuai. Nilai berpasangan/cocok dianalisis dengan uji-t berpasangan dua sisi. Nilai yang dibandingkan dengan nilai tetap (misalnya, viabilitas sel 100% pada kontrol) dievaluasi secara statistik untuk deviasi statistik dari nilai ini dengan uji-t satu sampel. Proporsi antara dua kelompok dianalisis dengan uji eksak Fisher. Data terdistribusi non-normal dengan lebih dari dua kelompok dibandingkan dengan beberapa perbandingan Kruskal-Wallis.
Analisis kelangsungan hidup dengan uji log-rank untuk kelangsungan hidup hewan dalam percobaan xenograft dilakukan dengan uji log-rank (Mantel–Cox). Ukuran tumor dari waktu ke waktu dalam percobaan tikus dibandingkan antara kelompok perlakuan dengan model efek campuran pengukuran berulang, yang memungkinkan nilai yang hilang, dengan beberapa perbandingan untuk setiap titik waktu. Analisis statistik kohort populasi asiklovir dilakukan dengan menggunakan perangkat lunak SAS 9.4 (SAS Institute Inc., Cary, AS). Dalam model bahaya proporsional Cox, penggunaan asiklovir, usia pada tanggal indeks, tahun kalender, dan indeks Komorbiditas Charlson dimasukkan sebagai variabel.
3 Hasil
3.1 CMV pada sel epitel prostat
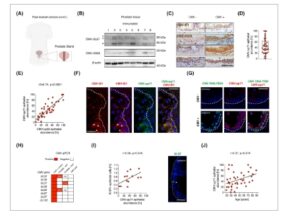
Kami bermaksud untuk mengkarakterisasi sejauh mana CMV hadir dalam jaringan prostat yang sehat dan dalam kanker prostat menggunakan beberapa metode ortogonal. Ekspresi gen CMV seringkali sulit atau tidak mungkin dideteksi dalam infeksi laten endogen, berbeda dengan infeksi litik aktif, meskipun DNA CMV hadir dalam kedua keadaan virus [ [ 26 , 29 ] ]. Pengurutan target CMV yang diperkaya dari sel-sel dari darah dan model latensi CMV in vitro telah menunjukkan ekspresi gen yang sangat rendah dari seluruh genom CMV [ [ 26 ] ]. Oleh karena itu, ekspresi protein dari sejumlah besar gen CMV diharapkan, tetapi sejauh pengetahuan kami belum dieksplorasi, dalam infeksi laten endogen sel-sel hematopoietik. Dalam model latensi, ekspresi protein CMV jauh berkurang dibandingkan dengan infeksi litik tetapi meskipun demikian, mereka dapat memiliki fungsi penting dalam pemeliharaan virus [ [ 25 , 45 , 46 ] ]. Ekspresi gen CMV belum terdeteksi oleh sequencing RNA dari sampel prostat [ [ 29 , 47 , 48 ] ] dan kami gagal mendeteksi transkrip CMV dalam analisis kanker prostat yang diurutkan secara mendalam (lihat Metode S1 ). Temuan nol ini mengusulkan bahwa CMV tidak ada, langka, atau laten. Untuk menilai apakah infeksi CMV laten dapat terjadi di kelenjar prostat, kami mengumpulkan jaringan prostat postmortem dari 41 pria berusia 19-89 tahun yang dua di antaranya telah didiagnosis dengan kanker prostat sebelum kematian (Gbr. 1A , Gbr. S1A ). Keberadaan DNA dan protein CMV dianalisis. Pertama, kami mengidentifikasi protein CMV yang berkarakterisasi dengan baik UL97 dan US28, keduanya diekspresikan selama latensi hematopoietik [ [ 26 ] ], dalam homogenat jaringan prostat dengan imunoblot ( n = 8; Gbr. 1B ). Tingkat protein CMV tidak berkorelasi dengan interval postmortem (Gambar S1B , n = 7).
Gbr. 1
Buka di penampil gambar
Presentasi PowerPoint
CMV dalam sel epitel prostat. (A) Ilustrasi, dibuat dengan Biorender.com , dari koleksi prostat dari donor postmortem. (B) Imunoblot homogenat jaringan prostat untuk protein CMV-UL97 (dengan tiga pita seperti yang diharapkan [ [ 81 ] ], ditandai dengan tanda bintang), CMV-US28, dan β-aktin dari delapan pria. kDa adalah kilodalton. (C) Gambar irisan prostat dengan pewarnaan antibodi CMV berwarna coklat di epitel. Nukleus diberi label ungu dengan hematoxylin. Skala batang 50 μm. (D) Kuantifikasi kelimpahan CMV-pp71 dalam sel epitel. Semua titik data ( n = 41) ditunjukkan dalam grafik dan diringkas dalam kotak plot (median, persentil ke-25–75, batang kesalahan menunjukkan nilai min-maks). (E) Regresi linear yang membandingkan kelimpahan CMV-pp71 dan CMV-pp65 dalam epitel prostat ( n = 41). (F) Pelabelan bersama CMV-pp71 (hijau) dan CMV-IE1 (merah). Skala batang 25 μm. Tanda bintang memberi label inti sel dengan ekspresi protein CMV-IE1 parsial. (G) Pelabelan bersama DNA CMV (hijau) dan CMV-pp71 (merah). Skala batang 25 μm. (H) Peta panas qPCR CMV. Pengujian qPCR CMV mendeteksi DNA CMV dalam kontrol positif (DNA CMV murni) tetapi tidak dalam kontrol negatif (lini sel kanker prostat tikus MyC-CaP). Angka menunjukkan berapa banyak prostat yang positif dan dievaluasi dengan qPCR dengan atau tanpa perlakuan pendahuluan enzim restriksi Bsr1 . Tiga sampel prostat dievaluasi dalam penyaringan pengujian qPCR. Na tidak dianalisis. (I) Korelasi Pearson dari persentase sel Ki-67 + dan kelimpahan CMV-pp71 ( n = 13). Pelabelan dengan Ki-67 (hijau). Bintang menunjukkan sel epitel Ki-67 + . Skala batang: 25 μm. (J) Korelasi Pearson antara kelimpahan epitel CMV-pp71 dan usia ( n = 41). Pada (F), (G) dan (I), nukleus diberi label biru dengan DAPI dan garis putus-putus menggambarkan lamina basal epitel. CMV, Human cytomegalovirus.
Untuk melokalisasi dan mengukur kelimpahan CMV, kami menggunakan imunohistokimia (IHC) dan berfokus pada sel epitel karena mereka adalah sel asal kanker prostat dan menunjukkan tropisme CMV [ [ 9 ] ]. Kami mempelajari protein CMV IE1, US28, pp65, dan pp71, yang semuanya diekspresikan selama latensi [ [ 26 ] ] dan IE1, US28, dan pp71 memiliki fungsi terkait latensi yang mapan [ [ 25 , 45 , 46 ] ]. Keempat uji IHC CMV mengidentifikasi CMV dalam kontrol positif (Gbr. S1C ), dan tidak ada sinyal yang terdeteksi dalam uji kontrol negatif (Gbr. S1D ). Protein CMV IE1, US28, pp65, dan pp71 semuanya terdeteksi di area epitel (Gbr. 1C,D ) dengan konkordansi tinggi (Gbr. 1E ; Gbr. S1A,E ). Protein CMV yang berbeda terdeteksi bersama dalam sel epitel prostat yang sama, dan ekspresi protein CMV tidak eksklusif untuk lokasi seluler tertentu (Gbr. 1F ; Gbr. S1F ). CMV terdeteksi di prostat pada semua subjek, dengan proporsi epitel prostat yang terinfeksi berkisar antara 2% hingga 100% dengan rata-rata 46% ( n = 41, Gbr. 1D ). DNA CMV ( gen RNA2.7 ) terdeteksi di bagian jaringan dengan hibridisasi in situ dan terutama ditemukan di inti sel dan terlokalisasi ke area epitel positif protein CMV (Gbr. 1G ), yang menguatkan bahwa CMV IHC secara khusus mengidentifikasi CMV dalam sel epitel prostat.
Meskipun DNA CMV mudah dideteksi oleh PCR selama infeksi litik aktif, lebih sulit untuk menangkapnya ketika virus laten [ [ 24 , 49 ] ], mungkin terkait dengan konformasi DNA virus sirkuler yang kompleks selama latensi. Dari delapan uji qPCR CMV yang mudah mengidentifikasi DNA CMV yang dimurnikan, dua (CMV- UL32 , CMV- UL83 ) mengidentifikasi CMV dalam prostat, dikonfirmasi dengan pengurutan produk PCR (Gbr. 1H ; Gbr. S1G ). Ini juga mengidentifikasi DNA CMV dalam sel garis keturunan hematopoietik, dengan jumlah tertinggi pada donor CMV IgG + (Gbr. S1H–K ), sejalan dengan laporan sebelumnya [ [ 50 – 52 ] ], yang mendukung spesifisitas uji tersebut. CMV- UL37 terdeteksi pada prostat setelah praperlakuan DNA dengan enzim restriksi (Gbr. 1H ), yang menunjukkan bahwa fragmen DNA virus yang lebih pendek dan terlinearisasi mungkin lebih mudah diakses untuk amplifikasi PCR. Satu-satunya prostat dalam kelompok ini yang negatif dalam semua uji qPCR memiliki kelimpahan epitel CMV terendah (2%) berdasarkan IHC (Gbr. 1D,H ; Gbr. S1A ).
Dalam area epitel CMV + , baik bercak sel atau seluruh area struktur kelenjar terinfeksi (Gbr. 1C ), yang mencakup satu atau lebih subtipe epitel utama sel basal, luminal, dan neuroendokrin (Gbr. S1L ). Kelimpahan CMV berkorelasi dengan jumlah sel epitel yang positif untuk penanda proliferasi Ki-67 ( r = 0,56, P = 0,045, Gbr. 1I ) dan proporsi sel epitel yang terinfeksi CMV meningkat seiring bertambahnya usia ( r = 0,37, P = 0,016, Gbr. 1J ), mungkin mencerminkan perluasan sel yang terinfeksi CMV seiring berjalannya waktu.
Singkatnya, kami mengidentifikasi infeksi CMV pada sel epitel kelenjar prostat melalui imunoblot, IHC, hibridisasi DNA in situ , dan PCR. Berbagai protein CMV terlokalisasi bersama satu sama lain dan dengan DNA CMV, dengan klon epitel CMV + mengambil alih area prostat yang lebih luas seiring berjalannya waktu.
3.2 CMV pada kanker prostat
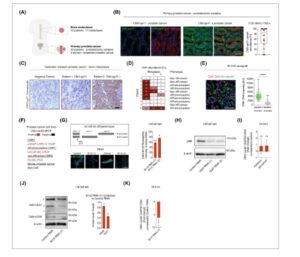
Untuk memeriksa sejauh mana sel kanker prostat terinfeksi CMV, kami menganalisis 20 tumor dalam spesimen prostatektomi dari pasien dengan kanker prostat (Gbr. 2A ; Gbr. S2A ), dua tumor insidental ditemukan postmortem pada subjek tanpa patologi prostat yang diketahui sebelumnya dan metastasis tulang dari 10 pasien dalam kohort terpisah (Gbr. 2A ). CMV dideteksi oleh CMV pp71 IHC pada 17/20 (85%) tumor primer (Gbr. 2A ), dengan 10 memiliki kelimpahan CMV yang sangat tinggi (90–100% sel kanker terinfeksi, Gbr. 2B ). Dalam sampel prostat dari tiga pasien dengan tumor primer negatif CMV, CMV juga tidak ada pada epitel jinak (Gbr. S2B ). Dalam sampel prostatektomi dengan tumor positif CMV, epitel jinak di sekitarnya juga terinfeksi CMV (Gbr. S2B ). Dari dua kanker prostat insidental pada dua donor postmortem, satu tumor adalah CMV + dan tumor lainnya adalah CMV − (Gbr. 2A ; Gbr. S2C ).
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
CMV pada kanker prostat dan lini sel kanker prostat. (A) Ilustrasi, dibuat dengan Biorender.com , dari kelompok kanker prostat. (B) Kelimpahan CMV-pp71 (hijau, %) pada tumor ( n = 20), ditentukan oleh IHC. Pan-keratin (merah) digunakan sebagai penanda untuk sel epitel jinak dan ganas. Kanker prostat diidentifikasi secara histologis di area yang digariskan oleh ahli patologi. Skala batang: 25 μm. (C, D) Metastasis tulang dari 10 pasien CRPC diperiksa untuk ekspresi protein CMV-pp71 dengan IHC. Nukleus diberi label ungu dengan hematoxylin. Skala batang: 50 μm. Fenotipe didefinisikan sebagai didorong oleh AR (MetA, aktivitas AR tinggi) dan tidak didorong oleh AR (MetB, fenotipe terdediferensiasi) [ [ 2 ] ]. Pada lima pasien, lebih dari satu metastasis diperiksa, diberi label metastasis I, II, dan III, dan persentase area CMV-pp71+ ditunjukkan dalam peta panas. x berarti tidak ada metastasis yang akan dianalisis. (E) CMV DNA FISH (merah) dalam xenograft DU145 ( n = 3). Intensitas fluoresensi dalam inti sel dalam pan-keratin + (sel epitel, di sini memberi label sel manusia, hijau) dan sel pan-keratin − (di sini memberi label sel tikus) dibandingkan dengan uji- t tidak berpasangan . AU, unit acak. Skala batang: 50 μm. Semua titik data (semua sel yang dianalisis) ditunjukkan dalam plot. (F) qPCR CMV- UL83 dalam lini sel. (G) LNCaP-abl ditransfeksi dengan IE1/2 RNAi (1) atau IE1/2 RNAi (2), menargetkan ekson 3 UL122-UL123 (ilustrasi), fluoresensi IE1/2 rata-rata berkurang (hijau) dibandingkan dengan Kontrol RNAi, dianalisis dengan uji – t satu sampel . Skala batang: 50 μm. n = 3. (H) Ekspresi Ser 807 /Ser 811 pRB dan β-aktin diperiksa dengan imunoblot ( n = 3). (I) DU145 yang diobati dengan kendaraan, maribavir 30 μ m , atau gansiklovir 100 μ m diperiksa dengan CMV- UL83 qPCR setelah 3 hari ( n = 4). Data ditampilkan sebagai perubahan lipat dibandingkan dengan kontrol dan diperiksa dengan uji-t berpasangan. (J) Imunoblot LNCaP-abl 4 hari setelah transfeksi dengan kontrol RNAi, IE1/2 RNAi (1). Ekspresi CMV-US28, CMV-UL97, dan β-aktin diperiksa, diukur ( n = 3) dan dianalisis dengan uji-t satu sampel. kDa adalah kilodalton. Isoform UL97 diberi label dengan tanda bintang. (K) Kelimpahan DNA CMV ditentukan dengan CMV- UL83 qPCR dalam DU145 4 hari setelah transfeksi dengan IE1/2 RNAi (1) dibandingkan dengan kontrol RNAi ( n = 6). Data ditampilkan sebagai perubahan lipatan negatif. Plot kotak dalam (B) dan (E) menunjukkan median; kotak persentil 25–75 dan batang galat adalah nilai maks dan min. * P < 0,05, ** P < 0,01, *** P < 0,0001, ns, tidak signifikan. Inti sel diberi label biru dengan DAPI pada (B), (E) dan (G). CMV, Human cytomegalovirus; CRPC, Kanker prostat yang resistan terhadap pengebirian; CSPC, Kanker prostat yang sensitif terhadap pengebirian; FISH = Hibridisasi fluoresensi in situ ; IHC, Imunohistokimia; IE1/2, Immediate early 1 dan 2; RNAi, Interferensi RNA.
Sel kanker prostat primer sering bermetastasis ke tempat distal seperti tulang. CMV dideteksi oleh CMV-pp71 IHC dalam metastasis tulang pada 7/10 (70%) pasien (Gbr. 2A,C,D , Gbr. S3A ). Selain itu, empat metastasis tulang yang diperiksa positif untuk CMV- UL37 qPCR. Pada lima pasien, dua hingga tiga metastasis diperiksa, dengan 9/13 (69%) metastasis CMV + yang diperiksa terinfeksi secara homogen sedangkan empat metastasis terinfeksi secara heterogen (Gbr. 2D ; Gbr. S3A ). Hasil ini menunjukkan bahwa infeksi CMV umum terjadi pada kanker prostat primer dan metastasis. Kami baru-baru ini menunjukkan bahwa kelimpahan atau seropositif CMV tidak terkait dengan skor Gleason, stadium T, atau stadium kanker prostat lanjut saat diagnosis, tetapi pasien kanker prostat seropositif CMV memiliki peningkatan risiko kematian akibat kanker prostat dan memiliki kelimpahan CMV yang tinggi pada tumor mereka [ [ 6 ] ]. Secara keseluruhan, keberadaan CMV dalam sebagian besar kanker prostat dan kaitannya dengan prognosis yang buruk menunjukkan bahwa CMV mungkin memiliki fungsi mendorong tumor dan dapat menjadi target terapi yang dapat ditindaklanjuti.
Hampir semua kanker prostat primer adalah adenokarsinoma dengan ekspresi AR dan pensinyalan androgen aktif, jalur inti pada kanker prostat yang mendorong pertumbuhan. Karena kanker prostat lanjut diobati dengan terapi anti-androgen, kanker tersebut akhirnya berkembang dari kanker prostat sensitif-kastrasi (CSPC) menjadi kanker prostat resistan-kastrasi yang mematikan (CRPC). Paling sering, pensinyalan androgen yang diaktifkan kembali mendorong CRPC, tetapi juga dapat muncul melalui mekanisme yang tidak didorong oleh AR, suatu keadaan penyakit yang ditandai dengan hasil yang lebih buruk dan lebih sedikit pilihan pengobatan [ [ 1 , 2 ] ]. Fenotipe metastasis tulang dari 10 pasien dikarakterisasi dengan analisis transkriptom [ [ 2 ] ]. Enam pasien memiliki metastasis dengan aktivitas AR tinggi (MetA) dan empat pasien memiliki fenotipe dedifferensiasi (MetB) [ [ 2 ] ]. Infeksi CMV terdapat pada metastasis tulang dari 5/6 pasien dengan MetA dan 2/4 pasien dengan MetB (Gbr. 2D ). Yang penting, hal ini menyimpulkan bahwa CMV dapat hadir pada kanker prostat stadium lanjut terlepas dari resistensi dan fenotipe pengebirian, menjadikan relevansi biologis dan terapeutiknya pada kanker prostat metastatik menarik untuk dijelajahi.
3.3 CMV pada lini sel kanker prostat dan mekanisme pemeliharaan virus
Untuk menentukan apakah CMV memengaruhi fitur-fitur yang mendorong kanker seperti viabilitas sel, proliferasi sel atau pensinyalan AR, kami beralih ke model kanker prostat. Menginfeksi sel kanker prostat dengan virion CMV yang dimurnikan mungkin tidak secara akurat meniru infeksi kanker prostat laten in vivo . Oleh karena itu, kami menyaring apakah lini sel mapan yang berasal dari pasien dengan kanker prostat lanjut terinfeksi CMV secara endogen, sehingga menawarkan sistem eksperimental alami. Kami menganalisis tujuh lini sel kanker prostat yang umum dipelajari, yang mewakili CSPC (LNCaP, LAPC-4, VCaP), CRPC yang digerakkan AR/adenokarsinoma (LNCaP-abl, LREX’), dan CPRC yang tidak digerakkan AR (DU145, PC3). Dalam sel kanker prostat DU145 yang ditanamkan pada tikus sebagai xenograft, DNA CMV terdeteksi di sebagian besar sel kanker (pan-keratin + ) dengan hibridisasi in situ dan CMV manusia, seperti yang diharapkan, tidak ada dalam sel tikus (pan-keratin − , Gambar 2E ). Khususnya, ketujuh lini sel yang dianalisis membawa CMV, seperti yang ditunjukkan dengan adanya DNA CMV- UL83 qPCR + (Gbr. 2F ), dan lini sel kanker prostat tikus MyC-CaP negatif terhadap CMV- UL83 qPCR (Gbr. 1H , 2F ). Lini sel juga positif terhadap protein CMV UL97 dan US28 (Gbr. S4A ).
Interferensi RNA (RNAi) terhadap gen CMV UL97 , US28 , dan UL122-UL123 mengurangi ekspresi protein terkait, memvalidasi keberadaannya dalam lini sel kanker prostat (Gbr. 2G , Gbr. S4B–E ), meskipun kami tidak dapat mendeteksi RNA CMV dengan RT-qPCR (Gbr. S4F S ). Untuk menguji bukti fungsional CMV dalam sel kanker prostat, kami menanyakan apakah fungsi UL97 sebagai kinase yang memfosforilasi protein Retinoblastoma (Rb) [ [ 53 ] ] dilestarikan. Khususnya, baik RNAi UL97 dan pengobatan dengan inhibitor kinase UL97 maribavir mengakibatkan berkurangnya fosforilasi Rb pada Ser 807 /Ser 811 dalam sel kanker prostat (Gbr. 2H ; Gbr. S4G ). Kami menyimpulkan bahwa infeksi CMV sangat umum terjadi pada lini sel kanker prostat, terlepas dari fenotipenya, dengan DNA virus, protein, dan aktivitas enzimatik CMV yang dapat dideteksi.
Selanjutnya kami menanyakan bagaimana CMV dipertahankan dalam sel kanker prostat. Tidak adanya RNA yang terdeteksi mengindikasikan keadaan virus laten. Infeksi aktif/litik dihambat oleh obat antivirus saat ini sedangkan infeksi laten tetap ada. Pengobatan dengan gansiklovir, yang menghambat sintesis DNA virus, dan maribavir, yang juga menghambat produksi virion, tidak mengurangi kadar DNA CMV yang diperiksa oleh qPCR dalam sel kanker prostat (Gbr. 2I ). Temuan ini menunjukkan bahwa CMV tidak dipertahankan melalui produksi virion dan infeksi ulang dan menyimpulkan bahwa infeksi tersebut laten.
Kami menanyakan bagaimana CMV laten dipertahankan dalam sel kanker prostat dan apakah CMV laten dapat dihapuskan. Lokus gen CMV UL122-UL123 yang berkarakterisasi dengan baik yang mengkode protein segera awal 1 dan 2 (IE1/2) mengatur siklus hidup virus [ [ 54 ] ] dan diperlukan untuk replikasi genom CMV laten dalam model eksperimental infeksi CMV dalam sel garis keturunan hematopoietik [ [ 25 ] ]. Kami menanyakan apakah penghambatan IE1/2 dalam sel kanker prostat CMV + dapat mengganggu infeksi laten. RNAi terhadap UL122-UL123 (IE1/2 RNAi) mengurangi kadar protein IE1/2 (Gbr. 2G ; Gbr. S4B ) serta protein CMV lainnya (Gbr. 2J ; Gbr. S4H ). Lebih jauh lagi, keberadaan DNA CMV berkurang lebih dari lima kali lipat oleh IE1/2 RNAi (Gbr. 2K ), yang membuktikan bahwa UL122-UL123 diperlukan untuk mempertahankan infeksi CMV dalam lini sel kanker prostat. Singkatnya, temuan ini memperluas fungsi UL122-UL123 yang diketahui dan menunjukkan bahwa CMV laten dapat dihilangkan dari sel yang terinfeksi dengan menargetkan jalur ini, yang menawarkan sistem eksperimental untuk mempelajari peran fungsional CMV dalam sel kanker prostat.
3.4 CMV meningkatkan kelangsungan hidup sel kanker prostat, proliferasi, dan sinyal reseptor androgen
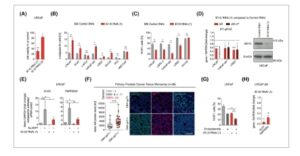
Karena kami telah menetapkan keberadaan CMV dan pengaturan eksperimental kehilangan fungsi secara in vitro dengan knockdown IE1/2, kami sekarang dapat bertanya bagaimana CMV memengaruhi fungsi seluler dalam lini sel kanker prostat. Kami menggunakan IE1/2 RNAi untuk menilai efek penghambatan CMV dalam tujuh lini sel kanker prostat CMV + yang mewakili CSPC (LNCaP, LAPC-4, VCaP), CRPC yang digerakkan oleh AR/adenokarsinoma (LNCaP-abl, LREX’), dan CRPC yang digerakkan oleh non-AR (DU145, PC3). Pengurangan CMV yang dimediasi oleh IE1/2 RNAi mengurangi viabilitas (ditentukan dengan uji CellTiter-Glo) sel kanker prostat (Gbr. 3A ; Gbr. S4I ) dan meningkatkan kadar penanda apoptosis caspase-3 terbelah dalam 5/7 (71%) dari lini sel kanker prostat yang diperiksa, terlepas dari fenotipe (Gbr. 3B ). Seperti yang diharapkan, apoptosis tidak diinduksi oleh IE1/2 RNAi dalam lini sel kanker prostat CMV − tikus MyC-CaP (Gbr. 3B ) dan juga tidak mengubah viabilitas sel dalam lini sel fibroblas manusia WI-38 (Gbr. S4J ). Kami menyimpulkan bahwa penghambatan CMV mengurangi kelangsungan hidup sel dalam model CSPC dan CRPC terlepas dari ekspresi AR.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
CMV endogen meningkatkan viabilitas sel dan ekspresi reseptor androgen pada kanker prostat. (A) Viabilitas sel, ditentukan dengan Uji Viabilitas Sel CellTiter-Glo 2.0, dalam LNCaP 4 hari setelah transfeksi dengan IE1/2 RNAi (1) ( n = 6) atau IE1/2 RNAi (2) ( n = 4) dibandingkan dengan kontrol RNAi. (B) Sel yang ditransfeksi dengan kontrol RNAi atau IE1/2 RNAi (1) dianalisis setelah 3 atau 4 hari untuk % sel caspase-3+ yang terbelah ( n = 3, kecuali untuk VCaP dan LNCaP-abl: n = 4). MyC-CaP adalah lini sel kanker prostat tikus. (C) Sel yang ditransfeksi dengan kontrol RNAi atau IE1/2 RNAi (1) dan dianalisis setelah 3 atau 4 hari untuk persentase sel Ki-67 + ( n = 3). (D) Sel yang ditransfeksi dengan kontrol RNAi atau IE1/2 RNAi (1) diperiksa untuk ekspresi gen AR dan AR-V7 dengan RT-qPCR (LNCaP, n = 3; LNCaP-abl dan LREX’, n = 4) dan ekspresi protein AR panjang penuh (AR-FL) dengan western blot 3 hari setelah transfeksi. (E) LNCaP tumbuh dalam FBS yang dilucuti arang dan ditransfeksi dengan kontrol RNAi atau IE1/2 RNAi (1) 4 hari ( n = 3). Sel diperlakukan dengan 5α-DHT 10 nm satu hari setelah ekspresi gen target AR TMPRSS2 dan KLK3 diperiksa. Batang abu-abu adalah sel yang diperlakukan dengan kontrol RNAi, dan batang merah adalah sel yang diperlakukan dengan IE1/2 RNAi (1). (F) Hubungan antara keberadaan CMV pp71 dalam sel kanker dan kadar protein AR dalam nuklei (AU; unit arbitrer) diperiksa dalam jaringan mikroarray dengan kanker prostat primer ( n = 38). Pan-keratin digunakan sebagai penanda sel epitel. Setiap titik dalam grafik adalah kadar protein AR rata-rata dari semua sel CMV pp71- (abu-abu) dalam satu tumor dan sel CMV pp71+ (merah) dalam satu tumor, dibandingkan dengan uji Mann–Whitney. Tiga sampel tidak mengandung sel tumor CMV+, 11 sampel mengandung sel tumor CMV+ dan CMV−, dan 24 sampel hanya mengandung sel tumor CMV+. Kotak diagram menunjukkan median; kotak menunjukkan persentil 25–75 dan batang galat menunjukkan nilai maks dan min. Batang skala: 100 μm. (G) Persentase sel Ki-67+ dalam LNCaP yang ditransfeksi dengan kontrol RNAi atau IE1/2 RNAi (1) dan diobati dengan pembawa atau enzalutamide 10 μ m pada hari berikutnya ( n = 3). (H) Analisis ekspresi gen dalam LNCaP-abl yang diobati dengan IE1/2 RNAi (1) dibandingkan dengan kontrol RNAi 4 hari setelah transfeksi ( n = 3). Inti sel dalam (F) diberi label biru dengan DAPI. Data dalam grafik batang ditampilkan sebagai rata-rata. Batang galat dalam grafik batang adalah SEM. Hasil RT-qPCR ditampilkan sebagai perubahan lipat dari kontrol. Kecuali dinyatakan lain, efek pengobatan diperiksa dengan uji- t berpasangan . * P < 0,05, ** P < 0,01, *** P < 0,001, ns, tidak signifikan. 5α-DHT, 5α-dihidrotestosteron; AR, Reseptor androgen; CMV, human cytomegalovirus; IE1/2, segera awal 1 dan 2; RNAi, gangguan RNA.
Berikutnya, kami menanyakan apakah CMV mendorong proliferasi sel kanker prostat. IE1/2 RNAi mengurangi proporsi sel yang positif terhadap penanda proliferasi sel Ki-67 dalam lini sel CSPC dan CRPC yang mengekspresikan AR, tetapi tidak pada CRPC yang tidak digerakkan oleh AR (Gbr. 3C ). Untuk menilai apakah CMV dapat memengaruhi pensinyalan androgen, jalur utama yang mendorong perkembangan kanker prostat, kami mentransfeksi sel CSPC dengan IE1/2 RNAi. Hal ini mengakibatkan berkurangnya ekspresi gen AR dan kadar protein AR (Gbr. 3D ), serta berkurangnya ekspresi gen yang diatur oleh androgen KLK3 dan TMPRSS2 sebagai respons terhadap 5α-dihidrotestosteron (5α-DHT) (Gbr. 3E ). Selain itu, kami menemukan bahwa sel yang terinfeksi CMV (CMV-pp71 + ) mengekspresikan kadar protein AR yang lebih tinggi daripada sel yang tidak terinfeksi (CMV pp71 − ) dalam sampel kanker prostat primer ( n = 38) (Gbr. 3F ), yang menunjukkan bahwa CMV meningkatkan kadar AR dalam sel kanker prostat juga secara in vivo . Singkatnya, temuan ini menunjukkan bahwa CMV mendorong proliferasi dan pensinyalan androgen dalam sel kanker prostat yang mengekspresikan AR.
Terapi anti-androgen adalah dasar melawan kanker prostat lanjut. Kami bertanya apakah penghambatan CMV dapat memiliki efek aditif terhadap terapi anti-androgen pada CSPC dan CRPC. Pada garis sel CSPC LNCaP, menggabungkan IE1/2 RNAi dan inhibitor AR enzalutamide lebih lanjut mengurangi proliferasi dibandingkan dengan salah satu pengobatan saja (Gbr. 3G ). Peningkatan aktivitas AR dan varian sambatan AR AR-V7 dengan ekspresi yang lebih tinggi atau perolehan mutasi fungsi merupakan ciri khas CRPC dan dapat bertindak untuk memberikan resistensi terhadap terapi anti-androgen [ [ 55 ] ]. Proses ini ditiru dalam garis sel LNCaP-abl dan LREX’. IE1/2 RNAi menurunkan kadar protein dan ekspresi AR dan AR-V7 dan gen targetnya KLK3 dan TMPRSS2 dalam model CRPC (Gbr. 3D,H ). Secara keseluruhan, temuan-temuan ini menunjukkan bahwa penghambatan CMV dapat melemahkan pensinyalan androgen pada CRPC dan menyiratkan bahwa penghambatan CMV dapat memiliki efek aditif pada senyawa farmasi yang menargetkan reseptor androgen pada kanker prostat CMV + .
3.5 Efek asiklovir pada model kanker prostat dan pada kohort populasi besar
Aciclovir dan ganciclovir adalah obat anti-virus herpes analog nukleotida yang umum dan ditoleransi dengan baik, yang keduanya diaktifkan melalui fosforilasinya oleh kinase CMV UL97 [ [ 56 , 57 ] ]. Aciclovir secara klinis digunakan sebagai pengobatan profilaksis CMV pada pasien transplantasi [ [ 58 ] ]. Sebuah studi kasus melaporkan bahwa dua pasien kanker prostat dengan herpes zoster (disebabkan oleh virus herpes varicella zoster) yang diobati selama 2 minggu dengan valaciclovir, obat pendahulu asiklovir, memperoleh penurunan yang nyata dan bertahan lama dalam antigen spesifik prostat serum [ [ 59 ] ]. Meskipun beberapa penjelasan untuk efek terkait asiklovir pada antigen spesifik prostat serum masuk akal, kami berhipotesis bahwa CMV mungkin menjadi targetnya dan digunakan untuk mengobati kanker prostat. Selain menghambat sintesis DNA virus, asiklovir yang diaktifkan dapat menghambat DNA polimerase manusia dengan afinitas rendah, yang menyebabkan kerusakan DNA dan kematian sel [ [ 60 ] ] tanpa adanya virus yang bereplikasi secara aktif (Gbr. 4A ). Demikian pula, gansiklovir yang diaktifkan dapat menyebabkan kematian sel secara in vivo [ [ 61 ] ].
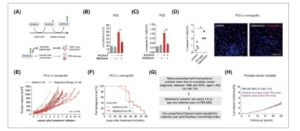
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Asiklovir pada kanker prostat. (A) Ilustrasi, dibuat dengan Biorender.com , dari aktivasi asiklovir dan mekanisme kerja asiklovir teraktivasi dan terfosforilasi (P). (B, C) Pada PC3, pengobatan maribavir (10 μ m ) mengurangi kemampuan asiklovir untuk mempromosikan fokus yH2AX ( n = 3) (B) dan untuk menginduksi apoptosis ( n = 3) (C), sebagaimana dianalisis dengan uji-t berpasangan. Batang kesalahan ditunjukkan sebagai SEM. (D) Tikus tidak diobati (kontrol, n = 4) atau diobati dengan valasiklovir ( n = 3) 17–21 hari. Apoptosis yang diinduksi asiklovir (sel caspase-3 + terbelah ) dalam xenograft PC3. Persentase sel caspase-3 + terbelah dibandingkan dengan uji- t tidak berpasangan . Batang skala: 25 μm. (E) Volume xenograft PC3 dari waktu ke waktu (minggu setelah dimulainya pengobatan) pada hewan kontrol ( n = 15) dan hewan yang diobati dengan valasiklovir ( n = 16). Analisis efek campuran pengukuran berulang digunakan untuk membandingkan volume tumor dari waktu ke waktu dan beberapa statistik perbandingan dinilai pada 6 minggu. (F) Kurva survival Kaplan–Meier yang membandingkan survival hewan kontrol ( n = 15) dan valasiklovir ( n = 16). Survival dibandingkan menggunakan uji log-rank. (G) Bagan alir desain studi kohort populasi asiklovir dan mortalitas kanker prostat. (H) Insiden kumulatif (%) mortalitas kanker prostat pada nonpengguna asiklovir (garis biru) dan pengguna asiklovir (garis merah). Area yang diarsir biru dan merah mewakili interval kepercayaan 95% (CI). HR, rasio bahaya. * P < 0,05, ** P < 0,01.
Efek antikanker dari asiklovir diuji dalam lini sel kanker prostat. Asiklovir meningkatkan jumlah fokus γH2AX per nukleus (Gbr. 4B ; Gbr. S5A ), penanda kerusakan DNA untai ganda, dan menginduksi apoptosis, sebagaimana ditentukan oleh persentase sel caspase-3 + yang terbelah , dalam enam lini sel kanker prostat (Gbr. 4C ; Gbr. S5B ). Obat terkait gansiklovir menghasilkan respons yang serupa (Gbr. S5C,D ). Respons ini dihapuskan ketika CMV-UL97 dihambat dengan maribavir, diturunkan regulasinya dengan UL97 RNAi (Gbr. 4B,C ; Gbr. S5C,E,F ) atau pada IE1/2 RNAi (Gbr. S5G ), yang menunjukkan efek asiklovir dan gansiklovir yang bergantung pada CMV dalam sel kanker prostat laten yang terinfeksi CMV. Penelitian lebih lanjut difokuskan pada asiklovir karena menunjukkan efek yang serupa dengan gansiklovir pada sel kanker prostat dan memiliki profil efek samping yang lebih ringan dibandingkan dengan asiklovir. Pengobatan dengan asiklovir selama 5 hari diikuti dengan 7 hari tanpa pengobatan meningkatkan efeknya dalam menginduksi apoptosis (Gbr. S5H,I ) yang disertai dengan peningkatan proliferasi sel (Gbr. S5J ) dan kerusakan DNA (Gbr. S5K ).
Untuk menilai efek asiklovir in vivo , tikus yang mengandung xenograft PC3 diberikan valasiklovir secara oral (25 mg·g -1 chow), yang menghasilkan konsentrasi serum asiklovir yang sebanding dengan konsentrasi terapeutik pada manusia (Gbr. S5L ) [ [ 62 , 63 ] ]. Apoptosis selektif yang diinduksi valasiklovir pada sel kanker (Gbr. 4D ; Gbr. S5M ) dan pertumbuhan tumor berkurang hingga 16%, membandingkan volume rata-rata tumor pada 6 minggu (Gbr. 4E ; P = 0,018). Valasiklovir ( n = 16) meningkatkan kelangsungan hidup (Gbr. 4F ; uji log-rank; P = 0,011) dibandingkan dengan tikus kontrol ( n = 15), dengan 31% (5/16) hewan hidup 60 hari setelah dimulainya pengobatan dibandingkan dengan 0% (0/15) kontrol (uji pasti Fisher P = 0,043). Singkatnya, asiklovir menginduksi apoptosis pada lini sel kanker prostat CMV + dan menghasilkan sedikit pengurangan pertumbuhan tumor dan peningkatan kelangsungan hidup dalam model xenotransplantasi kanker prostat.
Bahasa Indonesia : Untuk mendapatkan indikasi pertama potensi klinis asiklovir untuk mengobati kanker prostat, kami melakukan studi kohort besar yang mengevaluasi apakah pria yang diresepkan asiklovir memiliki penurunan risiko kematian akibat kanker prostat dengan menggunakan registri terkait berbasis populasi Denmark [ [ 38-41 , 64 ] ]. Karena kanker prostat umum terjadi, tumbuh lambat dan mungkin ada bertahun-tahun sebelum diagnosis, kami memeriksa risiko kematian akibat kanker prostat pada semua pria berusia 40 tahun dan lebih tua (Gbr. 4G ). Pengguna asiklovir/valasiklovir sistemik (selanjutnya disebut pengguna asiklovir; n = 156.116) dicocokkan berdasarkan usia pada resep pertama, yang didefinisikan sebagai awal tindak lanjut, dan tahun kalender untuk nonpengguna ( n = 780.580; Gbr. 4G ; Tabel S1 ). Semua pengguna asiklovir, terlepas dari jumlah resep asiklovir, disertakan. Dalam model bahaya proporsional Cox yang disesuaikan dengan usia, tahun kalender, dan indeks komorbiditas (Tabel S1 ), pengguna asiklovir memiliki angka kematian akibat kanker prostat yang lebih rendah, namun tidak signifikan secara statistik, HR yang disesuaikan 0,95 (95% CI 0,90–1,01, P = 0,09) (Gbr. 4H ).
3.6 Obat anti-CMV dapat digunakan kembali untuk melawan kanker prostat
Respons kanker prostat yang terbatas terhadap asiklovir mendorong kami untuk menyelidiki apakah obat lain terhadap CMV bisa lebih efisien. Kami mempelajari obat kemoterapi dan senyawa antivirus baru. Obat kemoterapi ellipticine dan mithramycin A, yang keduanya merupakan interkalator DNA, mengurangi replikasi genom CMV laten dalam model eksperimental [ [ 25 ] ]. Mithramycin A terkadang digunakan untuk mengobati pasien dengan kanker testis [ [ 65 ] ] dan hiperkalsemia terkait kanker [ [ 66 ] ], sedangkan ellipticine tidak digunakan secara klinis, tetapi derivatif yang lebih cocok untuk penggunaan manusia sedang dikembangkan. Protein virus sering kali multifungsi dan beroperasi baik selama latensi maupun replikasi aktif. Oleh karena itu, ada alasan rasional untuk mengevaluasi obat yang menargetkan protein CMV dalam sel kanker prostat dan memeriksa apakah ini dapat digunakan kembali. Kami meneliti obat anti-CMV baru maribavir, penghambat kinase CMV UL97, dan letermovir, penghambat CMV UL56. Kedua obat tersebut ditoleransi dengan baik dan digunakan secara klinis [ [ 67 , 68 ] ].
Garis sel kanker prostat yang merespons IE1/2 RNAi dengan apoptosis juga paling sensitif terhadap mithramycin A, ellipticine, dan maribavir, yang ditentukan dengan uji viabilitas sel (Gbr. 5A ; Gbr. S6A ). Obat-obatan ini secara drastis mengurangi viabilitas sel setelah 3–6 hari (Gbr. 5A ), menjadi lebih cepat dan lebih efisien daripada asiklovir (Gbr. S6B ). Obat-obatan tersebut menginduksi apoptosis dan mengurangi proliferasi pada garis sel yang mewakili CSPC dan CRPC (Gbr. S6C, D, E, F ) dan mengurangi ekspresi gen target AR [ [ 69 ] ] (Gbr. 5B ). Dibandingkan dengan maribavir, efek letermovir terbatas pada garis sel yang mengekspresikan AR (Gbr. 5A ). Tidak terdapat efek aditif dari IE1/2 RNAi dan ellipticine atau mithramycin A pada apoptosis atau proliferasi (Gbr. S6G,H ), maribavir dan mithramycin A juga tidak mempunyai efek aditif pada viabilitas sel (Gbr. 5C ), yang menunjukkan bahwa semuanya bekerja melalui mekanisme yang bergantung pada CMV yang sama.
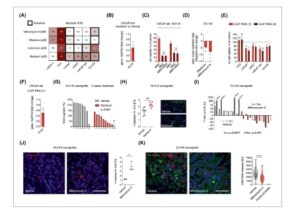
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
CMV dapat ditargetkan secara terapeutik pada kanker prostat dengan kemoterapi dan obat antivirus baru. (A) Peta panas dengan IC50 absolut dalam lini sel yang diobati dengan mithramycin A 3 hari (LNCaP, LAPC-4, n = 4; PC3, DU145, n = 5 nm ), ellipticine 3 hari ( n = 3 kecuali LNCaP, n = 4 μ m ), letermovir 6 hari ( n = 3, μ m ), atau maribavir 6 hari ( n = 3 semua lini sel kecuali LNCaP-abl, n = 4 μ m ). Kotak tebal menunjukkan lini sel yang paling sensitif terhadap obat. Warna yang lebih terang menunjukkan IC50 absolut yang lebih rendah dan karenanya sensitivitas yang lebih tinggi. Na = tidak dianalisis. (B) Ekspresi gen dalam LNCaP-abl setelah 4 hari pengobatan maribavir dibandingkan dengan pembawa ( n = 4). Data ditampilkan sebagai perubahan lipat. (C) LNCaP-abl dan DU145 diobati dengan 30 μ m maribavir (MBV), 30 n m mithramycin A (MitA) atau keduanya. Viabilitas sel diperiksa setelah 3 hari pengobatan ( n = 3). (D) Kelimpahan DNA CMV ditentukan dengan CMV- UL83 qPCR pada DU145 4 hari setelah pengobatan dengan 3 μ meliptisin atau 30 n m mithramycin A dibandingkan dengan pembawa ( n = 3). Data ditampilkan sebagai perubahan lipatan negatif. (E) Viabilitas sel, ditentukan dengan Uji Viabilitas Sel CellTiter-Glo 2.0, dievaluasi dengan uji-t satu sampel 4 hari setelah transfeksi dengan kontrol RNAi, UL97 RNAi (1) (PC3, n = 4; LNCaP, n = 6; LREX’, n = 8; LNCaP-abl, n = 6, DU145 n = 5) atau UL97 RNAi (2) (PC3, n = 4; LNCaP, n = 5; LREX’, n = 6; LNCaP-abl, n = 6, DU145 n = 4). (F) Ekspresi KLK3 diperiksa setelah pengobatan 4 hari dengan UL97 RNAi (1) dibandingkan dengan kontrol RNAi dalam LNCaP-abl ( n = 5). (G) Pertumbuhan tumor DU145 dalam persentase setelah pengobatan 2 minggu dengan pembawa atau 100 mg·kg −1 maribavir dua kali sehari. (H) Persentase sel caspase-3 + yang terbelah dalam xenograft DU145 yang diobati dengan pembawa ( n = 8) dan maribavir ( n = 6). Skala batang: 50 μm. Inti sel diberi label biru dengan DAPI. (I) Perubahan ukuran tumor dalam persentase 1 minggu (w) dan 7–8 minggu setelah pengobatan pembawa ( n = 6) atau mithramycin A ( n = 7). 1 minggu: Mann–Whitney t-tes; 0–8 minggu: Pengukuran berulang (RM) model campuran. HE = Titik akhir manusiawi (ulkus tumor: n = 2 kontrol, n = 1 mithramycin A; ditemukan mati n = 1 mithramycin A; tidak sehat n = 1 mithramycin A). (J) Persentase sel caspase-3 + yang terbelah dalam xenograft DU145 pada hewan yang diberi pembawa dan mithramycin A ( n = 3 per perlakuan, semua titik data ditunjukkan dalam grafik). Skala batang: 50 μm. Inti sel diberi label biru dengan DAPI. (K) DNA CMV diperiksa oleh CMV FISH pada tumor dan prostat tikus setelah 7–8 minggu perlakuan. Inti sel diberi label biru dengan DAPI. Pan-keratin digunakan sebagai penanda untuk sel epitel. DNA CMV dalam sel pan-keratin+, diukur dengan intensitas nuklir, dibandingkan antara tikus yang diobati dengan kendaraan ( n = 3) dan mithramycin A ( n = 3). Sel epitel yang divisualisasikan dengan DAPI dikuantifikasi dalam prostat tikus. Skala batang: 50 μm. Kotak plot menunjukkan median; kotak adalah persentil 25–75 dan batang galat menunjukkan maks dan min. Hasil RT-qPCR ditampilkan sebagai perubahan lipat dari kontrol. Uji-t Student tidak berpasangan dalam (G–H) dan (J–K). Uji- t berpasangan dilakukan dalam (B–F). Grafik batang ditampilkan dengan nilai rata-rata dan batang galat adalah SEM. * P < 0,05, ** P < 0,01, *** P < 0,001, **** P < 0,0001, ns, tidak signifikan. CMV, Human cytomegalovirus; FISH, Hibridisasi fluoresensi in situ ; RNAi, Interferensi RNA.
Kami menanyakan bagaimana mithramycin A, ellipticine, dan maribavir memberikan efeknya melalui penghambatan CMV. Mithramycin A dan ellipticine menurunkan kadar DNA CMV pada sel kanker prostat (Gbr. 5D ), sejalan dengan efek negatifnya yang diketahui pada pemeliharaan genom laten [ [ 25 ] ]. Namun, sementara mithramycin A dan ellipticine menargetkan protein SP1 dan TOPIIB bertanggung jawab atas replikasi genom laten pada sel hematopoietik, penurunan protein ini pada sel kanker prostat tidak meniru fenotipe yang diinduksi mithramycin A atau ellipticine (Gbr. S7A–E ). Mithramycin A dan ellipticine keduanya adalah interkalator DNA. Untuk memeriksa apakah obat kemoterapi lain dengan sifat yang berinteraksi dengan DNA juga merupakan inhibitor CMV, kami mengobati sel kanker prostat dengan cisplatin atau etoposide. Obat-obatan ini hanya secara mudah mengurangi viabilitas sel pada satu dari empat lini sel (Gbr. S7F ) dan etoposide tidak mengurangi kelimpahan DNA CMV (Gbr. S7G ), yang menunjukkan adanya spesifisitas terhadap mitramisin A dan elipsin.
CMV UL97 kinase belum dilaporkan sebagai pengatur latensi CMV, dan maribavir tidak mengurangi kelimpahan CMV dalam sel kanker prostat (Gbr. 2I ), mendukung peran nonesensial UL97 dalam mempertahankan latensi. Namun, temuan ini menunjukkan bahwa maribavir menargetkan pendorong utama kanker prostat karena pengobatan maribavir meniru beberapa fitur IE1/2 RNAi dan pengobatan mithramycin A atau ellipticine. Mirip dengan maribavir, menghambat protein targetnya UL97 dengan RNAi mengurangi viabilitas sel (Gbr. 5E ) dan ekspresi gen target AR (Gbr. 5F ). Temuan ini menyiratkan bahwa maribavir secara khusus menargetkan CMV dalam sel kanker prostat.
Kami menanyakan apakah mithramycin A atau maribavir dapat memengaruhi sel kanker prostat dalam model xenograft pada tikus. Tikus dengan xenograft DU145 yang sudah terbentuk diberi 100 mg·kg −1 maribavir ( n = 10) atau pembawa ( n = 8) dua kali sehari setiap hari kerja. Meskipun hewan kehilangan berat badan pada minggu pertama pengobatan maribavir, berat badan mereka kemudian stabil dan tetap stabil selama sisa periode pengobatan (Gbr. S8A ), tetapi pengobatan berkelanjutan selama lebih dari 3,5 minggu tidak ditoleransi dengan baik. Sejalan dengan hasil in vitro (Gbr. S6F ), maribavir tidak mengubah jumlah sel yang berproliferasi dalam xenograft DU145 (Gbr. S8B ). Pertumbuhan tumor berkurang pada tikus yang diobati dengan maribavir yang diperiksa setelah 2 minggu (Gbr. 5G ). Pengurangan pertumbuhan tumor yang diinduksi maribavir disertai dengan peningkatan aktivitas apoptosis pada tumor (Gbr. 5H ). Mithramycin A menyebabkan penyusutan xenograft sel DU145 setelah 7 hari pengobatan yang bertahan selama periode 8 minggu (Gbr. 5I ), menunjukkan tanda-tanda apoptosis aktif (Gbr. 5J ) [ [ 70 ] ], dan mengurangi kelimpahan genom CMV (Gbr. 5K ). Singkatnya, hasil ini menunjukkan bahwa obat yang ditargetkan CMV seperti mithramycin A dan maribavir memiliki potensi manfaat klinis terhadap kanker prostat.
4 Diskusi
Di sini kami melaporkan bahwa infeksi CMV sangat umum terjadi pada epitel prostat yang sehat dan ganas. Dari tujuh lini sel kanker prostat yang umum dipelajari, semuanya terinfeksi CMV. Semua bukti menunjukkan keadaan virus laten yang persisten dalam sel prostat di mana protein virus diekspresikan dan berfungsi tetapi virion tidak diproduksi, sejalan dengan paradigma saat ini tentang latensi CMV dalam tipe sel lain. Kelimpahan CMV dapat dikurangi secara drastis oleh CMV-IE1/2 RNAi dan oleh beberapa senyawa farmasi, yang memungkinkan kami untuk mempelajari peran fungsional CMV dalam model kanker prostat. CMV meningkatkan proliferasi, kelangsungan hidup sel, dan pensinyalan androgen dalam lini sel kanker prostat yang sensitif dan resisten terhadap pengebirian. Kelimpahan CMV dalam epitel prostat meningkat seiring bertambahnya usia, dan sel kanker prostat CMV + memiliki kadar protein AR yang lebih tinggi dibandingkan dengan sel kanker yang tidak terinfeksi, temuan yang menunjukkan bahwa efek CMV yang kami identifikasi secara in vitro juga beroperasi pada manusia secara in vivo . Asiklovir menunjukkan efek yang sederhana pada pertumbuhan tumor dalam model praklinis, dan penggunaan asiklovir dalam praktik klinis tidak dikaitkan dengan penurunan mortalitas kanker prostat secara signifikan pada dosis dan durasi yang diteliti. Obat kemoterapi lama seperti mitramisin A dan obat CMV baru termasuk penghambat CMV-UL97 maribavir memiliki efek yang lebih nyata pada viabilitas sel pada sel kanker prostat yang bergantung pada CMV. Hasil ini mendorong penyelidikan terhadap penggunaan klinis obat anti-CMV seperti mitramisin A dan maribavir untuk pengobatan kanker prostat.
Kehadiran, karakteristik, dan peran CMV dalam jaringan dan penyakit seperti kanker menantang untuk dipelajari dan telah menghambat kemajuan [ [ 31 ] ], paling tidak karena ketidakkonsistenan dalam teknik deteksi virus. Secara luas diterima bahwa sel-sel dari garis keturunan hematopoietik terinfeksi oleh CMV, meskipun RNA CMV sulit dideteksi pada infeksi CMV kronis [ [ 24 , 26 , 29 , 49 ] ]. Ekspresi gen virus selama latensi juga tidak dapat dideteksi dalam sel-sel tumor yang terinfeksi virus papiloma manusia [ [ 71 ] ], menunjukkan bahwa mekanisme umum regulasi ekspresi gen mungkin ada untuk beberapa virus DNA. Kehadiran dan lokalisasi seluler protein virus jarang dinilai dalam sel yang terinfeksi CMV endogen selama latensi, dan pengetahuan tentang protein CMV oleh karena itu sangat bergantung pada eksperimen in vitro . Protein IE CMV secara klasik dipandang sebagai protein nuklir selama replikasi aktif tanpa ekspresi selama latensi. Namun, paradigma saat ini menyatakan bahwa beragam gen CMV, termasuk gen IE, memang dapat diekspresikan selama latensi [ [ 26 ] ], meskipun pada tingkat yang lebih rendah. Protein virus dapat memiliki fungsi yang berbeda tergantung pada keadaan virus dan seluler, dan lokalisasi seluler spesifik juga dapat berbeda, seperti yang dicontohkan dengan CMV pp71 [ [ 46 ] ]. Dalam penelitian ini, protein IE tidak secara eksklusif diekspresikan dalam inti sel, suatu fenotipe yang juga telah dijelaskan dalam jenis kanker lainnya. Temuan ini menjamin eksplorasi lebih lanjut dari ekspresi protein CMV dalam latensi, seperti sel-sel garis keturunan hematopoietik, dan fungsi protein spesifik kompartemen sel. Deteksi CMV yang koheren dengan beberapa antibodi dan dengan DNA CMV, memperkuat kesimpulan kami tentang keberadaan CMV umum dalam epitel prostat dan juga menyiratkan bahwa bias deteksi karena variasi dalam strain atau mutasi CMV dapat diabaikan.
Umumnya, bercak sel epitel, dan bukan sel tunggal, positif CMV, menunjukkan klon seluler atau hotspot untuk infeksi ulang CMV. Jika CMV bereplikasi secara aktif dan umumnya menginfeksi sel-sel tetangga, lisis sel dan respons inflamasi akan diharapkan. Kurangnya temuan ini [ [ 6 ] ] menyiratkan bahwa CMV bertahan dalam sel epitel melalui mekanisme lain, seperti replikasi genom virus laten dan penerusannya ke sel anak. Gagasan bahwa CMV mungkin tidak bereplikasi secara aktif dalam sel yang ditransformasi [ [ 72 ] ] berbicara untuk paradigma ini. Kelompok donor postmortem kami memungkinkan kami untuk secara menyeluruh mengatasi keberadaan CMV dengan berbagai metode, tetapi berpotensi memperkenalkan bias deteksi. Virus varicella zoster dapat mengaktifkan kembali postmortem [ [ 73 ] ], tetapi tidak jelas apakah fenomena ini terjadi dengan CMV. Tidak adanya korelasi antara interval postmortem dan tingkat protein CMV pada prostat serta rendahnya deteksi DNA CMV postmortem [ [ 74 ] ] menunjukkan bahwa virus tersebut mungkin tidak akan aktif kembali dalam kondisi ini.
Mayoritas lini sel kanker prostat yang dianalisis bergantung pada CMV endogen untuk kelangsungan hidup sel, mengingatkan pada kecanduan onkogen seperti MYC, protein yang, mirip dengan virus laten, meningkatkan penghindaran imun [ [ 75 ] ]. CMV, dengan sekitar 700 kerangka baca terbuka [ [ 76 ] ], dapat mengubah banyak proses seluler, termasuk yang meningkatkan kelangsungan hidup dan proliferasi sel, agar replikasi dan penyebaran virus dapat berlangsung [ [ 11 ] ]. Dalam model eksperimental, CMV dapat meningkatkan tumorigenesis [ [ 77 ] ] dan meningkatkan perkembangan tumor pada kanker yang sudah terbentuk [ [ 78 ] ], tetapi generalisasi dari temuan ini tidak jelas, karena konsekuensi seluler dari ekspresi dan fungsi protein CMV mungkin berbeda dalam keadaan virus kronis atau laten. Oleh karena itu, penting untuk mempelajari efek virus pada kanker dalam konteks yang tepat dalam keadaan infeksi alaminya, seperti dalam penelitian ini. CMV, di antara keganasan lainnya, telah diusulkan untuk menginfeksi glioblastoma, dan gangguan IE1/2 pada sel induk glioblastoma yang terinfeksi CMV secara endogen mengurangi viabilitas sel [ [ 44 ] ], mungkin menunjukkan fungsi bersama CMV pada beberapa jenis tumor. Dalam penelitian kami, pengurangan CMV-IE1/2 pada sel kanker prostat mengakibatkan pelemahan DNA CMV, dan oleh karena itu tidak pasti apakah protein IE1/2 sendiri bertindak untuk mempertahankan viabilitas sel. Fenotipe pelemahan CMV hanya sebagian ditiru oleh penghambatan UL97, yang menunjukkan bahwa lebih banyak gen CMV yang berperan.
Garis sel dirancang untuk diwariskan beberapa kali dan mungkin berbeda dari fenotipe aslinya secara in vivo , yang juga dapat terjadi pada CMV, yang menyebabkan keterbatasan potensial dalam generalisasi temuan kami. Model ex vivo lain yang lebih mirip dengan sifat in vivo , seperti xenograft dan organoid yang berasal dari pasien, merupakan model yang menarik untuk dieksplorasi lebih lanjut.
Merkel cell polyomavirus adalah virus onkogenik, dan sel karsinoma sel Merkel bergantung pada ekspresi onkogen virus secara in vitro [ [ 79 ] ]. Meskipun sel kanker prostat mungkin memerlukan CMV untuk bertahan hidup, seseorang tidak dapat melabeli CMV sebagai virus onkogenik. Misalnya, CMV tidak penting untuk tumorigenesis prostat karena tumor CMV − dan sebagian tumor CMV − dapat muncul. Lebih jauh, tidak ada hubungan antara seropositif CMV dan risiko kanker prostat [ [ 6 ] ]. Selain itu, kanker yang disebabkan oleh virus sering kali cenderung muncul setelah imunosupresi, tetapi tidak ada hubungan seperti itu yang ditemukan untuk kanker prostat [ [ 80 ] ]. Sebaliknya, seseorang dapat melabeli CMV sebagai virus onko-modulasi, menjadikan CMV target obat yang menarik untuk kanker yang sudah mapan, bahkan pada stadium lanjut.
Selain kelangsungan hidup sel, CMV mempromosikan proliferasi. CMV memengaruhi pensinyalan AR, jalur pro-proliferasi yang dikenal pada kanker prostat dengan mempromosikan ekspresi gen AR . Penghambatan UL97 mengurangi ekspresi gen target AR, tetapi gen CMV lainnya juga dapat menjadi pengatur AR. Banyak yang diketahui tentang kofaktor dan pengatur hulu yang mendorong pensinyalan AR, tetapi penelitian lebih lanjut diperlukan untuk menjelaskan mekanisme pensinyalan AR yang didorong CMV. Mekanisme pro-proliferatif potensial lainnya dari CMV dapat melalui fosforilasi dan inaktivasi Rb oleh UL97 (Gbr. 2E ) [ [ 53 ] ], karena Rb aktif umumnya mengikat E2F yang mengakibatkan penghambatan siklus sel. Persentase sel dalam siklus sel tidak diubah oleh penghambatan CMV pada sel Rb rendah DU145, mendukung hipotesis ini. Tetapi regulasi dan fungsi Rb pada kanker prostat rumit dan hilangnya fungsi lebih umum terjadi ketika penyakit sudah lanjut, tidak mungkin semata-mata dikaitkan dengan CMV.
Yang penting, beberapa metode penghambatan CMV mengurangi viabilitas sel dalam model CRPC, suatu kondisi penyakit dengan pilihan pengobatan terbatas. Banyak mekanisme resistensi telah dijelaskan, termasuk mutasi AR, peningkatan regulasi AR atau AR-V7 , dan peralihan garis keturunan dari adenokarsinoma ke keadaan sel basal/neuroendokrin androgen acuh tak acuh [ [ 55 ] ]. CMV hadir dalam beberapa fenotipe kanker prostat lanjut secara in vitro dan in vivo , yang menyiratkan bahwa CMV tidak cukup untuk mendorong komitmen garis keturunan sel kanker. Dalam CRPC dengan aktivitas AR tinggi, penghambatan CMV menurunkan ekspresi AR dan AR-V7 , suatu fungsi yang dapat dimanfaatkan secara terapeutik. Karena peningkatan regulasi AR dan AR-V7 dikaitkan dengan perkembangan resistensi pengobatan, data ini menimbulkan pertanyaan apakah CMV berpotensi memperburuk resistensi antiandrogen.
Meskipun asiklovir menyebabkan kerusakan DNA dan apoptosis yang bergantung pada CMV secara in vitro , efek in vivo cukup sederhana dalam model xenograft, dan kami tidak menemukan hubungan antara penggunaan (val)asiklovir sistemik dan mortalitas kanker prostat. Tidak mungkin untuk menyimpulkan kausalitas dari studi observasional kami, dan desain studi yang digunakan rentan terhadap bias seperti pengganggu berdasarkan indikasi. Meskipun hasil kami menentang aktivitas klinis asiklovir, kami berspekulasi bahwa efek asiklovir potensial mungkin paling nyata pada pria seropositif CMV. Mengidentifikasi kemungkinan superresponder, mengeksplorasi waktu dan durasi pengobatan, skema dosis, dan terapi kombinasi akan menjadi penting untuk mengevaluasi lebih lanjut kemungkinan manfaat klinis.
Obat antivirus baru letermovir dan maribavir memiliki efek yang lebih substansial pada viabilitas sel kanker prostat daripada asiklovir pada dosis terapeutik, dengan maribavir memiliki efek terluas. Mithramycin A paling dekat meniru kehilangan CMV eksperimental, tetapi toksisitas sistemik menghambat penggunaan klinis umum. Analog mithramycin A yang lebih ringan dan sistem penghantaran obat baru berpotensi digunakan untuk mengatasi kendala ini. Beberapa virus lain yang menginfeksi dan mempromosikan kanker belum dapat dengan mudah ditargetkan dengan terapi antivirus, karena sifat latennya. Di sini kami menunjukkan bahwa adalah mungkin untuk menargetkan virus DNA endogen sebagai terapi kanker. Bahwa seropositif CMV pada pasien kanker prostat dikaitkan dengan peningkatan mortalitas [ [ 6 ] ] dan demonstrasi kami di sini bahwa CMV mempromosikan jalur inti kanker prostat dan bahwa penghambatannya mengurangi pertumbuhan tumor, memotivasi studi tentang potensi manfaat terapi anti-CMV untuk memperpanjang hidup pasien kanker prostat.
5 Kesimpulan
Kami menyimpulkan bahwa infeksi CMV umum terjadi pada kanker prostat dan berpotensi menyebar luas. Penghambatan CMV mengurangi viabilitas sel kanker prostat, dan beberapa strategi pengobatan potensial dengan menargetkan CMV diusulkan.

