
Abstrak
Optimalisasi dosis onkologi selama era kemoterapi difokuskan pada identifikasi dosis maksimum yang dapat ditoleransi (MTD) untuk uji coba registrasi, yang sering kali mengakibatkan toksisitas yang signifikan. Munculnya obat-obatan yang ditargetkan secara molekuler dan imunoterapi menawarkan potensi untuk mencapai kemanjuran yang sama dengan dosis yang lebih rendah dan efek samping yang lebih sedikit, karena kemanjuran maksimal sering kali dicapai pada dosis di bawah MTD. Panduan FDA terkini menguraikan harapan untuk meningkatkan optimalisasi dosis dalam pengembangan obat onkologi. Tinjauan ini menyajikan kerangka kerja untuk optimalisasi dosis yang disesuaikan dengan mengkategorikan molekul onkologi ke dalam empat kelas berbeda berdasarkan mekanisme aksi dan aktivitas klinisnya: terapi target molekul kecil dan konjugat obat antibodi (Kelas 1), antagonis molekul besar (Kelas 2), agonis imunoterapi kanker (Kelas 3), dan molekul dengan aktivitas agen tunggal yang terbatas atau tidak ada (Kelas 4). Pertimbangan optimalisasi dosis yang unik untuk setiap kelas dibahas, didukung oleh contoh kasus ilustratif. Untuk meningkatkan pengambilan keputusan dosis yang kuat dan mengoptimalkan pemanfaatan sumber daya pasien, kami mengusulkan penggunaan bukti aktivitas sebagai gerbang untuk memulai perluasan dosis dengan satu atau beberapa tingkat dosis. Tinjauan ini menekankan pentingnya mengintegrasikan semua data praklinis yang relevan, pengetahuan penyakit, dan pengukuran klinis serta menyoroti peran penting farmakologi kuantitatif dan pemodelan statistik dalam mengoptimalkan dosis.
Selama era kemoterapi, optimalisasi dosis onkologi difokuskan pada identifikasi dosis maksimum yang dapat ditoleransi (MTD) untuk uji coba registrasi, yang sering kali disertai toksisitas tambahan bagi pasien. Perawatan yang lebih baru, seperti obat target molekuler dan imunoterapi, sering kali mencapai kemanjuran maksimal pada dosis di bawah MTD, sehingga memungkinkan dosis yang lebih rendah dengan efektivitas yang sama dan efek samping yang lebih sedikit. 1 , 2 Dosis yang terlalu tinggi dapat berdampak negatif pada kualitas hidup pasien, yang menyebabkan modifikasi dosis atau penghentian, yang pada akhirnya memengaruhi kemampuan pasien untuk menerima terapi. Dosis yang optimal menemukan keseimbangan antara memastikan obat tersebut efektif, sekaligus aman dan dapat ditoleransi bagi pasien dalam perawatan jangka panjang. Otoritas kesehatan, termasuk FDA dan EMA, menganjurkan reformasi dalam optimalisasi dosis untuk obat onkologi, dengan panduan FDA yang menguraikan harapan umum. 3 , 4 Banyak publikasi menganjurkan pendekatan kasus per kasus untuk optimalisasi dosis, dengan mengakui kompleksitas multidimensi pengembangan obat onkologi. 5 , 6
Meskipun ada upaya yang sedang berlangsung, pengembang obat sering menghadapi tantangan dalam merancang strategi optimasi dosis untuk molekul baru dan menyerukan solusi nyata untuk mengatasi kesenjangan ini. Makalah ini bertujuan untuk menyediakan kerangka kerja optimasi dosis yang disesuaikan sebagai landasan untuk mengembangkan solusi praktis. Kami mengusulkan mengkategorikan molekul onkologi ke dalam empat kelas berbeda berdasarkan mekanisme aksi (MOA) dan aktivitas klinisnya: terapi target molekul kecil (SM) dan konjugat obat antibodi (ADC) (Kelas 1), antagonis molekul besar (Kelas 2), agonis imunoterapi kanker (Kelas 3), dan molekul dengan aktivitas agen tunggal yang terbatas atau tidak ada (Kelas 4) ( Gambar 1 ). Pertimbangan optimasi dosis yang unik untuk setiap kelas dalam indikasi awal dibahas, didukung oleh contoh kasus ilustratif. Modalitas baru yang muncul, seperti terapi sel dan vaksin kanker, dikecualikan karena mungkin memerlukan pendekatan yang berbeda.
 Gambar 1
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Kelas molekul berdasarkan mekanisme aksi dan aktivitas klinisnya. ADC, konjugat antibodi-obat.
PERTIMBANGAN UMUM PENGEMBANGAN KLINIS UNTUK OPTIMASI DOSIS ONKOLOGI
Optimasi dosis mencakup rencana holistik yang mencakup semua tahap pengembangan obat. Ini termasuk mengintegrasikan hasil dari studi praklinis, uji coba Fase I pertama pada manusia yang melibatkan pengaturan dosis dan perluasan dosis, dan berlanjut melalui inisiasi uji coba registrasi pertama dalam indikasi klinis awal ( Gambar 2 ). Dua tonggak penting dalam pengembangan klinis mencakup bukti aktivitas (POA) dan bukti konsep (POC) ( Gambar 2 ). POC didefinisikan sebagai pemenuhan target keamanan dan kemanjuran yang telah ditetapkan sebelumnya jika dibandingkan dengan standar perawatan (SOC). Kriteria ini sering kali berfungsi sebagai gerbang untuk memulai uji coba registrasi. Sebaliknya, POA didefinisikan dalam tinjauan ini sebagai menunjukkan aktivitas antitumor yang dapat diukur secara klinis (misalnya, respons tumor, pengurangan ukuran tumor, pengurangan PSA atau protein M, pembersihan ct-DNA), yang bergantung pada molekul, pengaturan penyakit, dan/atau tujuan pengembangan. Di sini, kami mengusulkan untuk menggunakan POA guna mengendalikan keputusan untuk memajukan pengembangan dari fase “penentuan dosis” (peningkatan/pengisian ulang dosis) ke fase “ekspansi dosis” (ekspansi dosis dengan satu atau beberapa tingkat dosis, yang berpotensi diacak).
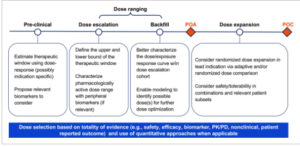 Gambar 2
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Pertimbangan utama pengembangan klinis untuk pengoptimalan dosis pada indikasi onkologi awal. POA, bukti aktivitas; POC, bukti konsep.
Studi praklinis menjadi dasar untuk tahap awal pemberian dosis pada manusia dan membantu mengidentifikasi potensi risiko keamanan dan biomarker farmakodinamik (PD) yang relevan, yang menjadi kunci penilaian klinis. Oleh karena itu, sangat penting untuk mempertimbangkan secara saksama perubahan praklinis ke klinis dari farmakokinetik dan farmakodinamik (PK-PD), toksisitas, dan efikasi untuk memperkirakan jendela terapi dengan lebih baik.
Studi Fase I awal (fase penentuan rentang dosis [yaitu, kohort eskalasi dosis dan pengisian ulang]) dirancang untuk memperkirakan batas atas (yaitu, dosis maksimal yang dapat ditoleransi atau diberikan untuk mendapatkan informasi paparan/keselamatan) dan batas bawah (yaitu, dosis aktif farmakologis minimal) dari rentang dosis terapeutik dan aktif farmakologis, sambil menentukan keamanan dan tolerabilitas yang dapat diterima ( Gambar 2 ). Biomarker PD perifer dan/atau terkait tumor membantu dalam menunjukkan bukti mekanisme (POM) dan mengkarakterisasi rentang dosis aktif farmakologis. Selain itu, pengisian ulang kohort dosis dengan populasi yang lebih homogen (yaitu, jenis tumor tertentu atau pasien yang dipilih biomarker) dapat dipertimbangkan untuk menghasilkan bukti tambahan POA ( Gambar 2 ).
Untuk molekul dengan aktivitas agen tunggal, POA diharapkan terbentuk selama fase penentuan dosis. Setelah POA terbentuk, pemilihan dosis dapat dicapai melalui perluasan dosis tunggal atau ganda pada populasi pasien tertentu ( Gambar 2 ). Ketika lebih dari satu dosis dipertimbangkan, kohort perbandingan dosis acak dapat digunakan untuk mengendalikan bias seleksi dan potensi faktor pengganggu. Kohort ini biasanya tidak berdaya untuk menunjukkan perbedaan yang signifikan secara statistik dalam kemanjuran atau keamanan antara tingkat dosis, yang juga sejalan dengan panduan FDA. 3 Meskipun demikian, kohort ini harus memberikan bukti yang cukup untuk mendukung dosis Fase II atau III yang direkomendasikan, berdasarkan penilaian kuantitatif dan kualitatif dari data klinis yang dikumpulkan.
Untuk lebih mendefinisikan keamanan dan tolerabilitas, rekomendasi terkini dari lintas industri menganjurkan penggabungan hasil yang dilaporkan pasien (PRO) ke dalam studi Fase I awal untuk menilai tolerabilitas dan toksisitas simptomatik. 7 Mengecualikan PRO dari Fase I dapat mengakibatkan kegagalan dalam memahami perspektif pasien mengenai tolerabilitas. 7 Oleh karena itu, penyertaan PRO dalam fase penentuan rentang dosis dan perluasan dosis uji klinis Fase I dan II harus dipertimbangkan.
Secara keseluruhan, keputusan dosis harus didasarkan pada totalitas bukti (misalnya keamanan, kemanjuran, biomarker, PK/PD, nonklinis, dan PRO), yang melibatkan perencanaan strategis untuk menghasilkan dan mengintegrasikan secara kuantitatif data translasi dan klinis yang relevan 8 ( Gambar 2 ).
KELAS MOLEKUL PERTIMBANGAN UNIK UNTUK OPTIMASI DOSIS
Kelas 1: Terapi target molekul kecil dan konjugat obat antibodi
Kelas 1 terdiri dari terapi target SM dan ADC (misalnya, asciminib, sotorasib, trastuzumab deruxtecan). Molekul-molekul ini terutama memodulasi jalur onkogenik yang berbeda atau menargetkan antigen permukaan pada sel kanker dengan selektivitas tinggi. Ketersediaan model in vitro atau hewan prediktif biasanya menghasilkan penerjemahan efikasi yang lebih baik dari data praklinis ke manusia dibandingkan dengan kelas 9 lainnya ( Gambar 3 ). Kisaran dosis target yang berkhasiat sering kali dapat diproyeksikan dari data ini untuk menginformasikan strategi peningkatan dosis. Namun, jendela terapeutik untuk Kelas 1 cenderung lebih sempit daripada Kelas 2 (antagonis molekul besar), yang dikaitkan dengan potensi efek di luar target atau toksisitas pada target dan di luar tumor yang terkait dengan SM dan ADC. 2 Analisis persetujuan awal FDA untuk terapi target SM atau ADC dari tahun 2019 hingga 2021 mengungkapkan modifikasi dosis yang sering terjadi pada dosis yang direkomendasikan, 10 yang menggarisbawahi perlunya mengkarakterisasi toksisitas awal dan akhir serta tolerabilitas pasien, sebagaimana dinilai oleh PRO. SM/ADC Kelas 1 adalah terapi target yang biasanya ditujukan untuk populasi pasien tertentu (misalnya, pasien dengan mutasi KRAS G12C untuk sotorasib, atau mereka dengan tumor HER2+ untuk trastuzumab deruxtecan). Dengan demikian, studi penentuan dosis pada populasi pasien tertentu dapat dipertimbangkan untuk molekul Kelas 1.
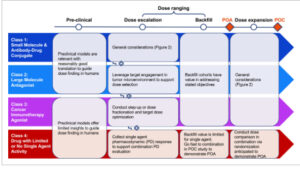 Gambar 3
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Pertimbangan pengembangan klinis yang unik untuk pengoptimalan dosis di seluruh kelas molekuler. POA, bukti aktivitas; POC, bukti konsep.
Asciminib: Penentuan dosis berdasarkan farmakologi praklinis
Asciminib adalah penghambat tirosin kinase SM alosterik yang menunjukkan aktivitas ampuh terhadap BCR-ABL1 tipe liar (WT) dan bermutasi, termasuk mutan T315I. Studi praklinis menunjukkan bahwa asciminib kira-kira 4 hingga 13 kali lebih ampuh terhadap tumor WT daripada tumor yang mengandung mutasi T315I, yang menunjukkan paparan asciminib yang lebih tinggi diperlukan untuk mencapai aktivitas anti-tumor pada tumor yang mengandung mutasi T315I. Berdasarkan temuan farmakologi praklinis ini, Sponsor melakukan studi Fase I dengan dua eskalasi dan ekspansi dosis terpisah untuk pasien WT dan pasien mutan T315I, yang menginformasikan dosis yang digunakan dalam studi penting atau kohort masing-masing. 11 FDA menyetujui asciminib dengan dosis berbeda untuk populasi WT (40 mg BID atau 80 mg QD) dan mutan T315I (200 mg BID). 12 Asciminib menggambarkan pertimbangan penentuan dosis yang unik untuk kelas ini; khususnya, pertimbangan serupa telah dilaporkan untuk banyak ADC. 13
Kelas 2: Antagonis molekul besar
Kelas 2 mencakup molekul besar dengan aktivitas antagonis (misalnya, antibodi monoklonal [mAb]: pembrolizumab dan isatuximab). Molekul Kelas 2 biasanya mengikat antigen targetnya dengan spesifisitas tinggi dan sering dikaitkan dengan risiko efek toksik yang lebih rendah di luar target, kecuali untuk reaksi yang dimediasi imun untuk imunoterapi. Dibandingkan dengan Kelas 1, molekul Kelas 2 sering menunjukkan jendela terapeutik yang lebih luas. Antara tahun 2000 dan 2013, dari 82 uji klinis pertama pada manusia yang melibatkan antibodi monoklonal (mAb), 69 penelitian (84%) tidak mencapai dosis maksimum yang dapat ditoleransi (MTD). Dalam banyak kasus, dosis Fase II yang direkomendasikan (RP2D) ditentukan tanpa adanya atau terlepas dari MTD. 14 Akibatnya, penting untuk memanfaatkan data farmakologi praklinis, PK klinis dan PD, bukan MTD, untuk memandu pemilihan dosis. Untuk molekul dengan MOA baru, sering kali sulit untuk menggunakan penanda jalur PD untuk mendukung pemilihan dosis karena kurangnya pemahaman tentang relevansi klinis dari biomarker ini. Mengingat efek farmakologis molekul Kelas 2 terutama didorong melalui pengikatan antigen target, saturasi pengikatan target di tempat kerja (yaitu, tumor) dapat digunakan sebagai pengganti untuk saturasi farmakologis (yaitu, efek maksimal pada pensinyalan hilir) ( Gambar 3 ). Peningkatan dosis jauh di atas saturasi target tumor mungkin tidak diperlukan karena tidak mungkin memberikan aktivitas antitumor tambahan dan dapat menyebabkan peningkatan toksisitas. Mengingat peringatan ini, tolerabilitas jangka panjang, selain keamanan akut, perlu dipertimbangkan sebelum memutuskan dosis optimal.
Pembrolizumab: Pemilihan dosis yang dipandu oleh keterlibatan target intratumoral
Pembrolizumab adalah anti-PD-1 humanized mAb yang sangat selektif, yang disetujui untuk lebih dari 40 indikasi onkologi di seluruh dunia. Strategi pemilihan dosis pragmatis diadopsi dengan memanfaatkan keterlibatan target intratumoral bersama dengan perbandingan dosis acak untuk memilih RP2D pembrolizumab. 15 RP2D diperkirakan berdasarkan data PK Fase I dan saturasi target PD-1 intratumoral, yang merupakan pengganti untuk efek farmakologis maksimal untuk mAb antagonis. Mengingat tantangan dan keterbatasan yang terkait dengan pengukuran keterlibatan target intratumoral, model PK berbasis fisiologis (PBPK) dikembangkan untuk memprediksi keterlibatan target intratumoral. RP2D diperkirakan sebesar 200 mg setiap 3 minggu, di mana saturasi PD-1 diprediksi akan tercapai dalam tumor dan sirkulasi sistemik. 15 Ketepatan RP2D yang diprediksi dikonfirmasi oleh studi perbandingan dosis acak, yang menunjukkan kemanjuran serupa pada RP2D yang diproyeksikan dan pada dosis yang lebih tinggi dengan paparan PK yang tidak tumpang tindih (yaitu, dosis/paparan 5 kali lebih tinggi). 15
Kelas 3: Agonis imunoterapi kanker
Kelas 3 mencakup molekul dengan aktivitas agonis imunoterapi kanker, termasuk pengikat sel T (TCE, misalnya, teclistamab dan mosunetuzumab) dan imunositokin (misalnya, aldesleukin). 16 Translatabilitas klinis model praklinis terbatas karena kompleksitas sistem imun manusia tidak sepenuhnya terwakili dalam model ini. Oleh karena itu, sedikit wawasan dapat dihasilkan dari data praklinis untuk optimasi dosis untuk Kelas 3 dibandingkan dengan Kelas 1. 9 Merancang rejimen dosis yang optimal merupakan tantangan untuk Kelas 3 karena mode aksi agonis yang dibedakan dan strategi mitigasi yang berbeda untuk toksisitas akut, yang perlu dipertimbangkan untuk meningkatkan jendela terapeutik. Selain itu, hubungan efikasi berbentuk lonceng secara teoritis dimungkinkan untuk TCE, yang dapat membuat proses optimasi dosis lebih rumit 17 Khususnya, sindrom pelepasan sitokin (CRS) adalah kejadian buruk (AE) yang umum terjadi pada target yang menjadi perhatian untuk TCE, yang terjadi secara akut setelah siklus pertama dan menghilang seiring waktu. Mengingat ketergantungan waktu yang unik dari CRS, penerapan dosis bertahap (yaitu, memberikan satu atau lebih dosis tambahan sebelum dosis target) dapat meredam pelepasan sitokin dengan setiap langkah berikutnya, yang memungkinkan dosis target yang lebih tinggi tercapai dan menghasilkan efikasi yang lebih baik. 17 Demikian pula, untuk imunositokin, membagi dosis besar menjadi beberapa dosis kecil dari waktu ke waktu sering dianggap dapat mengurangi risiko toksisitas yang disebabkan oleh Cmax. Akibatnya, setiap dosis yang digunakan dalam pendekatan dosis terfraksinasi atau bertahap mungkin memerlukan pengoptimalan selama fase penentuan rentang dosis ( Gambar 3 ). Yang pertama bertujuan untuk mengidentifikasi rejimen dosis bertahap yang optimal atau skema fraksinasi dosis. Yang kedua berfokus pada pendefinisian dosis target yang optimal untuk memastikan keseimbangan yang tepat dalam menentukan manfaat–risiko. Mengingat MOA yang kompleks dan keterbatasan data praklinis, pendekatan pemodelan farmakologi mekanistik (misalnya, PK/PD atau QSP) telah semakin banyak diterapkan untuk mendukung pengoptimalan dosis untuk kelas molekul ini. 17 , 18
Mosunetuzumab: Eskalasi dosis yang dipandu model (peningkatan dosis dan pengoptimalan target)
Mosunetuzumab, antibodi bispesifik pengikat sel T anti-CD20/CD3, disetujui untuk mengobati pasien limfoma folikular (FL) yang kambuh/refrakter (R/R) yang telah menerima setidaknya dua terapi sistemik sebelumnya. Sebagai agonis kondisional, pembunuhan sel B target diharapkan hanya setelah pengikatan mosunetuzumab secara bersamaan ke CD20 pada sel B dan CD3 pada sel T. Mengingat aktivasi sel T yang kuat yang diinduksi oleh mosunetuzumab, toksisitas akut pada target seperti CRS dapat memengaruhi jendela terapi, yang berpotensi membatasi dosis dan kegunaannya. Untuk memahami mekanisme di balik keamanan dan kemanjuran serta mengeksplorasi strategi mitigasi keamanan, model QSP mekanistik baru dikembangkan untuk menangkap dinamika limfosit B dan T serta interaksinya dalam beberapa kompartemen fisiologis bersama dengan farmakologi mosunetuzumab. 19 Hasil simulasi model menunjukkan bahwa pemberian dosis fraksional satu langkah atau dua langkah akan mengurangi kadar sitokin puncak dengan dampak minimal pada respons antitumor. Hal ini memberikan dasar pemikiran yang kuat dan panduan kuantitatif untuk desain studi peningkatan dosis Fase I klinis mosunetuzumab. 20 Alih-alih melakukan satu peningkatan dosis, Sponsor secara strategis merencanakan dua peningkatan dosis yang berbeda: pemberian dosis tetap dan peningkatan dosis bertahap siklus 1. 20 Hasil yang muncul dari uji klinis mengonfirmasi prediksi dan telah memungkinkan dosis target yang lebih tinggi dengan risiko CRS yang dapat diterima. 20
Kelas 4: Molekul dengan aktivitas agen tunggal terbatas atau TIDAK ADA
Kelas 4 mencakup molekul dengan aktivitas agen tunggal (SA) yang terbatas atau tidak ada sama sekali dalam pengaturan klinis. Seperti Kelas 3, wawasan yang dihasilkan berdasarkan model praklinis sering kali terbatas. Mengingat bahwa Kelas 4 memiliki aktivitas agen tunggal yang terbatas atau tidak ada sama sekali, evaluasi pengisian ulang agen tunggal biasanya tidak menginformasikan pemilihan dosis; sebaliknya, tujuannya adalah untuk bergerak cepat ke pengaturan kombinasi untuk menetapkan POA. Ini mengasumsikan bahwa profil keamanan agen tunggal dapat ditoleransi, dan idealnya ada modulasi PD yang mendukung sesuai dengan MOA yang diharapkan. 21 Penilaian risiko toksisitas yang tumpang tindih memandu strategi peningkatan dosis untuk kombinasi dan pedoman manajemen keamanan yang sesuai. Karena penilaian efikasi dan keamanan sering kali dikacaukan oleh kontribusi mitra kombinasi, kohort pengisian ulang dalam populasi yang lebih homogen dapat digunakan untuk lebih mengkarakterisasi hubungan PK/PD tetapi biasanya bukan POA. Akibatnya, POA kombinasi dengan agen aktif mungkin hanya ditunjukkan pada saat percobaan acak pertama untuk mengisolasi kontribusi individu dari komponen-komponen tersebut. Dengan demikian, bahkan tanpa adanya POA, pengacakan dosis dapat dipertimbangkan secara oportunistik untuk dimasukkan dalam percobaan acak pertama yang memungkinkan POC dalam pengembangan klinis awal, berdasarkan prioritas strategis dan bukti dari percobaan praklinis dan peningkatan dosis ( Gambar 3 ). Sebagai alternatif, optimasi dosis untuk molekul Kelas 4 dapat dilakukan, jika diperlukan, setelah menetapkan POC pada dosis “tanpa penyesalan”. 5
Relatlimab
Ada beberapa contoh molekul Kelas 4 yang disetujui, dengan relatlimab sebagai contoh terbaru. 22 Sementara hubungan dosis dan respons paparan yang datar untuk keamanan dan kemanjuran, bersama dengan profil manfaat-risiko klinis yang positif secara keseluruhan, membenarkan rejimen dosis relatlimab yang disetujui, 22 publikasi dan dokumen tinjauan regulasi yang tersedia memberikan wawasan terbatas ke dalam pertimbangan pengoptimalan dosis yang unik. Secara khusus, pertimbangan terperinci untuk desain studi rentang dosis dan perluasan dosis dalam terapi monoterapi dan kombinasi dalam konteks POM, POA, dan POC tidak terdokumentasi dengan baik.
KESIMPULAN
Pengembangan obat onkologi merupakan usaha yang rumit dengan pengoptimalan multidimensi yang memerlukan strategi trade-off dan urutan POM, POA, POC, pemilihan populasi pasien, strategi kombinasi, dan pengoptimalan dosis dalam kerangka strategis yang lebih luas. Karena kerumitan ini, tidak ada solusi tunggal yang cocok untuk semua orang dalam pengoptimalan dosis onkologi. 5
Tinjauan ini menyoroti kerangka kerja pengoptimalan dosis yang disesuaikan untuk setiap kelas molekul sebagai landasan untuk mengembangkan solusi konkret. Pertimbangan utama meliputi kemampuan menerjemahkan data praklinis, relevansi keterlibatan target dan biomarker PD, sifat AE, jendela terapi, dan MOA yang berbeda, yang semuanya penting untuk mengembangkan strategi pengoptimalan dosis yang efektif untuk setiap kelas ( Gambar 3 ).
Kelas 1, 2, dan 3 diharapkan untuk menunjukkan aktivitas antitumor agen tunggal, seperti tingkat respons keseluruhan (ORR) selama eskalasi/pengisian ulang dosis (yaitu, fase rentang dosis), POA harus ditetapkan untuk mengatur perluasan dosis dengan satu atau beberapa tingkat dosis ( Gambar 2 ). Ini bukan penggunaan sumber daya pasien yang terbaik untuk memperluas pada dosis yang tidak diharapkan memiliki aktivitas antitumor. 23 Lebih jauh lagi, mungkin sulit untuk membuat keputusan dosis hanya berdasarkan data keamanan/tolerabilitas tanpa aktivitas antitumor ketika memperluas pada dosis yang tidak efektif, terutama untuk molekul yang tidak memiliki biomarker yang andal dan relevan secara klinis untuk kemanjuran. POA mungkin lebih menantang untuk ditetapkan untuk Kelas 4 karena aktivitas antitumor yang diamati dapat disumbangkan oleh mitra kombinasi. Seperti dibahas sebelumnya, POA untuk Kelas 4 mungkin hanya ditunjukkan dalam kombinasi pada saat percobaan acak pertama untuk memperhitungkan kontribusi individu dari komponen-komponen.
Studi acak (atau kohort) dengan beberapa dosis dapat mendukung pengoptimalan dosis dengan menghilangkan bias seleksi saat membandingkan dosis. Membangun fleksibilitas dalam desain studi lebih awal dalam rencana pengembangan klinis memungkinkan infrastruktur fleksibel dengan kemampuan untuk mengaktifkan pengacakan sesuai kebutuhan dan beradaptasi dengan data yang muncul untuk suatu molekul (misalnya menambahkan tingkat dosis tambahan atau menghapus tingkat dosis). Semua kelas molekuler harus menilai perlunya perbandingan dosis acak setelah profil keamanan cukup dikarakterisasi, dan bukti awal aktivitas antitumor ditunjukkan untuk agen tunggal atau kombinasi untuk memanfaatkan sumber daya pasien sebaik-baiknya.
Pemodelan empiris dan semi-mekanistik, termasuk pemodelan PK populasi, analisis dosis/paparan-respons, dan pemodelan PK/PD, telah terbukti menjadi alat yang sangat berharga untuk mendapatkan pemahaman mendalam tentang paparan obat, kemanjuran, dan toksisitas. 8 Karena kompleksitas dan persyaratan data dan pengetahuan yang luas untuk pengembangan model, model mekanistik multiskala (misalnya, model PBPK dan QSP) biasanya digunakan dalam skenario tertentu. Jika keterlibatan target penting untuk pemilihan dosis per MOA molekul yang diinginkan (misalnya, Kelas 2), pemodelan PBPK dapat menjadi alat yang berharga untuk memprediksi konsentrasi obat dan keterlibatan target di tempat kerja (yaitu, tumor). Untuk molekul dengan MOA baru dan kompleks (misalnya, ADC, TCE), ada tren yang meningkat bagi molekul-molekul ini untuk mengadopsi model QSP mekanistik multiskala untuk mendukung pemilihan dosis. 18 , 24 Model-model ini memainkan peran penting dalam memandu keputusan dosis berdasarkan data selama pengembangan, dari dosis awal pertama pada manusia hingga dosis perluasan dan dosis Fase II/III yang direkomendasikan. Dengan mengintegrasikan berbagai sumber data dan mengadopsi desain studi yang fleksibel, pendekatan ini mengoptimalkan penggunaan sumber daya pasien dan mendukung pengoptimalan dosis yang kuat di seluruh kelas obat onkologi.

