
ABSTRAK
Asam alfa-lipoat (ALA) merupakan antioksidan alami dengan potensi terapeutik, tetapi saat ini belum ada metode yang mengukur ALA dalam struktur okular. Penelitian ini menggunakan beta-siklodekstrin (β-CD) dan (2-hidroksipropil)-β-siklodekstrin (HP-β-CD) untuk meningkatkan kelarutan dan stabilitas ALA dalam rasio M 1:1. Penelitian ini bertujuan untuk mengoptimalkan dan memvalidasi metode untuk mengukur ALA dalam kompleks CD menggunakan kromatografi cair kinerja tinggi dengan deteksi ultraviolet (HPLC-UV) dan untuk melakukan studi difusi guna mengevaluasi permeabilitas ALA dalam jaringan okular. Metode HPLC menggunakan kolom C18 (ukuran partikel 150 × 4,6 mm, 5 μm) dengan fase gerak isokratik asetonitril dan air (50:50, v/v) pada pH 4,0, laju alir 1 mL/menit, mendeteksi ALA setelah 4,8 menit pada panjang gelombang 334 nm. Validasi metode dilakukan menurut pedoman ICH M10 tentang validasi metode bioanalisis. Studi stabilitas mengungkapkan bahwa stabilitas yang lebih baik diperoleh untuk ALA dalam inklusi β-CD dibandingkan dengan HP-β-CD. Studi eks vivo menggunakan sel difusi Franz dilakukan untuk mengonfirmasi bahwa ALA mampu menembus kornea dan sklera melalui pemberian okular. Metode HPLC-UV yang akurat dan tepat ini membuka jalan bagi penelitian masa depan tentang potensi ALA untuk meringankan kondisi okular.
Ringkasan
Studi ini mengoptimalkan dan memvalidasi metode HPLC-UV yang tepat dan akurat untuk mengukur ALA dalam kompleks CD, mengikuti pedoman ICH M10 tentang validasi metode bioanalisis.
Studi stabilitas mengungkapkan bahwa kompleks β-CD memberikan stabilitas termal dan kelarutan yang lebih baik untuk ALA dibandingkan dengan kompleks HP-β-CD.
Studi difusi ex vivo mengonfirmasi bahwa ALA berhasil meresap ke dalam kornea dan sklera melalui pemberian okular.
Metode yang tervalidasi meletakkan dasar untuk penelitian masa depan tentang potensi ALA untuk meringankan komplikasi yang terkait dengan penyakit mata.
Singkatan
Bahasa Indonesia: ALA
asam alfa-lipoat
ACN
asetonitril
Buku CD
siklodekstrin
DHL
asam dihidrolipoat
GSH
glutation
GSSG
glutathione teroksidasi
HP-β-CD
2-hidroksipropil)-β-siklodekstrin
HPLC-UV
kromatografi cair kinerja tinggi dengan deteksi ultraviolet
NOAEL
tingkat tidak ada efek samping yang diamati
Bahasa Indonesia: PBS
larutan penyangga fosfat
β-CD
beta-siklodekstrin
1 Pendahuluan
Peran antioksidan dalam proses metabolisme telah memperoleh relevansi yang signifikan dalam beberapa tahun terakhir karena efeknya pada kesehatan visual, dan ada banyak penelitian yang diterbitkan tentang penggunaannya dalam pengobatan beberapa patologi (Santos dan Sinha 2023 ). Di antara antioksidan yang paling menjanjikan adalah antioksidan yang berasal dari produk alami, asam α-lipoat (C 8 H 14 O 2 S 2 , asam 1,2-dithiolane-3-pentanoat, ALA), yang merupakan senyawa di mana-mana yang dapat ditemukan di setiap sel prokariotik dan eukariotik (Rochette et al. 2015 ). Meskipun Snell et al. ( 1937 ) menggambarkan ALA sebagai stimulan pertumbuhan untuk bakteri asam laktat pada tahun 1937, senyawa tersebut tidak dikonfirmasi dan diisolasi sampai tahun 1951 (Reed et al. 1951 ; Snell et al. 1937 ). ALA memiliki pusat kiral, yang menghasilkan dua bentuk enantiomer: R-ALA dan S-ALA (Liu et al. 2022 ). Beberapa penelitian telah menetapkan efektivitas yang lebih unggul dengan hanya menggunakan enantiomer (R) alami (Liu et al. 2022 ; Uchida et al. 2015 ). Meskipun sebagian besar formulasi komersial mengandung campuran rasemat (50:50) R-ALA dan S-ALA, keberadaan S-ALA tidak mengganggu aktivitas terapeutik R-ALA, juga tidak menunjukkan efek berbahaya pada sel (Wang et al. 2023 ).
ALA menunjukkan sifat hidrofilik dan lipofilik karena struktur kimianya, yang mencakup gugus polar seperti asam karboksilat (-COOH) dan rantai hidrokarbon nonpolar (Gambar 1 ) (Packer et al. 1995 ). Fitur-fitur ini memungkinkan ALA untuk berinteraksi baik dalam sitosol maupun membran plasma, serta dengan mudah melewati sawar darah-otak, yang memungkinkannya larut dalam larutan berair dan menembus membran kaya lipid (Morini et al. 2004 ). Molekul tersebut menyajikan profil keamanan yang optimal. Studi toksikologi menunjukkan bahwa konsumsi jangka panjang ALA 60 mg/kg per hari pada tikus diklasifikasikan dengan tingkat tidak ada efek samping yang teramati (NOAEL) (Shay et al. 2009 ). Ini menunjukkan sifat keamanan manusia yang menguntungkan dengan tolerabilitas yang terdokumentasi dengan baik dalam banyak studi in vivo hewan dan uji klinis manusia (Derosa et al. 2020 ; Haghighatdoost et al. 2019 ). ALA dapat diserap dari makanan dan sebagai zat gizi mikro. Di antara banyak fungsi yang dijelaskan, ALA dapat meningkatkan kadar glutathione intraseluler (GSH), mengambil bagian dalam kontrol redoks protein dan faktor transkripsi dan dapat meningkatkan regenerasi antioksidan lain seperti Vitamin E dan C (Capece et al. 2022 ). Sebagai agen terapeutik, ALA memiliki implikasi penting dalam sindrom metabolik (Packer dan Cadenas 2011 ), neuropatologi (Triggiani 2020 ) dan penyakit kanker (Yan et al. 2024 ).
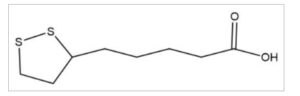
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Struktur kimia ALA.
Sumber: PubChem.
Antioksidan dapat didefinisikan sebagai zat apa pun yang, jika hadir dalam konsentrasi yang sangat rendah dibandingkan dengan substrat yang dapat dioksidasi, secara signifikan memperlambat atau menghambat oksidasi substrat tersebut (Forman dan Zhang 2021 ). Atom oksigen tunggal, superoksida dan anion hidroksil adalah radikal bebas, molekul yang sangat reaktif yang dapat merusak sel, protein dan DNA, berkontribusi terhadap berbagai penyakit dan mempercepat proses penuaan (Sies 2015 ). Stres oksidatif terjadi ketika ada ketidakseimbangan antara produksi radikal bebas dan kemampuan tubuh untuk menetralkannya (Carocho dan Ferreira 2013 ; Forman dan Zhang 2021 ). Antioksidan bertindak sebagai pemulung radikal bebas ini, sehingga mengurangi efek kerusakannya dan dengan demikian membantu menjaga kesehatan sel (Rasheed dan Fathima 2019 ).
Cincin dithiolane terutama bertanggung jawab atas reaktivitas kimia ALA (Rochette et al. 2013 ). Bentuk teroksidasi ALA dan bentuk tereduksinya, asam dihidrolipoat (DHLA), menciptakan pasangan redoks dengan potensial -320 mV, sedangkan pasangan GSH/glutathione teroksidasi memiliki potensial redoks -240 mV (Flohé 2013 ; Rochette et al. 2013 ). Hal ini menjadikan DHLA/ALA pasangan redoks yang lebih kuat, memberikan perlindungan yang lebih besar terhadap stres oksidatif dibandingkan dengan GSH/glutathione teroksidasi. Studi kimia awal menunjukkan bahwa ALA dan DHLA dapat menetralkan radikal hidroksil, asam hipoklorit dan oksigen tunggal, yang merupakan spesies yang terlibat dalam kerusakan sel dan peradangan (Flohé 2013 ). Selain itu, penelitian lain menunjukkan bahwa ALA dan DHLA bereaksi dengan ion peroksinitrit, spesies oksigen reaktif yang terbentuk dari interaksi cepat oksida nitrat dengan anion superoksida, yang diperkirakan memediasi sebagian besar efek sitotoksik oksida nitrat (Salehi 2019 ). Lebih jauh lagi, ALA dan DHLA terbukti mendukung regenerasi antioksidan endogen, seperti Vitamin C dan E, dengan menyediakan sarana bagi antioksidan ini untuk dikembalikan ke bentuk aktifnya setelah teroksidasi (Mosallaei et al. 2024 ; Papanas dan Ziegler 2014 ).
Stabilitas dan bioavailabilitas banyak zat lipofilik dalam larutan terhalang oleh kelarutan airnya yang rendah (Muhammad et al. 2017 ). Siklodekstrin (CD) telah digunakan secara luas dalam beberapa tahun terakhir untuk meningkatkan kelarutan dalam air, stabilitas dan bioavailabilitas obat-obatan (Conceicao et al. 2018 ; Jacob dan Nair 2018 ; Lachowicz et al. 2020 ; Mahjoubin-Tehran et al. 2020 ). CD adalah oligosakarida siklik, yang terdiri dari unit D-glukopiranosa yang terhubung dengan (α-1,4) (Conceicao et al. 2018 ). Dengan struktur rongga berbentuk kerucut terpotong yang khas, CD memiliki bagian dalam hidrofobik dan bagian luar hidrofilik, yang memungkinkannya untuk secara efisien membentuk kompleks inklusi dengan molekul hidrofobik, sehingga meningkatkan kelarutannya dalam air (Jacob dan Nair 2018 ). Tiga CD alami adalah α-siklodekstrin (α-CD), β-siklodekstrin (β-CD) dan γ-siklodekstrin (γ-CD), yang masing-masing terdiri dari enam, tujuh dan delapan unit glukopiranosa (Mahjoubin-Tehran et al. 2020 ). Meskipun β-CD memiliki kelarutan terendah dalam air, siklodekstrinlah yang paling penting dalam industri farmasi (Loftason dan Duchêne 2007 ). Karena berat molekul sebagian besar obat berkisar antara 200 hingga 800 g/mol, β-CD ideal untuk membungkus prinsip aktif; lebih jauh lagi, produksinya untuk mendapatkan bentuk murni mudah dan ekonomis (Riccio et al. 2023 ). Selama dua dekade terakhir, CD telah diteliti secara ekstensif dan diaplikasikan sebagai pembawa obat, menghasilkan ketersediaan banyak senyawa turunan CD di pasaran (Jacob dan Nair 2018 ; Jansook et al. 2018 ). 2-Hidroksipropil-β-siklodekstrin (HP-β-CD) disintesis dengan mensubstitusi beberapa gugus hidroksil dari β-CD dengan gugus 2-hidroksipropil, yang memodifikasi sifat fisikokimianya (Gould dan Scott 2005 ).
Sebagian besar obat mata bersifat hidrofobik, dan sebagian besar tidak mampu mengatasi penghalang alami mata, seperti pergantian air mata dan permeabilitas terbatas epitel kornea (Torres-Luna et al. 2020 ). Pencantuman prinsip aktif dalam CD umumnya digunakan dalam obat tetes mata dan sistem penghantaran obat mata lainnya untuk meningkatkan waktu retensi obat, mengurangi iritasi, dan meningkatkan hasil terapi (Shulman et al. 2015 ; Soliman et al. 2017 ; Zaghloul et al. 2022 ). Lebih jauh, CD juga dapat meminimalkan toksisitas dengan mengurangi kontak langsung antara obat dan jaringan mata yang sensitif, menjadikannya alat yang menjanjikan untuk meningkatkan keamanan dan kemanjuran pengobatan mata (Wang et al. 2018 ).
Sebagian besar penelitian tentang ALA dilakukan secara oral, yang mana datanya menunjukkan bioavailabilitas hanya 30% dan mengalami degradasi hati yang cepat serta waktu paruh yang pendek, yaitu 30 menit (Capece et al. 2022 ; Mosallaei et al. 2024 ; Shay et al. 2009 ). Mengenai penggunaan ALA pada penyakit mata, telah terbukti membantu mencegah atau mengobati cacat permukaan mata pada pasien diabetes (Roszkowska et al. 2022 ), mengurangi akumulasi proses oksidatif pada sel epitel kornea manusia (Li et al. 2023 ) atau dikombinasikan dengan obat lain untuk memperbaiki timbulnya penyakit mata (Luzet et al. 2024 ). Sebuah penelitian terkini telah mengevaluasi keamanan obat tetes mata topikal yang mengandung ALA (Korenfeld et al. 2021 ). Meskipun demikian, ALA menunjukkan kelarutan yang rendah dalam larutan berair, diperkirakan sebesar 0,003 M pada suhu 25°C dan ketidakstabilan pada suhu 37°C (Caira et al. 2017 ). Perlu ditingkatkan agar dapat diberikan melalui larutan berair (Caira et al. 2017 ; Ikuta et al. 2013 ). Oleh karena itu, CD digunakan untuk meningkatkan keterbatasan ALA yang disebutkan dalam larutan. β-CD dan HP-β-CD, yang banyak digunakan untuk pemberian okular, dipilih untuk membentuk inklusi dengan ALA (Kaur et al. 2004 ).
Meskipun beberapa penelitian telah mengenkapsulasi ALA dalam CD, tetapi tidak satupun dari penelitian tersebut telah menyediakan metode yang tervalidasi untuk mengukur ALA secara kuantitatif (Ikuta et al. 2013 ; Kaur et al. 2004 ). Penelitian awal telah menerapkan beberapa metode, seperti spektrofotometri, spektrofluorometri, elektrokimia dan spektrometri massa untuk mengukur ALA dalam sampel biologis (Borowczyk et al. 2015 ). Namun, kromatografi cair kinerja tinggi dengan sinar ultraviolet (HPLC-UV) dapat menjadi metode yang baik untuk pemeriksaan sampel biologis karena kemampuan pemisahannya yang besar. Sampai saat ini, belum ada penelitian yang melaporkan deteksi ALA dalam jaringan mata menggunakan HPLC-UV. Deteksi dan kuantifikasi ALA adalah langkah pertama sebelum melakukan penelitian lebih lanjut tentang molekul dalam pengiriman okular. Tujuan dari penelitian ini adalah untuk mengembangkan dan memvalidasi metode HPLC-UV yang stabil untuk mengukur ALA dalam kompleksasi CD mengikuti pedoman International Conference on Harmonization (ICH) M10 tentang validasi metode bioanalisis (International Council for Harmoniisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) 2022 ). Pada akhirnya, kita harus dapat menerapkan metode untuk mengukur ALA setelah studi difusi ex vivo molekul tersebut di mata.
2 Bahan dan Metode
2.1 Bahan
2.1.1 Instrumen
HPLC-UV terdiri dari pompa kuartener Waters 1525, rangkaian dioda dan detektor Waters 2707 dengan panjang gelombang ganda, serta injektor otomatis dengan kapasitas maksimum sampel 50 μL (Water 2998 Plus). Peralatan tersebut terhubung ke komputer yang dilengkapi dengan perangkat lunak Breeze2 Login. Injektor otomatis (Nomor Model SM7) digunakan dengan volume injeksi 50 μL. Fase stasioner adalah kolom Waters Sunfire C18 (ukuran partikel 150 × 4,6 mm, 5 μm) dengan laju alir standar 1,0 mL/menit. Sampel dijalankan pada suhu 22°C, dan untuk deteksi ALA, panjang gelombang 334 nm dipilih.
2.1.2 Reagen
Baik bubuk asam α-lipoat (sintetis, kemurnian > 99,0%) dan dua CD, β-siklodekstrin (kemurnian > 98,0%) dan (2-hidroksipropil)-β-siklodekstrin (kemurnian > 98%), dibeli dari Sigma. Larutan penyangga fosfat (PBS), pH = 7,4, dibuat di laboratorium dari natrium klorida (NaCl, kemurnian > 99,5%, Honeywell Fluka), dinatrium hidrogen fosfat (Na 2 HPO 4 , kemurnian > 99,0%, Sigma-Aldrich) dan kalium dihidrogen fosfat (KH 2 PO 4 , kemurnian > 99,0%, Sigma-Aldrich). Larutan fase gerak HPLC, yang merupakan asetonitril tingkat HPLC, metanol tingkat HPLC, dan air tingkat HPLC, dibeli dari Carbon Group, Ringaskiddy, County Cork, Irlandia. Asam asetat (kemurnian 99,8%) diperoleh dari Honeywell Fluka.
2.2 Metode
2.2.1 Persiapan Solusi
Fase bergerak terdiri dari campuran asetonitril (ACN) dan air bermutu HPLC dengan rasio 50:50 (v/v), dengan pH yang disesuaikan menjadi 4,00 (Metria, Model M92). Larutan fase bergerak disaring sebelum disuntikkan ke dalam kolom menggunakan filter membran selulosa ester Durapore (ukuran pori 0,45 μm; Merck Millipore Ltd, Irlandia).
Larutan PBS dibuat dengan melarutkan massa garam padat yang ditimbang dengan jumlah berikut (b/v): 0,8% NaCl, 0,144% Na2HPO4 dan 0,024 % KH2PO4 dan dilarutkan dalam 1 L air suling, dan pH diatur menjadi 7,4 .
Sampel biologis yang dimaksud disiapkan dengan memisahkan berbagai jaringan mata kelinci, termasuk kornea, iris, humor akuos, humor vitreus, sklera, koroid, retina, dan otot mata. Struktur ini dicampur dan diaduk dalam larutan PBS selama 24 jam pada suhu ruangan, kemudian disaring dua kali melalui filter 0,22 mm untuk menghilangkan kotoran.
Larutan ALA standar berair 1 mg/mL dibuat dengan melarutkan ALA dan β-CD dan ALA dalam HP-β-CD dalam rasio molar 1:1 dalam larutan biologis. Campuran diaduk selama minimal 24 jam pada suhu ruangan. Dari campuran, larutan stok 100 μg/mL dibuat dengan mengencerkan larutan standar dalam labu ukur. ALA dideteksi menggunakan metode HPLC, dan garis kalibrasi dibuat untuk menetapkan hubungan antara konsentrasi ALA yang diketahui dan absorbansi yang sesuai. Biasanya, pelarut kurva kalibrasi adalah PBS. Namun, dalam validasi khusus ini, kurva kalibrasi menggunakan struktur okular campuran digunakan untuk memastikan bahwa jejak struktur okular tidak mengganggu puncak ALA.
2.2.2 Metode Validasi
Metode ini dievaluasi menurut pedoman ICH M10 tentang validasi metode bioanalitik untuk validasi parsial metode kromatografi, yang berisi pengujian berikut: selektivitas, spesifisitas, efek matriks, kurva kalibrasi dan rentang, yang mencakup penentuan batas bawah deteksi (LLOD) dan batas bawah kuantifikasi (LLOQ), akurasi dan presisi, carry-over dan stabilitas. Uji selektivitas dilakukan untuk mengevaluasi kemampuan mendeteksi dan membedakan ALA dalam sampel biologis. Konsentrasi ALA yang diketahui diencerkan dalam sampel biologis kosong dan dianalisis dalam HPLC. Kromatogram dari 10 sampel berbeda dievaluasi.
Uji validasi lainnya adalah efek matriks, yang didefinisikan sebagai perubahan sampel obat karena komponen yang tidak teridentifikasi. Uji ini dievaluasi dengan menganalisis enam sampel independen pada konsentrasi ALA rendah (10 μg/mL) dan tinggi (75 μg/mL) yang disiapkan dalam sampel biologis, dengan tiga kali ulangan masing-masing, untuk memastikan bahwa area di bawah kurva puncak tetap konsisten di berbagai sumber.
Kurva kalibrasi ALA disiapkan dari sampel biologis kosong dan tujuh tingkat konsentrasi (dari 1 hingga 100 μg/mL). Kurva kalibrasi dilaporkan dalam bentuk garis regresi linier, dengan kemiringan dan intersep. Dari data yang diperoleh dari lima kurva kalibrasi selama 3 hari, LLOD dan LLOQ dihitung melalui rumus berikut:
![]()
di mana σ adalah deviasi standar residual dan b adalah kemiringan persamaan regresi linier.
Ketepatan dan presisi dinilai melalui eksperimen dalam-hari dan antar-hari, menggunakan empat tingkat konsentrasi: LLOQ, konsentrasi rendah (10 μg/mL), konsentrasi sedang (50 μg/mL) dan konsentrasi tinggi (75 μg/mL). Untuk ketepatan dalam-hari, enam kali ulangan dari setiap tingkat konsentrasi dievaluasi dalam satu hari. Ketepatan antar-hari dilakukan dengan mengevaluasi dua kali ulangan dari setiap tingkat konsentrasi setiap hari selama 5 hari. Ketepatan ditentukan dengan menilai konsentrasi ALA tertentu dan menghitung deviasi relatif di lima garis kalibrasi. Ketepatan dinyatakan sebagai persentase deviasi dari konsentrasi nominal, menggunakan rumus berikut:
![]()
(Borowczyk dkk. 2015 )
Carry-over dievaluasi dengan menganalisis enam sampel blanko biologis mengikuti konsentrasi tertinggi pada kurva kalibrasi (100 μg/mL), dengan tiga kali ulangan masing-masing. Tujuannya adalah untuk mendeteksi kemungkinan residu ALA dari sampel sebelumnya yang tersisa di HPLC.
Mengenai uji stabilitas, sampel dengan konsentrasi tinggi dan rendah (masing-masing 75 dan 10 μg/mL) ALA dalam CD disiapkan dalam enam kondisi berbeda: inkubator (37°C), suhu ruangan dengan cahaya (25 L), suhu ruangan dalam gelap (25 D), lemari es (4°C), freezer (−18°C) dan freezer ekstrem (−80°C). Larutan diukur pada hari ke-nol dan kemudian disimpan pada kondisi yang dijelaskan. Pada setiap hari pengambilan sampel (Hari ke-3, 7, 10, 14, 21 dan 30), sebagian kecil dari setiap sampel (200 μL) dikumpulkan untuk mengukur persentase pemulihan obat.
2.2.3 Studi Difusi Ex Vivo
Protokol percobaan ini mendapat persetujuan dari Komite Etik Universitas CEU Cardenal Herrera (Ref. 2011/010) dan Conselleria d’Agricultura, Pesca i Alimentació, Generalitat Valenciana (Ref. No. 2017/VSC/PEA/00,192). Sebelum eutanasia, hewan diberi makan sepuasnya dan ditangani sesuai dengan peraturan kesejahteraan hewan terkini, sebagaimana yang diuraikan dalam Keputusan Kerajaan Spanyol 1201/2005 (BOE 2005). Kornea dan sklera dari kelinci betina albino putih Selandia Baru digunakan untuk mengevaluasi permeasi obat melalui jaringan mata. Setelah eutanasia, mata diambil dan dibilas dengan larutan garam, dan jaringan otot yang tersisa dibuang. Kornea dan sklera dipisahkan menggunakan pisau bedah dengan membuat sayatan pada sambungan sklera-limbal dan dipasang pada sel difusi Franz standar (Disa, Italia) dengan luas difusi 0,567 cm 2 . Sel difusi standar ini terdiri dari dua kompartemen, donor dan reseptor, yang dipisahkan oleh membran tempat jaringan mata ditempatkan. Larutan donor terdiri dari 0,5 mL ALA 1 mg/mL dalam β-CD dalam larutan PBS. Larutan akseptor juga PBS, yang dipilih untuk meniru lingkungan fisiologis segmen dalam mata.
Ketika ALA dalam larutan β-CD ditambahkan ke kompartemen donor, ALA akan meresap melalui kornea atau sklera untuk mencapai ruang reseptor. Untuk meniru segmen posterior mata, 4,2 mL PBS ditambahkan ke kompartemen reseptor. Sampel 200 μL dari kompartemen reseptor dikumpulkan pada menit ke-30, 60, 90, 150, dan 180, dan volume PBS yang sama diganti untuk mempertahankan volume awal. Jumlah ALA yang terakumulasi di ruang reseptor diukur menggunakan metode HPLC yang telah divalidasi sebelumnya.
Setelah 3 jam percobaan, konsentrasi ALA di ruang donor dan membran juga diukur. Aliquot larutan ALA (100 μL) di ruang donor dikumpulkan dan diukur dengan HPLC. Di sisi lain, kornea dan sklera dikeluarkan dan direndam dalam larutan ekstraksi yang telah diuji sebelumnya menggunakan asetonitril:air (v/v, rasio 80:20) selama 12 jam pada suhu ruangan. Kemudian, larutan disaring dengan filter berpori 0,22 μm untuk menghilangkan kotoran. Jumlah ALA yang tertahan di jaringan diukur dengan menggunakan HPLC.
2.2.4 Analisis Statistik
Semua data disajikan sebagai mean ± SD ( n = 6). Grafik statistik disiapkan menggunakan Sigmaplot 12.0, dan uji statistik dilakukan menggunakan IBM SPSS Statistics 29.0. Semua hasil dinilai untuk uji normalitas dengan tingkat keyakinan 95%, dan perbandingan hasil diuji menggunakan ANOVA satu arah jika data terdistribusi normal. Jika data tidak mengikuti distribusi normal, uji Kruskal–Wallis digunakan.
3 Hasil
3.1 Deteksi Puncak
Proporsi pelarut yang berbeda dari fase mobil (metanol atau asetonitril) dengan air diuji (70:30, 60:40 dan 50:50, v/v). Nilai pH yang berbeda berkisar dari 3,0 hingga 4,5 disesuaikan dengan asam asetat. Kisaran konsentrasi adalah dari 1,0 hingga 100,0 μg/mL. Di bawah kondisi yang dievaluasi, tidak ada ALA yang dapat dideteksi dalam kromatogram ketika metanol:air digunakan sebagai fase mobil. HPLC-UV mendeteksi ALA setelah 4,8 menit, pada panjang gelombang 334 nm menggunakan asetonitril:air, rasio 50:50 (v/v), elusi isokratik (Gambar 2 ). Setiap analisis dijalankan selama 10 menit. Sampel biologis kosong, sampel PBS dan PBS dengan sampel CD dianalisis untuk mengonfirmasi bahwa baik pelarut maupun CD tidak memengaruhi puncak ALA.
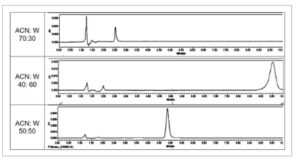
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Kromatogram HPLC-UV representatif dari 100 μg/mL asam α-lipoat dalam tiga fase bergerak berbeda yang mengandung asetonitril (ACN) dan air (W), semuanya dengan pH = 4,0. Puncak depan adalah PBS, asam asetat, dan CD, dan tidak ada satu pun yang mengganggu puncak ALA.
Sumber: Perangkat lunak Breeze2.
3.2 Validasi Metode
3.2.1 Selektivitas, Spesifisitas, Efek Matriks dan Carry-Over
Untuk uji selektivitas, analisis konsentrasi ALA yang diketahui dalam sampel biologis kosong dari 10 sumber berbeda menghasilkan kromatogram yang sama dan tidak mengganggu waktu retensi ALA. Di sisi lain, tujuan uji spesifisitas adalah untuk membuktikan bahwa untuk konsentrasi ALA yang diketahui, tidak ada perbedaan antara luas puncak ( p > 0,05). Dalam kromatogram, tidak ada perubahan dalam bentuk puncak atau puncak lainnya, yang menunjukkan bahwa tidak ada metabolit, pengotor, atau produk degradasi dari sampel.
Untuk menilai efek matriks, enam sampel berbeda dengan konsentrasi ALA rendah (10 μg/mL) dan tinggi (75 μg/mL) dianalisis, dan konsentrasi yang dihitung dari kromatogram berada dalam kisaran 15% dari konsentrasi teoritis. Kandungan ALA endogen dalam mata kelinci dinilai untuk memastikan bahwa tidak ada kadar ALA yang terdeteksi yang diamati dalam kondisi pengujian kami, yang mengonfirmasi kesesuaian matriks kosong untuk validasi metode dan penelitian lebih lanjut. Dalam uji carry-over, sampel biologis kosong yang dianalisis setelah konsentrasi tertinggi garis kalibrasi tidak menunjukkan puncak apa pun, kecuali puncak depan. Oleh karena itu, tidak ada ALA residual yang terbawa dari sampel sebelumnya.
3.2.2 Kurva Kalibrasi, Penentuan LLOD dan LLOQ
Kurva kalibrasi dibuat menggunakan ALA dalam β-CD dalam larutan PBS. Persamaan kalibrasi standar dibuat dengan memplot area di bawah kurva terhadap konsentrasi yang sesuai menggunakan kurva regresi linier penyesuaian kuadrat terkecil setelah kurva kalibrasi dibuat dari tujuh tingkat konsentrasi (1, 5, 10, 25, 50, 75 dan 100 μg/mL) untuk menilai linearitas metode (Gambar 3 ). Setelah melakukan regresi linier, koefisien determinasi ( R 2 ) dihitung (Tabel 1 ).
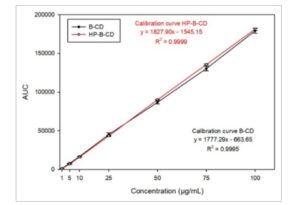
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
Regresi linier kurva kalibrasi rata-rata ALA dalam β-CD dan ALA dalam larutan standar HP-β-CD. Data menunjukkan area di bawah kurva (AUC) versus konsentrasi ALA yang diketahui dengan interval kepercayaan 95%.
TABEL 1. Data dari kurva regresi untuk ALA dalam dua siklodekstrin yang dievaluasi, β-siklodekstrin (β-CD) dan HP-β-siklodekstrin (HP-β-CD). Data ini mencakup persamaan kurva kalibrasi, koefisien determinasi ( R 2 ), rentang linearitas, batas bawah deteksi (LLOD) dan batas bawah kuantifikasi (LLOQ).

3.2.3 Stabilitas
Kontrol kualitas stabilitas obat menjamin bahwa periode penyimpanan sampel harus sama dengan atau lebih lama dari periode analisis. Stabilitas ALA dalam CD dievaluasi menggunakan konsentrasi rendah dan tinggi, masing-masing 10 dan 75 μg/mL. Kondisi penyimpanan bervariasi, termasuk inkubasi pada suhu tinggi, suhu ruangan, dan beberapa kondisi penyimpanan dingin. Sebagian besar kondisi penyimpanan dipertahankan dalam kegelapan, kecuali suhu ruangan, yang dinilai baik dalam kegelapan maupun dalam paparan cahaya. Gambar 4 menampilkan hasil uji stabilitas. Tidak ada perbedaan dalam konsentrasi awal ALA antara kedua CD. Dapat dilihat bahwa kondisi yang lebih tidak stabil adalah inkubator dan suhu ruangan, sedangkan yang lebih stabil adalah kondisi lemari es dan freezer. Pada Hari ke-3, sebagian besar kondisi menunjukkan pemulihan lebih dari 90%. Khususnya, kondisi penyimpanan dingin menunjukkan pemulihan obat lebih dari 98%. Sejak Hari ke-7, degradasi ALA pada suhu 37°C, 25°C terang, dan 25°C gelap lebih cepat daripada tiga kondisi lainnya, dan terdapat tanda dimerisasi pada kromatogram. Sampel pada suhu 4°C, −18°C, dan −80°C stabil, mempertahankan lebih dari 80% ALA setelah 30 hari penyimpanan, dan tidak menunjukkan tanda dimerisasi pada kromatogram.

GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
Stabilitas ALA selama 30 hari dalam kompleks CD. Konsentrasi 10 dan 75 μg/mL. Kondisi yang digunakan adalah inkubator (37°C), suhu ruangan dengan cahaya (25 L), suhu ruangan dalam gelap (25 D), lemari es (4°C) dan dua kondisi freezer (−20°C) dan (−80°C). Data dinyatakan sebagai % pemulihan obat ± simpangan baku ( n = 6), dan perbedaan yang signifikan secara statistik antara % ALA dalam β-CD dan % ALA dalam HP-β-CD untuk setiap hari ditandai dengan *.
Degradasi ALA dalam dua jenis CD tersebut sebanding. Pada suhu 37°C, perbedaan yang signifikan secara statistik terlihat pada konsentrasi 75 μg/mL, dengan ALA dalam β-CD terdegradasi lebih lambat daripada dalam HP-β-CD. Pada Hari ke-30, tidak ada kadar ALA yang terdeteksi tersisa dari 10 μg/mL awal, terlepas dari jenis siklodekstrin. Pada suhu ruangan, kondisi cahaya, β-CD lebih stabil daripada HP-β-CD sejak Hari ke-21 ( p < 0,05) dalam konsentrasi 75 μg/mL, sedangkan pada 10 μg/mL, kedua CD memiliki kecenderungan degradasi yang sama. Pada suhu ruangan, kondisi gelap, β-CD lebih stabil pada konsentrasi rendah, sedangkan HP-β-CD lebih stabil pada konsentrasi tinggi pada Hari ke-30.
Pada kondisi yang lebih dingin (4°C, −18°C, dan −80°C), persentase pemulihan antara kedua CD mulai menunjukkan beberapa perbedaan signifikan sejak Hari ke-7. Pada suhu 4°C, terdapat perbedaan signifikan dalam retensi ALA antara Hari ke-10 dan ke-21, meskipun tidak ada perbedaan yang terdeteksi pada Hari ke-30. Pada suhu −18°C, data menunjukkan bahwa β-CD menunjukkan persentase pemulihan yang lebih tinggi dibandingkan dengan HP-β-CD. Dengan cara yang sama, β-CD menunjukkan stabilitas yang lebih baik pada konsentrasi yang lebih rendah pada suhu −80°C dengan konsentrasi 75-μg/mL. Satu-satunya titik tidak teratur terdapat pada suhu −80°C dengan konsentrasi 10-μg/mL, terdapat perbedaan signifikan pada Hari ke-7 namun tidak pada Hari ke-3 dan ke-10. Sejak Hari ke-21, terlepas dari konsentrasinya, ALA dalam β-CD lebih stabil dibandingkan ALA dalam HP-β-CD ( p < 0,05).
Secara keseluruhan, setelah 30 hari, persentase ALA yang diinklusi dengan β-CD menunjukkan stabilitas yang lebih baik dibandingkan dengan HP-β-CD, terutama saat disimpan pada suhu ekstrem. Oleh karena itu, kami terus berupaya menginklusi ALA dalam β-CD.
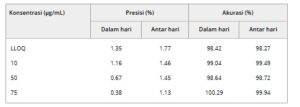
Hasil akurasi dan presisi ALA dalam metode β-CD ditunjukkan pada Tabel 2. Tidak ada perbedaan signifikan secara statistik dalam akurasi antara intraday dan interday, meskipun semakin tinggi konsentrasi, semakin presisi konsentrasinya. Ada juga perbedaan signifikan antara presisi intraday dan interday untuk konsentrasi 50 dan 75 μg/mL. Namun, presisi dan akurasi berada dalam kisaran 15% dari nilai konsentrasi aktual, yang dinyatakan dalam pedoman ICH.
TABEL 2. Ketepatan dan akurasi metode HPLC untuk menentukan ALA dalam kompleks β-CD dalam waktu satu hari dan dua hari. Data direpresentasikan sebagai rata-rata dari lima garis kalibrasi.
3.3 Studi Difusi Ex Vivo
Dosis awal ALA di kompartemen donor adalah 881,61 ± 3,99 μg/cm 2 ( n = 6). Konsentrasi ALA yang telah berdifusi melalui kompartemen membran terdeteksi di kompartemen reseptor 15 menit setelah pemberian (Gambar 5 ). Tiga jam setelah pemberian, konsentrasi ALA yang berdifusi melalui kornea dan sklera masing-masing adalah 229,60 ± 24,96 μg/cm 2 dan 314,59 ± 33,06 μg/cm 2 , yang mengindikasikan bahwa ada perbedaan signifikan antara konsentrasi ALA yang meresap melalui dua jaringan ( p < 0,05). Linearitas kedua kurva berlanjut, yang mengindikasikan bahwa ada kemungkinan lebih banyak ALA yang meresap ke kompartemen reseptor jika bersentuhan dengan jaringan untuk jangka waktu yang lebih lama (Gambar 5 ).
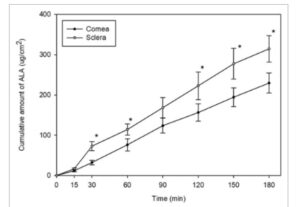
GAMBAR 5
Buka di penampil gambar
Kekuatan Gambar
Jumlah ALA yang terakumulasi di kompartemen reseptor selama 3 jam setelah pemberian (μg/cm 2 ) versus waktu (menit) kornea dan sklera ( n = 6, mean ± SD). Perbedaan signifikan antara kornea dan sklera ditandai dengan *.
Sementara itu, jumlah ALA dalam kompartemen membran dan donor dikuantifikasi dan direpresentasikan dalam Gambar 6 sebagai persentase keseimbangan massa antara semua kompartemen. Total massa ALA dalam tiga kompartemen berjumlah 99% dari massa teoritis, yang berarti hampir tidak ada degradasi kehilangan ALA selama percobaan. Grafik keseimbangan massa menunjukkan bahwa tidak banyak ALA yang tertahan dalam jaringan, 4,92% di kornea dan 3,06% di sklera.
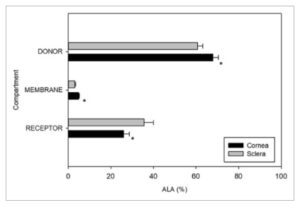
GAMBAR 6
Buka di penampil gambar
Kekuatan Gambar
Keseimbangan massa ALA (%) dari tiga kompartemen: donor, membran dan reseptor setelah 3 jam kornea dan sklera ( n = 6, mean ± SD). Perbedaan signifikan antara kedua jaringan ditandai dengan *.
4 Diskusi
Asam alfa-lipoat adalah antioksidan alami yang ditemukan dalam sayuran hijau seperti bayam, brokoli, dan daging merah (Triggiani 2020 ). Ia menonjol karena kemampuannya membentuk khelat dengan logam berat, mengurangi efek berbahaya dari ROS dan menetralkan radikal bebas secara langsung, serta meregenerasi antioksidan endogen lainnya (Packer dan Cadenas 2011 ; Yan et al. 2024 ). Secara klinis, ia menunjukkan hasil yang menjanjikan dalam mengelola kondisi seperti diabetes dengan meningkatkan sensitivitas insulin, mengurangi kerusakan oksidatif, dan melindungi neuron dalam penyakit neurodegeneratif (Papanas dan Ziegler 2014 ; Rochette et al. 2015 ; Triggiani 2020 ). Deteksi ALA dalam sampel biologis pada penyakit hati (Hidalgo et al. 2024 ), penyakit ginjal (Noripour et al. 2024 ), penyakit degeneratif (Korenfeld et al. 2021 ) dan penyakit terkait hormonal (Barrientos et al. 2024 ) telah dijelaskan. Mengenai penyakit mata, ALA telah dipelajari karena manfaat potensialnya dalam mengelola retinopati diabetik dengan melindungi terhadap kerusakan oksidatif pada retina dan meningkatkan kesehatan mitokondria (Ajith 2020 ; Shi et al. 2020 ). Penelitian lain menunjukkan bahwa ALA dapat memperlambat perkembangan glaukoma dengan mengurangi stres oksidatif dan menjaga sel ganglion retina (Inman et al. 2013 ). Selain itu, sebuah penelitian menyelidiki manfaat ALA dalam sindrom mata kering, menunjukkan kemampuannya untuk mencegah erosi permukaan kornea yang disebabkan oleh stres oksidatif dan kerusakan pada kelenjar lakrimal (Ajith 2020 ). Studi yang dibahas sebelumnya terutama menyelidiki ALA sebagai suplemen makanan, yang berarti bahwa ALA mengalami metabolisme lintas pertama, yang berpotensi mengurangi bioavailabilitasnya dalam jaringan mata yang ditargetkan. Dengan demikian, konsentrasi yang tepat dalam jaringan mata tidak disediakan. Selain itu, waktu paruh plasma ALA yang pendek (30 menit) menimbulkan kekhawatiran tentang mempertahankan konsentrasi efektif dalam jaringan mata. Sampai saat ini, kami belum menemukan literatur tentang deteksi dan kuantifikasi ALA dalam jaringan mata pada penyakit yang berhubungan dengan mata, yang menyiratkan bahwa deteksi ALA dalam jaringan mata masih merupakan kebutuhan yang belum terpenuhi. Hanya ada satu studi yang telah melaporkan konsentrasi ALA dalam humor akuos dengan kromatografi gas setelah pemberian okular (Cagini et al. 2010 ). Oleh karena itu, ada kekurangan data yang dipublikasikan yang mengukur kadar ALA di jaringan mata lainnya, dan penyelidikan saat ini bertujuan untuk mengatasi kesenjangan ini dengan menentukan konsentrasi ALA di segmen anterior dan posterior mata.
Enkapsulasi adalah cara untuk mengawetkan dan melindungi senyawa bioaktif dari faktor lingkungan seperti oksigen, kelembaban, cahaya dan panas (Conceicao et al. 2018 ). Perlindungan ini memastikan bahwa senyawa mempertahankan bioaktivitasnya hingga mencapai lokasi target. Sebagai antioksidan, ALA dikenal karena ketidakstabilan termal dan kelarutan rendah dalam larutan berair (Takahashi et al. 2011 ). CD telah muncul sebagai salah satu makromolekul pelindung yang menjanjikan. Di antara tiga CD yang terjadi secara alami, β-CD banyak digunakan karena ukuran rongga yang ideal untuk banyak obat, termasuk ALA (Kaur et al. 2004 ). Docking teoritis ALA dalam β-CD dipelajari dan menunjukkan bahwa kompleks terbentuk ketika ALA memasuki rongga β-CD dari sisi rantai lemaknya (gugus COOH) (Djilani et al. 2015 ; Racz et al. 2012 ). Selain itu, spektroskopi FT-IR, kalorimetri pemindaian diferensial, difraksi bubuk sinar-X dan teknik resonansi magnetik nuklir digunakan sebelumnya untuk mengkarakterisasi kompleks inklusi (Racz et al. 2013 ). Studi awal tentang pembentukan ALA dengan β-CD dan dikonfirmasi oleh studi kelarutan fase bahwa ALA dalam stoikiometri β-CD memiliki rasio molar 1:1 (Tong et al. 1995 ). Hal ini disebabkan oleh kompatibilitas ukuran dan interaksi host-tamu yang spesifik antara kedua molekul. Studi selanjutnya mempertahankan rasio inklusi ini, menjamin perlekatan ALA yang tepat ke CD (Celebioglu dan Uyar 2019 ; Ikuta et al. 2013 ; Kaur et al. 2004 ; Noothalapati et al. 2018 ; Ren et al. 2014 ; Ruchika et al. 2024 ; Trenti et al. 2002 ). Turunan β-CD, seperti HP-β-CD dan metil-β-siklodekstrin (M-β-CD), juga termasuk kandidat yang baik untuk meningkatkan kelarutan dan ketersediaan ALA. Kelarutan β-CD dalam air pada suhu 25°C adalah sekitar 16,5 mM, yang setara dengan sekitar 18,5 g/L (Pharr et al. 1989 ), dan kelarutan HP-β-CD adalah 60 g/L. ALA dalam kompleks inklusi β-CD dan HP-β-CD disiapkan pada rasio M 1:1, yang menghasilkan konsentrasi CD yang tetap di bawah batas kelarutan yang dilaporkan, sehingga memastikan pembubaran lengkap dalam semua kondisi percobaan.
Bahasa Indonesia: Ada banyak metode analisis untuk melayani tujuan kuantifikasi molekul, dari kromatografi, spektroskopi, hingga teknik elektrokimia (Sharma et al. 2021 ). Di antara semua teknik yang disebutkan di atas, HPLC-UV adalah metode yang cocok untuk memisahkan, mengidentifikasi, dan mengukur molekul kecil seperti ALA, terutama dalam sampel farmasi dan biologis (Campos et al. 2016 ; Papageorgiou et al. 2020 ). Berbagai metode HPLC-UV untuk mendeteksi ALA telah dinyatakan dalam Tabel 3. Borowczyk et al. ( 2015 ) bertujuan untuk mendeteksi ALA dalam plasma manusia; Campo et al. ( 2016 ) ingin mendeteksi ALA dalam sampel kulit. Kothari et al. ( 2018 ) menciptakan metode yang memungkinkan deteksi ALA dan Docetaxel dalam formulasi nano, sementara Papageorgious et al. ( 2020 ) melakukan validasi ALA dalam krim kosmetik. Turkowicz dkk. ( 2020 ) menyelidiki esterifikasi ALA dengan 4-metoksibenzil alkohol dan menganalisis asam lipoat dalam bentuk esterifikasinya. Untuk meningkatkan sensitivitas dan spesifisitas kuantifikasi ALA dalam sampel okular, metode kami dikembangkan melalui revisi dan optimalisasi parameter dari metode yang ditetapkan sebelumnya dan untuk mencegah tumpang tindih puncak dari bahan biologis yang ada dalam sampel. Mengenai kolom, kolom C18, panjang 150 mm dan diameter 4,6 mm, dan ukuran partikel 5 μm digunakan (Borowczyk dkk. 2015 ; Papageorgiou dkk. 2020 ). Panjang kolom yang lebih panjang akan menghasilkan waktu deteksi yang lebih lama, sedangkan panjang yang lebih pendek akan tumpang tindih dengan puncak PBS dan CD.
TABEL 3. Ringkasan berbagai metode HPLC-UV untuk deteksi ALA. Metode kami ditetapkan dengan mengoptimalkan parameter berikut: kolom, fase gerak, volume injeksi, waktu retensi, panjang gelombang deteksi, rentang linearitas, LLOD dan LLOQ.
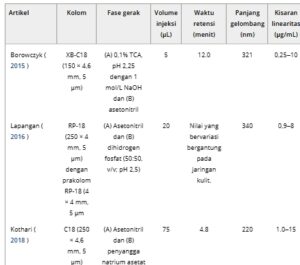
Untuk fase mobil, sebagian besar penulis menyiapkan fase mobil yang bersifat asam, dengan pH berkisar dari 2,25 hingga 4,5 (Borowczyk et al. 2015 ; Campos et al. 2016 ; Kothari et al. 2018 ; Papageorgiou et al. 2020 ). Metode kami menyesuaikan pH menjadi 4,00 dengan asam asetat; fase mobil yang terlalu asam dapat mengurangi umur kolom. Sementara Turkowicz et al. ( 2020 ) tidak melaporkan senyawa mana untuk menyesuaikan pH fase mobil, Campos et al. ( 2016 ) menggunakan asam asetat (pH = 2,4), Borowczyk et al. ( 2015 ) dengan asam trikloroasetat (pH = 1,0), dan Kothari et al. ( 2018 ) telah menggunakan buffer natrium asetat (pH = 3,5). Memang, keberadaan moderator pH tidak mengganggu kromatogram. Mengenai komponen fase mobil, tujuannya adalah untuk memilih kombinasi sederhana dari dua pelarut. Air adalah pelarut polar yang paling banyak digunakan, dan kompatibel dengan sebagian besar kolom. Di sisi lain, asetonitril, pelarut aprotik polar dan elusi kuat, lebih disukai daripada metanol (Campos et al. 2016 ; Kothari et al. 2018 ; Papageorgiou et al. 2020 ). Alasan metode kami tidak memiliki larutan buffer adalah untuk menghindari keberadaan kation lain. Volume injeksi kami adalah 50 μL, yang memungkinkan volume sampel lebih banyak daripada menggunakan 20 μL tanpa perubahan besar dalam waktu retensi dan area di bawah kurva (Boonen et al. 2013 ). Waktu retensi bervariasi antara studi yang berbeda, tetapi studi kami memiliki waktu retensi yang lebih dekat dengan hasil Kothrari et al. ( 2018 ) dan Turkowicz et al. ( 2020 ). Waktu deteksi yang lebih lama akan menghasilkan interval yang lebih panjang di antara setiap analisis. Untuk memastikan deteksi ALA yang selektif, panjang gelombang 334 nm dipilih, sejalan dengan penelitian sebelumnya oleh Campos et al. ( 2016 ) dan Papageorgiou et al. ( 2020 ). Panjang gelombang ini meminimalkan interferensi dari sampel biologis dan menawarkan spesifisitas yang lebih besar untuk ALA dibandingkan dengan yang lain. Sementara ALA menunjukkan absorbansi yang lebih kuat pada 220 nm dalam sistem HPLC-DAD kami, wilayah ini juga menunjukkan absorbansi yang signifikan dari CD dan komponen matriks (PBS dan asam asetat). Oleh karena itu, pemilihan 334 nm sengaja diterapkan untuk secara khusus melacak perubahan absorbansi yang terkait dengan cincin dithiolane ALA dalam kompleks CD, memberikan analisis inklusi yang lebih andal dan bebas interferensi.
Validasi parsial dari metode yang dioptimalkan menunjukkan bahwa metode ini selektif dan spesifik untuk ALA. Baik zat jaringan mata maupun pengotor/produk degradasi ALA tidak terdeteksi dalam kromatogram. Studi kami memiliki rentang yang lebih luas dalam kurva kalibrasinya, dari 1,0 hingga 100 μg/mL, dibandingkan dengan semua metode lain yang diidentifikasi dan memungkinkan deteksi ALA pada tingkat konsentrasi yang diperluas. Namun, LLOD dan LLOQ kami serupa dengan yang dilaporkan oleh kelompok lain, menggunakan metode lain (Tabel 1 ) (Campos et al. 2016 ; Papageorgiou et al. 2020 ).
Meskipun β-CD dan HP-β-CD memiliki kesamaan dalam kemampuan mereka untuk membentuk kompleks inklusi dan meningkatkan kelarutan (Kaur et al. 2004 ; Tomonaga et al. 2024 ), salah satu tujuan dari penelitian ini adalah untuk memilih CD yang lebih baik untuk melakukan penelitian lebih lanjut secara in vitro dan in vivo untuk pengiriman okular. Kami telah menemukan efisiensi enkapsulasi kami menjadi 91,3% ± 0,8% untuk ALA dalam β-CD dan 89,2% ± 0,5% untuk ALA dalam HP-β-CD, yang sebanding dengan pekerjaan yang dilaporkan sebesar 86,9% dalam penelitian oleh Ruchika et al. ( 2024 ) dan antara 84% dan 95% dalam penelitian oleh Tomonaga et al. ( 2024 ). Efisiensi tinggi yang konsisten ini sangat mendukung keandalan proses enkapsulasi. Penelitian sebelumnya telah mengevaluasi ALA dalam kompleks β-CD (Caira et al. 2017 ; Ikuta et al. 2013 ; Trenti et al. 2002 ) dan ALA dalam kompleks HP-β-CD (Celebioglu dan Uyar 2019 ), tetapi tidak ada satupun yang membandingkan keduanya. Hasil yang diperoleh dari sebagian besar uji validasi kami tidak menunjukkan perbedaan signifikan antara kedua CD ini. Oleh karena itu, stabilitas ALA pada kondisi yang berbeda merupakan parameter penting, yang membantu kami memutuskan CD mana yang akan digunakan untuk inklusi ALA dalam penelitian mata kami selanjutnya.
Secara umum, stabilitas termal ALA dalam larutan ditingkatkan dengan penyertaan CD. Data stabilitas mengungkapkan bahwa di bawah kondisi suhu ekstrem, seperti inkubasi atau pembekuan, β-CD menunjukkan retensi ALA yang lebih besar. Suhu permukaan mata dilaporkan sebesar 34,3°C ± 0,7°C, dengan sedikit variasi di berbagai daerah permukaan mata dan sensitivitasnya terhadap perubahan eksternal dan fisiologis (Efron et al. 1989 ). Hasil stabilitas kami pada 37°C menunjukkan bahwa ALA dapat digunakan untuk eksperimen pada suhu mata hingga 3 hari setelah persiapan sampel. Hasil yang sebanding diamati oleh Ikuta et al. ( 2013 ), yang mempelajari stabilitas ALA pada 25°C dan menemukan sekitar 97% pemulihan setelah 48 jam, sejalan dengan temuan kami. Aspek lain dari uji stabilitas melibatkan perbandingan retensi obat dalam kondisi terang dan gelap. Pada konsentrasi yang sama dan dengan CD yang sama, ALA menunjukkan persentase retensi yang lebih tinggi saat disimpan dalam kegelapan. Namun, ketika terpapar cahaya, ALA membuktikan stabilitas yang lebih besar dalam kompleks inklusi β-CD ( p < 0,05). Faktor lain yang digunakan untuk mengevaluasi stabilitas ALA adalah bentuk puncak. Studi Wang et al. ( 2023 ), yang berfokus secara khusus pada fotostabilitas ALA, menjelaskan bahwa hilangnya puncak serapan 330 nm dikaitkan dengan putusnya ikatan S–S pada cincin 1,2-dithiolane ALA. Meskipun luas puncak menurun selama pengujian stabilitas yang diperpanjang, tidak ada puncak tambahan atau perubahan waktu elusi yang diamati. Sampel ALA dapat disimpan setidaknya selama 1 bulan tanpa degradasi besar pada suhu 4°C, −18°C, dan −80°C ( p > 0,05).
Setelah memiliki metode validasi, studi ex vivo pertama adalah studi difusi, yang membantu menilai apakah ALA dalam kompleks β-CD mampu menembus kornea dan sklera. Hasil penelitian menunjukkan bahwa lebih banyak ALA yang melewati sklera daripada kornea. Ketebalan kornea kelinci sekitar 400 μm sedangkan ketebalan sklera dapat bervariasi antara 180 dan 250 μm, yang sebagian dapat mendukung teori bahwa ALA menembus lebih cepat melalui sklera daripada kornea (Peiffer et al. 1994 ). Kami memperkirakan bahwa di mata manusia, ALA akan mengikuti jalur yang sama, karena kornea manusia lebih tebal daripada sklera manusia di tempat pemberian (Camburu et al. 2023 ; Vurgese et al. 2012 ). Selain itu, kornea memiliki lima lapisan yang bergantian antara bersifat hidrofilik dan hidrofobik, yang membuat ALA lebih sulit untuk melewatinya (Alambiaga-Caravaca et al. 2021 ). Ini mungkin menjelaskan mengapa jumlah ALA yang tertahan di kompartemen membran kornea lebih tinggi daripada di sklera ( p < 0,05). Bagaimanapun, persentase pemulihan ALA dari kompartemen donor, membran dan reseptor setidaknya 95% dari konsentrasi awal. Hasil dari studi difusi menunjukkan bahwa permeasi ALA melalui mata dapat berkisar antara 25% hingga 35%, tergantung pada apakah rute pemberiannya adalah kornea atau sklera (Gambar 6 ). Pemberian ALA okular akan menghindari efek sistemik dan memastikan bioavailabilitas yang lebih baik daripada jika diberikan secara oral.
5 Kesimpulan
Hingga saat ini, belum ada metode analisis yang tersedia untuk mendeteksi ALA dalam struktur okular, dan penelitian kami menyajikan metode HPLC-UV yang telah divalidasi menurut pedoman ICH M10 tentang validasi metode bioanalisis. Kompleks inklusi dengan β-CD meningkatkan stabilitas termal dan kelarutan ALA. Metode ini menggunakan kolom C18 (150 × 4,6 mm id, ukuran partikel 5 μm) dengan laju alir 1 mL/menit, dan fase gerak 50:50 (v/v) asetonitril dan air pada pH 4,0. ALA dikuantifikasi pada menit ke-4,8 pada 334 nm, menunjukkan keandalan, selektivitas, spesifisitas, presisi, dan akurasi dalam rentang 1,0 hingga 100 μg/mL. Sampel okular yang mengandung ALA stabil selama minimal 30 hari saat disimpan pada suhu 4°C, −18°C, dan −80°C, dengan tingkat pemulihan lebih dari 90%. Studi difusi ex vivo dilakukan untuk memastikan bahwa ALA dalam kompleks β-CD mampu menembus kornea dan sklera okular, yang membuka peluang untuk mempelajari secara mendalam pemberian ALA untuk memperlambat perkembangan glaukoma, mengelola diabetes, dan meredakan peradangan sindrom mata kering.

