
Abstrak
Penuaan sel baru-baru ini telah diakui sebagai kontributor signifikan terhadap prognosis buruk glioblastoma, salah satu tumor otak paling agresif. Akibatnya, menghilangkan sel glioblastoma senesens secara efektif dapat bermanfaat bagi pasien. Translokase ADP/ATP manusia (ANT) berperan dalam fosforilasi oksidatif pada sel normal dan tumor. Penelitian sebelumnya telah menunjukkan bahwa sensitivitas sel senesens terhadap senolitik yang ditargetkan mitokondria bergantung pada tingkat ANT2. Di sini, kami secara sistematis memetakan tingkat transkrip dan protein isoform ANT dalam berbagai jenis penuaan dan tumorigenesis glioblastoma. Kami menggunakan analisis bioinformatika, spektrometri massa tertarget, RT-PCR, imunoblotting, dan penilaian status energi seluler untuk menjelaskan bagaimana isoform ANT individu diekspresikan selama perkembangan penuaan pada sel nonkanker dan glioblastoma. Kami mengamati peningkatan konsisten tingkat protein ANT1 di semua jenis penuaan yang diuji, sementara ANT2 dan ANT3 menunjukkan perubahan yang bervariasi. Perubahan kadar isoform protein ANT berkorelasi dengan pergeseran laju konsumsi oksigen seluler. Temuan kami menunjukkan bahwa isoform ANT dapat saling dipertukarkan untuk fosforilasi oksidatif dan manipulasi isoform ANT individual dapat berpotensi untuk terapi senolitik.
Singkatan
Bahasa Inggris AcN
asetonitril
AJCC
Komite Gabungan Amerika untuk Kanker
SEMUT
Translokase ADP/ATP
ATCC
Koleksi Budaya Tipe Amerika
BSA
albumin serum sapi
DIS
penuaan dini akibat obat
Bahasa Indonesia: DMEM
Dulbecco’s Modified Eagle Medium (Mata Elang yang dimodifikasi)
DMSO
dimetil sulfoksida
DOX
doksisiklin
DTT
ditiotreitol
DTX
docetaxel
Mobil Listrik
tingkat pengasaman ekstraseluler
EKONOMI
Status Kinerja Kelompok Onkologi Kooperatif Timur
Asam EDTA
asam etilendiamintetraasetat
Bahasa Inggris
asam format
Klub Sepak Bola
lipat perubahan
FCCP
karbonil sianida 4-(trifluorometoksi)fenilhidrazona
Bahasa Indonesia: FDR
tingkat penemuan palsu
HCAECS
sel endotel arteri koroner manusia
bunga iris
penuaan sel yang disebabkan oleh radiasi pengion
LC–MS
kromatografi cair yang digabungkan dengan spektrometri massa
NHBE
sel epitel bronkial manusia normal
OCR
tingkat konsumsi oksigen
OKSFO
fosforilasi oksidatif mitokondria
Bahasa Indonesia: PBS
garam penyangga fosfat
Bahasa Indonesia: PBST
garam penyangga fosfat dengan Tween
RPE-1
garis sel epitel pigmen retina manusia yang diabadikan melalui telomerase
Bahasa Inggris SASP
fenotipe sekresi terkait penuaan
SA-β-gal
β-galaktosidase yang terkait dengan penuaan
SD
natrium deoksikolat
Bahasa Inggris
pembawa zat terlarut
TEH
tetraetilamonium bromida
TFA
asam trifluoroasetat
Berita
temozolomida
μ LC-PRM
kromatografi cair yang digabungkan dengan pemantauan reaksi paralel
1 Pendahuluan
Penuaan selular adalah transformasi kompleks fenotipe selular yang terutama dipicu oleh stres genotoksis. Stres ini dapat disebabkan oleh aktivasi onkogen, ketidakseimbangan redoks, peningkatan jalur pensinyalan spesifik, paparan toksin bakteri, radiokemoterapi, dan inflamasi. Sebagai respons utama terhadap kerusakan DNA yang belum sembuh, penuaan selular bertindak sebagai penghalang antikanker, mencegah proliferasi sel dengan genom yang rusak dan tidak diperbaiki. Dalam kondisi fisiologis, sel-sel pikun berkontribusi pada regenerasi jaringan dan biogenesis trombosit dan juga memiliki fungsi sekretori yang dikenal sebagai fenotipe sekretori terkait penuaan (SASP; [ [ 1 ] ]). Namun, akumulasi sel-sel pikun yang berlebihan di jaringan dapat menyebabkan inflamasi ringan tetapi kronis dan efek kompleks lainnya yang terkait dengan penyakit terkait usia, termasuk kanker. Salah satu ciri khas sel-sel pikun adalah perubahan dalam metabolisme energiknya. Akibatnya, menargetkan aspek-aspek spesifik dari metabolisme sel pikun menjanjikan untuk pendekatan senolitik dan senomorfik [ [ 2 – 4 ] ].
Fosforilasi oksidatif mitokondria berfungsi sebagai sumber energi seluler sentral, dan disfungsi ini telah dikaitkan dengan tahap awal penuaan seluler [ [ 5 – 7 ] ]. Selama evolusi sel eukariotik, peristiwa penting terjadi–adaptasi fosforilasi oksidatif sebagai sumber energi baru–yang difasilitasi oleh hubungan simbiosis antara prekursor bakteri mitokondria dan sel eukariotik primordial. Protein yang bertanggung jawab untuk pertukaran ADP/ATP melintasi membran mitokondria adalah translokase ADP/ATP (ANT), anggota dari keluarga pembawa zat terlarut (SLC). ANT adalah protein yang paling melimpah di membran mitokondria bagian dalam. Pada manusia, empat gen mengkode ANT: ANT1 ( SLC25A4 ), ANT2 ( SLC25A5 ), ANT3 ( SLC25A6 ), dan ANT4 ( SLC25A31 ). Meskipun gen-gen ini diekspresikan bersamaan pada tingkat mRNA di semua jaringan, proporsinya bervariasi tergantung pada jenis jaringan [ [ 8 , 9 ] ]. mRNA ANT1 sebagian besar diekspresikan di jantung dan otot rangka, dengan ekspresi yang lebih sedikit di otak [ [ 10 ] ]. Tingkat transkrip ANT2 umumnya rendah, kecuali di hati dan sel-sel yang berproliferasi secara in vitro [ [ 11 – 13 ] ]. ANT3 adalah gen housekeeping yang diekspresikan secara luas di semua jaringan [ [ 13 ] ]. Anggota keluarga terakhir yang ditemukan, ANT4, diekspresikan di hati dan otak, tetapi ekspresinya yang dominan terjadi di testis [ [ 14 ] ].
Meskipun struktur utama protein ANT, kecuali ANT4 [ [ 14 ] ], sangat mirip, perbedaan fungsional telah dilaporkan sebagaimana ditinjau baru-baru ini [ [ 15 , 16 ] ]. Khususnya, dalam konteks penuaan, penelitian sebelumnya menunjukkan bahwa transkripsi ANT2 ditekan selama transisi sel proliferatif ke keadaan pikun in vitro dan selama perkembangan penuaan seluler pada sel kanker [ [ 17 ] ]. Selain itu, penurunan regulasi transkrip ANT2 diamati pada fibroblas dermal dari kulit manusia yang menua, dan ekspresi ektopik ANT2 membalikkan penuaan pada fibroblas dermal pikun replikatif [ [ 18 ] ]. Sebaliknya, memulihkan ekspresi ANT2 pada sel proliferatif dan pikun memberikan resistensi terhadap agen antikanker MitoTam (tamoxifen yang ditargetkan ke mitokondria melalui bagian trifenil fosfonium; [ [ 19 ] ]). Di sisi lain, penekanan siRNA ANT1 menginduksi penuaan pada sel epitel paru-paru [ [ 20 ] ].
Bahasa Indonesia: Untuk membedah dengan jelas perbedaan dalam fungsi fisiologis untuk isoform ANT individu, perlu memiliki metode selektif, sensitif, dan kuantitatif untuk evaluasi mereka pada tingkat protein. ANT1, ANT2, dan ANT3 berbagi sekitar 90% dari urutan asam amino mereka [ [ 14 ] ], membuatnya menantang untuk menyiapkan antibodi spesifik isoform. Meskipun antibodi spesifik isoform terhadap ANT1 dan ANT2 (tetapi bukan ANT3) tersedia secara komersial, imunoblotting, sebagai teknik semikuantitatif, dibatasi oleh variabilitas eksperimental karena pemuatan sampel yang tidak merata, transfer protein, dan latar belakang sinyal. Selain itu, afinitas antibodi yang bervariasi menghalangi penentuan rasio stoikiometri ANT secara langsung. Sementara teknik MS bottom-up pemindaian penuh sudah mapan untuk mengeksplorasi ribuan protein dalam sistem biologis [ [ 21 ] ], pemetaan isoform protein tetap menantang bahkan dengan spektrometri massa generasi berikutnya yang modern [ [ 22 ] ].
Dalam studi ini, kami melakukan analisis bioinformatika dari kumpulan data proteom dan transkriptom yang tersedia untuk umum dari sampel tumor glioma dan karsinoma paru manusia. Temuan kami mengungkapkan bahwa kadar protein ANT1, ANT2, dan ANT3 tidak berkorelasi dengan kadar transkripnya. Untuk mengukur rasio isoform ANT pada tingkat protein, kami mengembangkan metode kuantitatif berbasis spektrometri massa yang ditargetkan untuk memantau peptida ANT1, ANT2, dan ANT3 spesifik isoform. Kami mengukur perubahan isoform ANT dalam model penuaan seluler terpilih pada tingkat protein dan transkrip. Dengan pendekatan ini, kami mengamati peningkatan kadar protein ANT1 sebagai respons terhadap berbagai penginduksi penuaan di semua jenis penuaan yang diuji. Pada saat yang sama, ANT2 dan ANT3 menunjukkan perubahan variabel tergantung pada model penuaan spesifik. Lebih jauh, kami mencatat hubungan antara peningkatan fosforilasi oksidatif dan kadar protein ANT dalam sel-sel tua, yang menunjukkan regulasi ketat kadar protein isoform ANT yang terkait dengan biogenesis mitokondria.
2 Prosedur Eksperimen
2.1 Kultur sel
Kecuali dinyatakan lain dalam teks, bahan kimia dan reagen dibeli dari Sigma?Aldrich (St. Louis, MO, AS) dengan tingkat kemurnian tertinggi yang tersedia. Lini sel epitel pigmen retina manusia yang diabadikan dengan telomerase hTERT RPE-1 (RPE-1), fibroblas kulup manusia (BJ), dan lini sel glioma A-172 dan U-87 MG manusia dibeli dari American Type Culture Collection (ATCC, Manassas, VA, AS, nomor katalog CLR-4000, CRL-2522, CRL-1620, HTB-14). Sel A-172, U-87 MG, BJ, dan sel induk RPE-1 diautentikasi kurang dari setahun yang lalu oleh GENERI BIOTECH (Hradec Kralove, Republik Ceko).
Sel RPE-1, A-172, dan garis sel MG U-87 dikultur dalam medium Eagle yang dimodifikasi Dulbecco dengan 4,5 g·L −1 glukosa (DMEM, Gibco, Thermo Fisher Scientific, Waltham, MA, AS ) yang disuplemen dengan 10% serum fetal bovin (FBS), penisilin (100 U·mL −1 ), dan streptomisin (100 μg·mL −1 ).
Sel BJ dikultur dalam medium Eagle yang dimodifikasi Dulbecco dengan 1 g·L −1 glukosa (DMEM, Gibco, Thermo Fisher Scientific) yang dilengkapi dengan 10% FBS, penisilin (100 U·mL −1 ), dan streptomisin (100 μg·mL −1 ).
Untuk percobaan jangka panjang spesifik (32 hari) (Gbr. 3 ), sel RPE-1 dikultur dalam medium Eagle yang dimodifikasi Dulbecco dengan 4,5 g·L −1 glukosa (DMEM, Gibco, Thermo Fisher Scientific) yang dilengkapi dengan 200 mg·L −1 L -prolin, 10% serum fetal bovin (FBS), penisilin (100 U·mL −1 ), dan streptomisin (100 μg·mL −1 ).
Semua sel dipertahankan pada suhu 37 °C dalam atmosfer 5% CO2 dan kelembaban 95% dan diuji secara teratur untuk infeksi mikoplasma.
2.2 Persiapan garis sel dengan ekspresi ektopik inhibitor kinase dependen siklin
Sel RPE-1 dengan ekspresi p16INK4A (RPE-1 p16) dan p21WAF1 (RPE-1 p21) yang dapat diinduksi tetrasiklin disiapkan dengan mentransduksi sel dengan lentivirus rekombinan LentiX-Tet-ONE puro (San Jose, CA, AS, Takara Bio USA, Inc.) yang mengandung cDNA yang mengkode p16INK4A atau p21WAF1. Puromisin (konsentrasi akhir 2 μg·mL −1 ) digunakan untuk memilih sel positif. Sel kontrol RPE-1 tet-ONE kosong hanya mengandung vektor kosong.
2.3 Induksi penuaan sel dan penghambatan kontak
Untuk menyiapkan sel-sel pikun yang diinduksi radiasi pengion (IRIS), sel-sel RPE-1 ditanam pada kepadatan 2 × 104 sel ·cm −2 [ [ 23 ] ]. Keesokan harinya, sel-sel diekspos ke dosis tunggal 20 Gy (150 kV, 10 mA) menggunakan instrumen sinar-X Pantak HF160 (Gulmay, Surrey, Inggris) yang dilengkapi dengan generator Pantak Seifert HF320, tabung sinar-X MXR-161 (Comet, AG, Flamatt, Swiss), dan filter aluminium menggunakan arus 1–10 mA [ [ 23 ] ]. Sel-sel dipanen dalam 2, 4, 8, 16, dan 32 hari dalam tiga replikasi biologis. Sel-sel RPE-1 yang berproliferasi dan tidak diradiasi berfungsi sebagai kontrol.
Sel BJ pikun yang diinduksi obat Docetaxel (DTX; Thermo Scientific, Bremen, Jerman, ACRO456262500) disiapkan menurut protokol Sapega et al. [ [ 24 ] ] dengan sedikit modifikasi. Secara singkat, sel BJ diekspos ke DTX 5 nm diikuti dengan pertukaran medium setiap tiga hari selama 8 hari.
Untuk menyiapkan sel-sel pikun glioblastoma yang diinduksi temozolomide-(TMZ; Selleckchem, Houston, TX, AS, S1237), A-172 dan U-87 MG disemai pada kepadatan 15.000 sel·cm −2 dan, setelah 24 jam, diekspos ke TMZ pada konsentrasi akhir 100 μ m (diaplikasikan pada setiap pertukaran medium) selama 14 hari.
Untuk menginduksi penuaan sel melalui ekspresi ektopik inhibitor kinase dependen siklin p21 [ [ 25 ] ] dan p16 [ [ 26 ] ], sel p21-RPE-1 dan p16-RPE-1 dipaparkan pada 1 μg·mL −1 doksisiklin (DOX) untuk menginduksi ekspresi transgen selama 7 hari (diaplikasikan tiga kali dengan pertukaran media baru).
Untuk menginduksi ketenangan melalui penghambatan kontak, sel RPE-1 disemai pada kepadatan 15.000 sel·cm −2 dan dikultur selama 10 hari untuk mencapai konfluensi penuh. Ketenangan ditentukan oleh tidak adanya proliferasi sel.
2.4 Uji beta-galaktosidase terkait penuaan
Aktivitas beta-galaktosidase terkait penuaan pada sel kontrol dan sel pikun dilakukan menurut protokol Dimri et al. yang dimodifikasi . Secara singkat, sel yang tumbuh pada penutup kaca difiksasi dengan 0,5% glutaraldehida pada suhu ruangan selama 15 menit, dicuci dengan PBS yang ditambah dengan 1 mm MgCl 2 , dan kemudian diinkubasi dengan larutan X-gal yang dihangatkan terlebih dahulu (1 mg·mL −1 X -gal (Sigma-Aldrich), 0,12 mm K 3 Fe [CN] 6 , 0,12 mm K 4 Fe [CN] 6 × 3 H 2 O, 1 mm MgCl 2 dalam PBS , pH 6,0) pada suhu 37 °C dan 5% CO 2 selama 1–3 jam (atau sampai warna biru pada sel pikun terlihat). Setelah perkembangan pewarnaan biru yang tampak di dalam sel, penutup kaca dipasang dalam Mowiol yang mengandung 4′,6-diamidino-2-phenylindole (DAPI; Sigma-Aldrich) dan dilihat dengan mikroskop fluoresensi Leica DM6000 (Leica Microsystems, Wetzlar, Jerman) yang dilengkapi dengan kamera warna dan objektif HC PLAN APO 20×/0.70 DRY PH2.
2.5 Replikasi DNA
Replikasi DNA diperkirakan menggunakan uji penggabungan DNA EdU (Invitrogen Click-iT EdU, Waltham, MA, AS, Thermo Fisher Scientific) sesuai dengan protokol pabrik pembuatnya. Singkatnya, sel RPE-1 kontrol dan yang diiradiasi (hari ke-14) dipaparkan pada denyut EdU selama 24 jam sebelum panen. Inti sel diwarnai ulang dengan 4′,6-diamidino-2-fenilindol (DAPI; Sigma-Aldrich).
2.6 SDS/PAGE dan imunoblotting
Percobaan imunoblotting dilakukan dalam rangkap tiga biologis. Sel dicuci tiga kali dengan 1× PBS, dipanen ke dalam buffer lisis sampel SDS yang dipanaskan hingga 95 °C (2% SDS, 50 mm Tris – Cl, pH 6,8, 10% gliserol dalam H 2 O suling ganda ), dan disonikasi pada Diagenode Bioruptor 300 (Diagenode, Liege, Belgia, 4 °C, 5 siklus, intensitas tinggi, 30 detik hidup/mati). Konsentrasi protein diperkirakan dengan Pierce BCA Protein Assay (Thermo Fisher Scientific, Waltham). DTT (100 mm ) dan 0,01% bromofenol biru ditambahkan ke lisat sebelum pemisahan dengan SDS/PAGE (gel 10% digunakan). Jumlah protein yang sama dimuat ke dalam setiap sumur. Protein ditransfer secara elektrik ke membran nitrocellulose (Amersham™ Protran™ 0.45 μm NC, GE Healthcare, Chalfont St Giles, UK) menggunakan transfer semi-kering dan dideteksi oleh antibodi primer spesifik (pada suhu 4 °C semalaman) ANT1/SLC25A4 (Cell Signaling Technology, Danvers, MA, USA; #51755S, E3E9Y, pengenceran 1 : 1000) atau ANT2/SLC25A5 (Cell Signaling Technology; #14671S, E2B9D, pengenceran 1 : 1000) dalam larutan pemblokiran (5% susu bubuk tanpa lemak dalam PBST). Alfa-tubulin (GenScript, Piscataway, NJ, AS; A01410, pengenceran 1 : 1000) atau aktin (Sigma, St. Louis, MO, AS; A2066, pengenceran 1 : 10.000) digunakan sebagai kontrol pemuatan. Membran diinkubasi dengan antibodi sekunder (RT/1 jam) IgG-HRP (Bio-Rad, Hercules, CA, AS, pengenceran 1 : 10.000) anti-Kelinci (#170-6515) atau anti-Tikus (#170-6516) yang diencerkan dalam buffer pemblokiran. Aktivitas peroksidase dideteksi dengan menggunakan sistem pencitraan Fusion Solo S (Vilber, Prancis, Collégien).
2.7 Evaluasi spesifisitas antibodi ANT dengan interferensi RNA
Untuk menilai spesifisitas antibodi anti-ANT1 dan anti-ANT2 untuk analisis imunoblotting, knockdown ANT1 dan ANT2 dengan RNA interference dilakukan menggunakan sel A-172 dan HeLa dengan ekspresi ANT1 dan ANT2 yang tinggi, masing-masing. SiRNA berikut digunakan: siANT1 #2 [ [ 28 ] ] 5′-TTG TAT TGG TGT TGT ATG AdTdT-3′, dan siANT2 #2 (Austin, TX, AS, Ambion; s1375) 5′-GAA GAU UGC UCG UGA UGA AdTdT-3′, untuk knockdown ANT1 dan ANT2, masing-masing. siRNA diproduksi oleh Merck (Sigma-Aldrich). siNC (MISSION® siRNA Universal Negative Control #1 #SIC001) digunakan sebagai referensi. Sel-sel disemai 24 jam sebelum transfeksi pada kepadatan 16.000 dan 28.000 sel·cm −2 untuk HeLa dan A-172. Transfeksi siRNA dilakukan dengan Lipofectamine™ RNAiMAX (Invitrogen) sesuai dengan protokol pabrik, diikuti dengan inkubasi selama 48 jam.
2.8 PCR transkripsi balik kuantitatif waktu nyata
Sel dilisiskan menggunakan buffer lisis RLT (RNeasy Mini Kit Qiagen, Germantown, MD, AS) dengan DTT (20 μL DTT 2 m /1 mL RLT). Total RNA diisolasi menurut protokol pabrik. Jumlah RNA ditentukan secara spektrofotometri oleh NanoDrop 2000 (Thermo Fisher Scientific, Carlsbad, CA, AS) dan ditranskripsi balik menjadi cDNA dengan primer heksamer acak dan transkriptase balik MultiScribe (Applied Biosystems, Foster City, CA, AS). Tingkat ekspresi ANT1, ANT2, dan ANT3 diukur menggunakan kuantifikasi relatif qPCR (Applied Biosystems SYBR™ Select Master Mix, Applied Biosystems 7300 Real-Time PCR System dengan perangkat lunak SDS, Thermo Fisher Scientific). Jumlah relatif cDNA ditentukan oleh metode ΔΔ C t [ [ 29 ] ]; data dinormalisasi menjadi β-aktin (ACTB). Sampel diukur dalam rangkap tiga. Primer yang digunakan tercantum dalam Tabel S3 .
2.9 Analisis transkriptom
Data transkriptomik sel-sel pikun, tumor otak, pigmen naevi, adenoma, dan lesi hati diunduh dari Gene Expression Omnibus ([ [ 30 ] ]) dan database BioStudies [ [ 31 ] ] ArrayExpress. Paket Bioconductor [ [ 32 ] ] digunakan untuk memuat dan memanipulasi data mikroarray dalam perangkat lunak statistik r [ [ 33 ] ]. Metode RMA (Robust Multiarray Averaging) untuk normalisasi diterapkan pada semua kumpulan data. Paket bioconductor limma [ [ 34 ] ] digunakan untuk melakukan analisis ekspresi diferensial dan uji statistik. Dalam kumpulan data ini, kami hanya tertarik pada perubahan ANT, sehingga nilai- P digunakan untuk menentukan apakah perubahan ini signifikan. Ambang signifikansi statistik ditetapkan menjadi 0,01. Nilai outlier diidentifikasi menggunakan PCA (Principal Component Analysis) dan metode pengelompokan hierarkis. Titik-titik yang terjadi terlalu jauh dari data lain dari kelompok yang sama dinyatakan sebagai outlier dan dihapus. Beberapa outlier ditemukan dalam data: 3 dalam dataset E-GEOD-50161 dan 1 dalam dataset E-GEOD-4183. Dalam dataset GSE4290 , 7 outlier dan 4 sampel pasien tanpa diagnosis yang tepat ditemukan dan dihapus. Dataset E-MTAB-949 mencakup 5 sampel pasien dengan diagnosis unik yang tidak dapat dimasukkan ke dalam kelompok yang diselidiki; dengan demikian, mereka dihapus. Beberapa kelompok sampel yang tidak sesuai untuk analisis kami juga dihapus. Dalam kasus dataset E-GEOD-13712, hanya sel muda dan pikun dalam kondisi statis yang digunakan untuk analisis kami. Demikian pula, hanya sel muda dan pikun dari dataset E-GEOD-19864 dan E-MEXP-2683 yang digunakan. Hanya sel pikun dan muda yang tidak diobati yang digunakan dari dataset E-GEOD-77239. Kumpulan data GSE13276 berisi sampel dari otak normal, tumor, dan jaringan di sekitar tumor. Hanya sampel tumor dan otak sehat yang digunakan.
Secara keseluruhan, kumpulan data senescent berisi dua (E-MEXP-2683, E-MEXP-2283, E-GEOD-11954, E-GEOD-19864), tiga (E-GEOD-77239, E-GEOD-13712, GSE100014 ), empat (E-GEOD-16058), dan lima ( GSE35957 ) replikasi eksperimental. Kumpulan data tumor otak berisi 8 ( GSE13276 ), 127 ( GSE4290 ), dan 169 (E-GEOD-50161) sampel. Kumpulan data pigmen naevi, adenoma, lesi hati berisi 6 (E-GEOD-2487), 11 (E-GEOD-53223), 12 (E-GEOD-15960), 17 ( GSE46517 ), 23 (E-GEOD-4183), dan 275 (E-MTAB-950) sampel.
Data transkriptomik sel tunggal yang tersedia untuk umum dari sel tumor glioblastoma [ [ 35 ] ] yang diekstraksi dari 11 tumor diunduh, dianalisis menggunakan python 3.11.4 [ [ 36 ] ], dan divisualisasikan menggunakan seaborn 0.12.0 [ [ 37 ] ].
2.10 Korelasi mRNA dan protein
python 3.11.4 [ [ 36 ] ] digunakan untuk analisis korelasi transkriptom dan proteom. Dua set data berbeda yang berisi sampel dari tumor berbeda diunduh. Set data pertama [ [ 38 ] ] berisi 99 sampel pasien glioblastoma. Untuk membandingkan korelasi antara ekspresi mRNA dan jumlah protein, kami berfokus pada 19.938 mRNA pengkode protein dan proteom global yang berisi 10.977 protein terkuantifikasi. Secara total, 10.965 gen memiliki transkriptom dan proteom. Kami menggunakan jumlah bacaan tingkat gen, Fragmen Per Kilobase transkrip per Juta bacaan yang dipetakan (FPKM) untuk mRNA dan nilai intensitas berpusat nol yang dinormalisasi untuk protein. Hanya 10.941 gen yang digunakan untuk menghitung korelasi antara intensitas protein dan mRNA karena 24 gen memiliki tingkat mRNA yang sama dengan 0 FPKM. Set data juga berisi 10 sampel otak normal yang digunakan untuk membandingkan perubahan antara otak normal dan glioblastoma. Dataset kedua [ [ 39 ] ] berisi 108 sampel karsinoma sel skuamosa paru-paru. Sekali lagi, kami berfokus pada 19.938 mRNA pengkode protein dan proteom global yang berisi 11.485 protein terkuantifikasi. Secara total, 11.469 gen memiliki mRNA dan protein. Sekali lagi, kami menggunakan FPKM untuk data mRNA dan proteom ternormalisasi dua komponen, seperti yang dijelaskan dalam artikel. Namun, hanya 11.442 gen yang digunakan untuk menghitung korelasi antara intensitas protein dan mRNA karena 27 gen memiliki tingkat mRNA yang sama dengan 0 FPKM. Koefisien korelasi Pearson dan Spearman dihitung untuk setiap gen dalam setiap dataset dan nilai- P -nya . Matplotlib 3.7.2 [ [ 40 ] ] dan seaborn 0.12.0 [ [ 37 ] ] digunakan untuk visualisasi. Basis data berisi 1136 gen mitokondria manusia diunduh dari MitoCarta3.0 [ [ 41 ] ]. Dalam kumpulan data glioblastoma, terdapat 991 gen mitokondria. Akan tetapi, korelasi dihitung hanya untuk 988 gen karena 3 gen memiliki tingkat mRNA yang sama dengan 0 FPKM. Ada 985 gen mitokondria dalam kumpulan data kanker paru-paru, dan korelasi dihitung hanya untuk 982 gen karena 3 gen memiliki tingkat mRNA nol.
2.11 Respirasi seluler (OCR dan ECAR)
Analisis glikolisis dan fosforilasi oksidatif mitokondria (OXPHOS) melalui kuantifikasi laju pengasaman ekstraseluler (ECAR) dan laju konsumsi oksigen (OCR) diproses menurut Fitch et al. [ [ 42 ] ] menggunakan Seahorse Analyzers XFe24 (Agilent Technologies, Inc., Santa Clara, CA, AS). Untuk menginduksi kadar glikolisis, glukosa digunakan sebagai penambah kadar ECAR. Satu hari sebelum pengukuran, sel dilewatkan menggunakan larutan tripsin/EDTA (tripsin Biowest, Nuaillé, Prancis, P5957; EDTA, Sigma-Aldrich, 6381-92-6) 0,025%, DMEM (Thermo Scientific, Bremen, dengan GlutaMAX sebagai pengganti glutamin) ditambahkan untuk menetralkan tripsin, dan suspensi sel yang seragam dibuat dengan pipet. Sel dihitung menggunakan ruang Bürker dan ditanam dalam media pertumbuhan dengan volume total 250 μL, 15.000 sel (U-87 MG dan A-172), 5.000 sel (RPE-1 untuk IRIS, p16, p21) atau 2.800 sel (untuk BJ dan semua kontrol) ke dalam setiap sumur Seahorse XF24 V7 PS Cell Culture Microplates (24 sumur), empat sumur tanpa sel (hanya 250 μL media) untuk koreksi latar belakang. Pelat ditempatkan kembali ke dalam inkubator (5% CO 2 , 37 °C, dilembabkan) selama 24 jam. Sel RPE-1 untuk penghambatan kontak ditanam langsung ke dalam Seahorse XF24 V7 PS Cell Culture Microplates (5.000 sel per sumur) dan dikultur selama 10 hari. Pada hari pengujian, sel dicuci dengan 1 mL media pengujian yang baru disiapkan [DMEM tanpa fenol merah, dengan 0,2% bovine serum albumin (BSA), pH 7,4, Sigma-Aldrich, A9647] yang dihangatkan terlebih dahulu hingga 37 °C diikuti dengan penggantian media dengan 500 μL media pengujian terakhir. Kemudian, pelat kultur sel ditempatkan dalam inkubator 37 °C yang dilembabkan tanpa CO2 selama 30 menit sebelum pengukuran. Sementara itu, larutan obat 10x disiapkan dengan mengencerkan stok obat dalam dimetilsulfoksida (DMSO) dan dimuat dalam port obat untuk setiap sumur kartrid sensor. Konsentrasi akhir obat dalam sumur adalah sebagai berikut: Port B oligomisin 1 μ m (Sigma-Aldrich, O4876); Karbonil sianida Port C 4-(trifluorometoksi)fenilhidrazona (FCCP) 6 μ m (Sigma-Aldrich, C2920); Port D rotenon 1 μ m (Sigma-Aldrich, R8875)/antimisin A (1 μm·mL −1 ; Sigma-Aldrich, A8674) dalam 50 m m 2-deoksi-D-glukosa (Sigma-Aldrich, D8375) dengan 0,2% BSA (Sigma-Aldrich, A7030) dan Hoechst 33342 (Thermo Scientific, Bremen, 62 249). Untuk menginduksi glikolisis dan meningkatkan kadar ECAR, Port A dimuat dengan glukosa (Sigma-Aldrich, G7528) dalam konsentrasi akhir 10 m m sebagai substrat. Setelah 30 menit inkubasi pada suhu 37 °C tanpa CO 2, plat siap untuk diukur. Data dinormalisasi dengan menghitung sel yang diwarnai nuklir di setiap sumur plat menggunakan BioTek Instruments’ Cytation 3. Untuk menghitung karakteristik OCR dan ECAR, dua pengukuran dilakukan sebelum setiap injeksi obat dan dua di akhir percobaan. Karakteristik OCR berikut dihitung: OCR dasar sebagai titik waktu 1–5, OCR terkait ATP sebagai titik waktu 1–3, OCR respirasi maksimal sebagai 4–5, OCR kapasitas cadangan sebagai 4–2, dan kebocoran proton sebagai 3–5. Perhatikan bahwa keberadaan glukosa menurunkan OCR yang diukur, dan oleh karena itu, OCR basal dihitung tanpa adanya glukosa tambahan, dan OCR maksimal dihitung dengan adanya glukosa tambahan. Untuk ECAR, karakteristik berikut dihitung: ECAR dasar sebagai 1–5, ECAR kapasitas glikolat sebagai 3–5, dan ECAR cadangan glikolitik sebagai 3–2. Rasio OCR/ECAR dihitung sebagai OCR terkait ATP yang dibagi dengan ECAR glikolitik. Signifikansi statistik dihitung menggunakan uji Mann–Whitney–Wilcoxon, dan tingkat signifikansi ditetapkan pada 0,05.
2.12 Kuantifikasi translokase ADP/ATP yang ditargetkan melalui pemantauan reaksi paralel
2.12.1 Ekstraksi protein seluler
Untuk mengekstrak protein seluler, sel dicuci sekali dengan PBS, ditripsinasi, dinetralkan dengan media pertumbuhan, dipindahkan ke tabung Eppendorf, disentrifugasi (500 g , 5 menit pada suhu RT), dicuci 2x dalam PBS, dan disimpan pada suhu -80 °C. Sel kemudian dipanen dengan buffer lisis (1% SDC/50 mm Tris -Cl) dan disonikasi menggunakan Bioruptor (4 °C, 3–15 siklus, intensitas tinggi, 30 detik hidup/mati). Sisa serpihan sel dihilangkan dengan sentrifugasi (4 °C, 3000 g , 10 menit), dan konsentrasi protein diukur dengan uji BCA.
2.12.2 Kromatografi cair yang digabungkan dengan pemantauan reaksi paralel
Pelarut LC–MS dibeli dari Honeywell (Morris Plains, NJ, AS). Peptida ANT berlabel isotop sintetis dengan lisin ‘berat’ ( 13 C 6 15 N 2 ) atau arginin ( 13 C 6 15 N 4 ) (JPT Peptide Tech, Berlin, Jerman) dilarutkan kembali menggunakan 100 m m buffer trietilamonium bikarbonat, pH 8,5 (TEAB, Thermo Scientific, Rockford, IL, AS) untuk mendapatkan konsentrasi 2,5 pmol·μL −1 dan ditambahkan ke lisat sel RPE-1 sebelum pencernaan protein. Peptida berat ditambahkan ke 6 μg protein total sebagai berikut: 50 fmol dari setiap peptida ANT1, 100 fmol dari setiap peptida ANT2, dan 100 fmol dari setiap peptida ANT3. Pencernaan enzimatik protein diproses dalam 1% natrium deoksikolat (SDC)/100 m m TEAB. Sistein yang teroksidasi secara reversibel direduksi dengan 5 m m tris(2-karboksietil) fosfin hidroklorida pada suhu 60 °C selama 60 menit. Gugus tiol bebas dalam sistein yang tereduksi selanjutnya diblokir menggunakan 10 m m metil metanethiosulfonat pada suhu kamar selama 30 menit. Protein dicerna menggunakan rLys-C (Wako, Pure Chemical Industries, Osaka, Jepang) pada suhu 37 °C selama 3 jam, diikuti oleh pencernaan tripsin tingkat sekuensing (Promega, Madison, WI, AS) pada suhu 37 °C dengan rasio 1 : 50 (enzim/substrat) semalaman. Pencernaan dihentikan dengan penambahan asam trifluoroasetat (TFA) hingga mencapai konsentrasi akhir 1% (v/v), dan SDC yang diendapkan dihilangkan dengan ekstraksi dalam etil asetat jenuh air. Sampel dihilangkan garamnya pada kartrid SPE Empore C18-SD (3M, St. Paul, MN, AS), yang sebelumnya dikondisikan dengan metanol, dan diseimbangkan menggunakan 0,1% TFA dalam 5% AcN. Peptida dielusi dengan 0,05% TFA dalam 50% ACN dan diuapkan hingga kering.
Sampel protein yang dicerna diencerkan dalam 0,1% asam format (FA), 3% dimetilsulfoksida (DMSO), dan 0,4% asam asetat (HAc) hingga konsentrasi 1 μg·μL −1 dan disuntikkan ke Sistem RSLC biner UltiMate 3000 (Thermo Scientific, Bremen) dalam tiga replikasi teknis. Sistem analitis terdiri dari kolom analitis Halo Peptide ES-C18, 2,7 μm, 160 Å, 1,0 mm × 250 mm (Advanced Materials Technology, Wilmington, DE, AS). Peptida triptik dipisahkan dengan gradien linier dari 0,2% hingga 45% dari 0,1% asam format, 78% asetonitril (AcN), 0,4% HAc, dan 3% DMSO pada laju alir 68 μL·min −1 pada 55 °C selama 20 menit. Peptida disemprotkan ke spektrometer massa hibrida quadrupole-Orbitrap Q Exactive Plus menggunakan probe HESI-II (Thermo Scientific, Bremen) pada 3,0 kV. Spektrum MS ion positif diperoleh untuk m / z terpilih dalam jendela 3 menit yang ditentukan dengan target AGC 1 × 106 pada resolusi 35.000 dan waktu ion maksimum 110 ms. Jendela isolasi 2,0 m / z dan energi tumbukan ternormalisasi 28% digunakan.
2.12.3 Pengolahan data PRM
Catatan PRM survei diproses dalam Proteome Discoverer v. 3.0 (PD) untuk merancang file keluaran PD .msf dan .pdResult yang digunakan untuk membangun pustaka MS/MS di Skyline [ [ 43 ] ]. Tingkat penemuan palsu target (FDR) ditetapkan menjadi 0,01 untuk temuan peptida yang sangat yakin yang dihitung oleh Target Decoy PSM Validator. Prekursor monoisotopik (2 + ), ion y, dan b (1 + ) dipantau. Ion produk dipilih dari m / z > prekursor hingga 5 ion. Pengaturan peptida adalah sebagai berikut: tripsin [KR|P] sebagai protease, panjang urutan peptida 6–25 asam amino, pencocokan peptida berdasarkan perpustakaan dan filter, arginin berat ( 13 C 6 15 N 4 ) dan lisin ( 13 C 6 15 N 2 ) sebagai modifikasi isotop, tiometilasi residu sistein dan oksidasi metionin sebagai modifikasi struktural. Transisi peptida ANT target dan standar berlabel berat diekstraksi, dan total luas puncak peptida target dinormalisasi ke ekuivalen peptida berat sebagai rasio target-ke-berat. Setiap rasio dinyatakan sebagai rata-rata dari tiga replikasi teknis. Tingkat setiap isoform ANT ditentukan berdasarkan rasio target-ke-berat peptida terpilih dalam tiga replikasi biologis.
2.12.4 Pemilihan peptida ANT untuk pemantauan reaksi paralel
Karena ekspresi jaringan ANT4 terbatas, hanya ANT1, ANT2, dan ANT3 yang dipilih untuk identifikasi dalam sel RPE-1 dengan analisis μLC-PRM. Karena tingkat kesamaan urutan ANT1, ANT2, dan ANT3 yang tinggi, area unik pertama kali diprediksi berdasarkan penyelarasan urutan ganda yang dilakukan dalam clustal omega , seperti yang ditunjukkan pada Gambar S3A [ [ 44 ] ]. Dari kandidat peptida yang diidentifikasi, kami mengecualikan tiga peptida sinyal N-terminal (Tabel S2 ) yang rentan terhadap asetilasi (Gambar S3A ); lihat di bawah untuk detailnya. Selama evaluasi data percobaan dinamis penuaan akibat radiasi pengion (IRIS), kami juga mengecualikan satu peptida unik ANT2 (Tabel S2 ) karena oksidasi metionina buatan yang signifikan dari peptida standar (Gbr. S3B ) dan satu peptida unik ANT3 (Tabel S2 ) karena sinyal transisi yang tidak mencukupi (Gbr. S3C ) dan pergeseran RT (Gbr. S3D ). Peptida dengan pembelahan yang terlewat biasanya dikecualikan dari analisis massa target. Namun, dengan mempertimbangkan kurangnya peptida yang unik untuk ANT3, kami menyertakan peptida unik ANT3 yang salah dibelah IFRDEGGK. Meskipun ada satu pembelahan yang terlewat (IF R DEGGK), dalam kasus peptida ini, kami menemukan fragmentasi yang konsisten (Gbr. S3E ), sinyal yang stabil antara injeksi (Gbr. S3F ), waktu retensi yang dapat direproduksi, dan jumlah transisi yang efisien dalam kasus target dan peptida standar (Gbr. S3G ). Sebagai kesimpulan, kami mengukur ANT berdasarkan tiga peptida unik untuk ANT1 dan dua unik untuk ANT2 dan ANT3 selama perkembangan IRIS dalam RPE-1 (Tabel S1 ).
2.12.5 μ optimasi LC-PRM
Dalam analisis PRM awal, kami mencari injeksi optimal peptida RPE-1 untuk mencapai stabilitas sinyal dalam jendela waktu akuisisi 5 menit. Dalam percobaan awal, kami menyuntikkan 2, 4, dan 6 μg sampel kompleks yang dicampur dengan jumlah yang sama dari standar ANT berat (200 fmol). Kami mengamati tren peningkatan sinyal dari peptida ANT target dan standar (Gbr. S3I ) dan variabilitas yang lebih rendah dari luas puncak menuju muatan injeksi yang lebih tinggi (Gbr. S3J ). Oleh karena itu, injeksi 6 μg digunakan dalam percobaan lebih lanjut sebagai kompromi antara sinyal ion yang efisien dan konsumsi sampel yang wajar. Nilai default energi tumbukan yang dinormalisasi (NCE; 28%) adalah yang paling tepat untuk pemantauan ANT yang ditargetkan (Gbr. S3K ). Percobaan selanjutnya menilai konsentrasi yang tepat dari standar ANT berlabel ANT yang akan ditambahkan ke lisat RPE-1. Kami merancang rentang konsentrasi dari 10 hingga 1000 fmol untuk setiap standar yang dicampurkan ke dalam 6 μg lisat RPE-1. Untuk menghindari kelebihan muatan standar peptida berlabel ANT dibandingkan dengan target ANT, kami bertujuan untuk menggunakan konsentrasi peptida berlabel ANT yang tidak melebihi lima kali lipat dari level target ANT. Ini sesuai dengan konsentrasi peptida berlabel sebesar 50 fmol untuk ANT1 (Gbr. S3L ) dan 100 fmol untuk ANT2 dan ANT3 (Gbr. S3M,N ), masing-masing. Dengan mempertimbangkan jumlah peptida target yang rendah, kami mengurangi panjang LC-PRM dari 78 menjadi 35 menit untuk menghemat waktu instrumen, dan kami juga mempersempit jendela akuisisi 5 menit menjadi 3 menit. μ LC-PRM dengan durasi 35 menit menunjukkan variabilitas luas puncak yang sedikit lebih rendah tetapi luas puncak yang sebanding dengan standar ANT berat (Gbr. S3O,P ) bahkan setelah menggunakan resolusi yang lebih rendah dan waktu pengisian ion yang berkurang (35.000 dan 110 ms; Gbr. S3Q ).
2.13 Analisis LC–MS/MS 2D dari proteom pikun U87 setelah pengobatan temozolomide
2.13.1 Persiapan sampel
Pelet sel (lihat Bagian 2.12.1 ) dilisiskan dalam buffer lisis 3% SDC dalam 200 mm TEAB . Konsentrasi protein total ditentukan dalam semua sampel menggunakan uji protein BCA mikro (Thermo Fisher Sci, Rockford, IL, AS). Pencernaan protein secara enzimatik (50 μg) diproses dalam 100 mm TEAB . Ikatan disulfida direduksi dengan 5 mm tris (2-karboksietil) fosfina hidroklorida pada suhu 37 °C selama 30 menit, dan gugus tiol bebas diblokir menggunakan 10 mm metil metanetiosulfonat pada suhu kamar selama 10 menit. Untuk menghilangkan reagen kontaminan, 6 volume (~300 μL) aseton yang telah didinginkan sebelumnya ditambahkan, dan presipitasi protein dibiarkan berlangsung pada suhu −20 °C semalaman (O/N). Sampel disentrifugasi pada 12.000 g pada suhu 4 °C selama 10 menit, dan aseton didekantir tanpa mengganggu pelet. Pelet dibiarkan mengering selama 2 menit untuk membuang sisa aseton dan dilarutkan kembali dalam 50 μL TEAB 100 mm . Akhirnya, protein dicerna oleh campuran lysyl endopeptidase dan tripsin (Promega) pada rasio enzim-terhadap-protein 1 : 25 (b/b) pada suhu 37 °C semalaman. Setelah pencernaan, konsentrasi peptida total ditentukan menggunakan Fluorometric Peptide Assay (Thermo Fisher Scientific, Rockford, IL, AS) sesuai dengan petunjuk pabrik. Reagen label isobarik Tandem Mass Tag (TMT) 10-plex (Thermo Scientific, Rockford) dilarutkan dalam 20 μL AcN. Pelabelan isobarik peptida dibiarkan berlangsung pada suhu kamar selama 60 menit, dan reaksi dihentikan dengan 5% hidroksilamina sesuai dengan petunjuk pabrik. Peptida berlabel dalam jumlah yang sama (30 μg) dicampur ke multipleks TMT, dan sisa reagen dihilangkan dengan ekstraksi fase padat pada Kolom Spin Desalting Peptida (Thermo Fisher Scientific, Rockford) yang dikemas dengan fase terbalik C18 sesuai dengan petunjuk pabrik, dan multipleks TMT yang disiapkan diuapkan hingga kering.
2.13.2 Prafraksinasi pH tinggi
Multipleks TMT dilarutkan kembali dalam 2% AcN/10 mm NH 4 FA . Peptida dipisahkan menggunakan kolom XBridge BEH C18, 2,5 μm, 2,1 μm × 150 mm (Waters, Milford, MA, AS) dalam gradien linier fase mobil B (80% AcN/10 mm NH 4 FA ) pada laju alir 0,3 mL·menit −1 . Gradien berjalan dari 0% B ke 2% B dalam 2 menit, diikuti oleh 2% B ke 20% B dalam 9 menit, dari 20% B ke 50% B dalam 41 menit, dan dari 50% B ke 52% B dalam 5,5 menit. Secara total, waktu gradien adalah 57,5 menit. Fraksi-fraksi dikumpulkan ke dalam pelat polipropilena 96-sumur (Agilent Technologies) pada 45 detik dari interval 3,7 hingga 57,5 menit, menghasilkan 72 fraksi dalam volume 225 μL. Fraksi-fraksi yang dikumpulkan kemudian dirangkai menjadi 24 fraksi dan diuapkan hingga kering.
2.13.3 Kromatografi cair yang digabungkan dengan spektrometri massa tandem (nanoLC–MS/MS)
Fraksi yang terkumpul dilarutkan kembali dalam 0,1% asam trifluoroasetat (TFA), 2% asetonitril (AcN) dan disuntikkan pada Sistem UltiMate 3000 RSLCnano (Thermo Scientific, Bremen) dalam dua replikasi teknis. Sistem analitis terdiri dari kolom perangkap PepMap100 C18, 3 μm, 100 Å, 75 μm × 20 mm dan kolom analitis PepMap RSLC C18, 2 μm, 100 Å, 75 μm × 250 mm (keduanya dari Thermo Scientific, Bremen). Sampel dimuat ke kolom perangkap pada laju alir 5 μL·min −1 dari 0,1% TFA, 2% AcN selama 5 menit. Peptida tripsin dipisahkan dari fase mobil A (2% ACN/0,1% FA) dan B (80% ACN/0,1% FA), mulai dari 2% B hingga 34,5% B dalam 70 menit, diikuti oleh 34,5% B hingga 45% B dalam 10 menit pada laju alir 250 nL·min −1 . Peptida yang dielusi disemprotkan ke Exploris 480 menggunakan sumber ion NanoSpray Flex (NG) (Thermo Scientific, Bremen) pada tegangan semprot 1,8 kV selama 107 menit. Spektrum MS pemindaian penuh ion positif diperoleh dalam kisaran m / z 350–1400, pada resolusi 60.000 (pada m / z 200), nilai target AGC 300%, dan IT maksimum 25 ms. Antarmuka FAIMS Pro Duo dioperasikan pada nilai tegangan kompensasi −45 dan −60 V dan pada laju aliran gas 4,6 L·min −1 . Spektrum fragmentasi (MS/MS) diperoleh untuk 10 prekursor paling intens dalam mode TurboTMT. Jendela isolasi 1,3 m / z ( kesesuaian prekursor 70%) dan energi tumbukan ternormalisasi 35% digunakan. Setiap spektrum fragmentasi diperoleh pada resolusi 15.000 (pada m / z 200), dengan target AGC ternormalisasi 200% dan IT maksimum 34 ms. Massa pertama ditetapkan pada 110 m / z . Status muatan < 2 dan > 5 dikecualikan, dan pengecualian dinamis ditetapkan ke 17 detik setelah fragmentasi n = 1 kali.
2.13.4 Akuisisi dan evaluasi data
Spektrum MS dan MS/MS yang direkam diproses dan dicari dalam Proteome Discoverer 3.0 terhadap basis data protein referensi manusia UniProt yang telah ditinjau. Spesifisitas pencernaan tripsin dengan hingga dua pembelahan yang terlewat digunakan. Tiometilasi sistein ditetapkan sebagai modifikasi tetap, dan oksidasi metionina dan prolina dipilih sebagai modifikasi variabel. Toleransi massa dalam mode MS dan MS/MS dibiarkan pada nilai default untuk pencarian awal, dan 6 ppm ditetapkan sebagai toleransi massa dalam mode MS untuk pencarian utama. Laju penemuan palsu untuk identifikasi protein dibiarkan pada nilai default. File keluaran dari Proteome Discoverer diproses dalam lingkungan statistik Perseus dan R v. Intensitas ion reporter ditransformasikan ke log 2 , dan analisis ekspresi diferensial LIMMA [ [ 34 ] ] dilakukan dalam lingkungan statistik R dengan koreksi laju penemuan palsu (FDR) Benjamini–Hochberg pada tingkat signifikansi 0,05. Semua protein yang diukur diklasifikasikan menurut perbedaan signifikan antara kelompok kontrol dan kelompok yang diberi TMZ ( nilai- P BH FDR <0,05), dan penurunan/peningkatan regulasi berdasarkan nilai log 2 FC.
2.14 Analisis statistik
Pustaka SciPy Python 1.11.2 [ [ 45 ] ] digunakan untuk statistik. Signifikansi statistik data qPCR dihitung untuk log 2 (FC), yang memiliki distribusi normal; dengan demikian, uji – t digunakan. Uji Mann–Whitney–Wilcoxon digunakan untuk menghitung signifikansi statistik karakteristik OCR dan ECAR respirasi seluler. Signifikansi statistik untuk korelasi Pearson dan Spearman antara mRNA dan protein dihitung menggunakan fungsi ‘pearsonr’ dan ‘spearmanr’ dari pustaka SciPy 1.11.2 [ [ 45 ] ]. Nilai- P yang disesuaikan dihitung menggunakan prosedur Benjamini–Hochberg. Uji Mann–Whitney–Wilcoxon digunakan untuk menghitung signifikansi perubahan kadar protein ANT pada kelompok pasien yang ditentukan berdasarkan ukuran glioblastoma, karena distribusi dalam kelompok individu tidak normal. Uji Mann–Whitney–Wilcoxon digunakan untuk membandingkan distribusi koefisien korelasi mRNA-protein untuk semua protein dan protein mitokondria. Tingkat signifikansi ditetapkan pada 0,05 untuk uji statistik yang disebutkan di atas. Paket biokonduktor limma r digunakan untuk analisis statistik data mikroarray [ [ 34 ] ], dan tingkat signifikansi ditetapkan pada 0,01. Kadar ANT sel epitel pigmen retina manusia yang diabadikan dengan telomerase (RPE-1; IRIS) yang diobati dibandingkan dengan kontrol proliferatif dengan ANOVA dua arah pada tingkat signifikansi 0,05, diikuti oleh uji Dunn untuk beberapa perbandingan. Prisma graphpad 6 digunakan untuk ANOVA dan untuk konstruksi plot batang. Plot sebar dirancang menggunakan paket r ‘ ggplot2 ‘ [ [ 46 ] ]. Koefisien korelasi Spearman dan nilai- P digunakan untuk mengkarakterisasi korelasi kadar protein ANT dengan transkrip masing-masing, yang ditentukan menggunakan R default corr.test() [ [ 33 ] ]. Untuk analisis gen yang diekspresikan secara diferensial dalam sel MG U-87 setelah TMZ, tingkat signifikansi ditetapkan pada 0,05 dan ambang batas untuk log 2 FC ditetapkan pada 0,5. Besarnya nilai- P ditunjukkan dengan tanda bintang (*0,01 ≤ P ≤ 0,05; **0,001 ≤ P ≤ 0,01; ***0,0001 ≤ P ≤ 0,001; **** P ≤ 0,0001). Nilai- P yang lebih tinggi dari 5e-02 menunjukkan perubahan yang tidak signifikan; dengan demikian, mereka ditandai dengan ‘ns’.
3 Hasil
3.1 Perubahan tingkat transkrip ANTs dalam berbagai model in vitro penuaan sel dan lesi premaligna dan ganas
Mengingat bahwa ekspresi ANT2 secara aktif ditekan selama transisi dari fase pertumbuhan ke penuaan seluler secara in vitro oleh komponen jalur pensinyalan TGF-beta [ [ 11 , 17 , 19 , 47 ] ], kami bertujuan untuk memverifikasi apakah penurunan kadar transkrip ANT2 ini merupakan fenomena umum yang terkait dengan penuaan in vitro dan apakah itu juga terjadi dalam kondisi berbeda yang terkait dengan penuaan in vivo . Untuk tujuan ini, kami menganalisis kumpulan data profil ekspresi yang tersedia untuk umum dari berbagai jenis sel senesens (Tabel 1 ) untuk membandingkan perubahan dalam transkrip ANT1, ANT2, ANT3, dan ANT4 selama pembentukan penuaan seluler secara in vitro (Gbr. 1A ), dalam berbagai lesi premaligna dan ganas (Gbr. S1A ), dan dalam beberapa jenis tumor otak manusia (Gbr. 1B ). Analisis ini menunjukkan bahwa tingkat ekspresi isoform ANT1 ( SLC25A4 ), ANT2 ( SLC25A5 ), dan ANT3 ( SLC25A6 ) berubah dalam kondisi yang berbeda, tetapi tidak ada pola konsisten yang sesuai dengan temuan in vitro yang dapat dilihat dari data tersebut. Perhatikan bahwa tingkat mRNA ANT4 umumnya rendah dan tidak terpengaruh selama pembentukan penuaan.
Tabel 1. Daftar kumpulan data yang dianalisis untuk tingkat transkrip isoform ANT dalam penuaan seluler secara in vitro dan pada tumor jinak dan ganas manusia.

Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Perubahan dalam transkrip ANT dalam kumpulan data profil ekspresi yang tersedia untuk umum. Perubahan dalam transkrip ANT dalam sel kontrol dan sel pikun (A) dan dalam otak normal dan tumor otak (B) ditunjukkan dengan tingkat signifikansi statistiknya ( nilai- P ) yang diwakili oleh area titik-titik individual dan diberi kode warna dengan nilai perubahan lipatan (FC). Perubahan signifikan ( nilai- P < 0,05) ditandai dengan lingkaran hitam. (A, B) Statistik- t Bayes empiris yang dimoderasi digunakan untuk statistik. Kumpulan data pikun berisi 2 (E-MEXP-2683, E-MEXP-2283, E-GEOD-11954, E-GEOD-19864), 3 (E-GEOD-77239, E-GEOD-13712, GSE100014 ), 4 (E-GEOD-16058), dan 5 ( GSE35957 ) replikasi eksperimen. Dataset tumor otak berisi 8 sampel ( GSE13276 ), 127 ( GSE4290 ), dan 169 (E-GEOD-50161).
Dengan tersedianya data sekuensing sel tunggal dari pasien glioblastoma [ [ 35 ] ], kami menganalisis ekspresi isoform ANT individu dalam subpopulasi tumor. Seperti yang ditunjukkan pada Gambar S1B,C , ekspresi transkrip isoform ANT dalam tumor sangat heterogen. Sebagian sel turunan tumor mengekspresikan ketiga isoform ANT (Sel B yang membelah, OPC, OPC yang membelah, Astrosit yang belum matang, IPC dewasa/Neuron yang baru lahir; 22,9% sel). Khususnya, ada subpopulasi spesifik yang mengekspresikan secara dominan satu isoform (Neuron, Neuron yang membelah, CGE iN; ANT1 2,4%; ANT2 6,5%; ANT3 16,5%). Selain itu, kami menyelidiki apakah ekspresi ANT2 tumpang tindih dengan KI67 (MKI67), penanda proliferasi. Meskipun beberapa subpopulasi mengekspresikan kedua transkrip (12,4% sel), beberapa sel ANT2-positif bersifat KI67-negatif (Gbr. S1D ), menunjukkan bahwa ekspresi ANT2 mungkin tidak selalu berkorelasi dengan status proliferasi sel.
3.2 Korelasi transkrip isoform ANT dan tingkat protein pada glioblastoma dan kanker paru-paru
Temuan sebelumnya membawa kami untuk mempertanyakan apakah transkrip ANT dan kadar protein berkorelasi. Untuk memperjelas ini, kami menggunakan dataset analisis omik yang diterbitkan sebelumnya dari 99 pasien glioblastoma yang berisi data transkriptom dan proteom [ [ 38 ] ]. Kami mengidentifikasi 10.965 protein dengan kadar mRNA mereka (Gbr. 2A ). Pertama, kami melakukan korelasi umum dari protein yang diidentifikasi dengan kadar mRNA mereka. Korelasi Spearman median adalah 0,47 (Gbr. 2B dan untuk contoh mode korelasi mRNA/protein, lihat Gbr. S2A ). Protein mitokondria (dari basis data MitoCarta3.0 [ [ 41 ] ]) memiliki korelasi Spearman yang secara signifikan lebih rendah antara kadar transkrip dan protein dibandingkan dengan semua protein ( P = 2,88e-56, Gbr. 2B ). Korelasi median untuk protein mitokondria adalah 0,33. ANT termasuk protein mitokondria, dan seperti protein mitokondria lainnya, mereka memiliki korelasi yang buruk antara tingkat transkrip dan protein pada glioblastoma (korelasi Spearman: ANT1 0,5; ANT2 0,04; ANT3 0,01; perhatikan ANT4 tidak terdeteksi pada tingkat protein; Gambar. 2C dan Gambar. S2B ). Anehnya, ketiga protein ANT, tetapi bukan tingkat mRNA mereka, saling berkorelasi kuat di seluruh 99 sampel, yang menunjukkan sinkronisitas dalam mempertahankan tingkat protein mereka (Gambar. 2D dan Gambar S2C ). Data ini menunjukkan bahwa tingkat protein ANT mengikuti massa mitokondria. Memang, korelasi protein ANT dengan protein mitokondria lebih kuat dibandingkan dengan korelasi dengan semua protein (Gambar. 2E ). Protein yang paling berkorelasi dengan ANT adalah anggota lain dari kelompok SLC (SLC25A3, SLC30A9) dan reseptor impor membran mitokondria luar TOMM70. Lebih jauh, daftar korelasi terkuat dengan ANT1–3 sedikit berbeda. Akan tetapi, ketiga protein ANT juga berkorelasi kuat dengan sebagian besar protein membran internal dan eksternal mitokondria lainnya (TIMM50, TIMM29, TIMM22, TIMM21, TOMM22, dll.), subunit kompleks fosforilasi oksidatif yang dikodekan mitokondria (MT-ND1, MT-ND2, MT-ND4, MT-ND5, MT-ND6, MT-CYB, MT-CO1, MT-CO2, MT-CO3, MT-ATP6, dan MT-ATP8), dan protein yang mengatur dinamika mitokondria (seperti GDAP1, OPA1, IMMT, SNPH, MFN2, DNM1L, dan MFN1; Gambar S2D ).
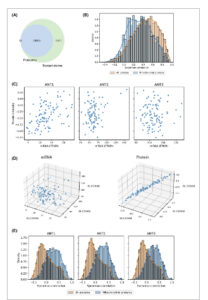
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Korelasi protein dan mRNA pada glioblastoma. (A) Diagram Venn untuk gen yang terekam dalam transkriptom dan proteom. (B) Distribusi korelasi mRNA-protein untuk semua gen dan protein mitokondria. Uji Mann–Whitney–Wilcoxon digunakan untuk statistik. (C) Plot sebar untuk ANT dengan tingkat transkrip (mRNA) pada sumbu x dan intensitas protein pada sumbu y . (D) Plot sebar 3D untuk tingkat transkrip ANT dan intensitas protein ANT. (E) Perbandingan distribusi korelasi protein ANT dengan semua protein dan dengan protein mitokondria.
Berikutnya, kami menyelidiki apakah ini adalah fenomena umum atau spesifisitas glioblastoma menggunakan dataset analisis omik yang diterbitkan sebelumnya dari 108 pasien dengan karsinoma paru sel skuamosa [ [ 39 ] ]. Secara keseluruhan, korelasi ANT mirip dengan glioblastoma. Tidak ada korelasi dekat antara transkrip dan kadar protein untuk isoform ANT (korelasi Spearman: ANT1 0,17; ANT2 0,25; ANT3 0,26; perhatikan ANT4 tidak terdeteksi pada kadar protein; Gambar S2E,F ), ketiga protein ANT saling berkorelasi kuat di seluruh 108 sampel (Gambar S2G,H ), dan protein ANT berkorelasi dengan massa mitokondria (Gambar S2I,J ). Lebih jauh, kami menanyakan apakah transkrip ANT dan kadar protein dikaitkan dengan keadaan klinikopatologis pasien glioblastoma (Gambar S2K ). Tingkat transkrip ANT2 dan ANT3 berkorelasi positif ringan dengan waktu dari diagnosis hingga kematian. Ketiga ANT berkorelasi positif lemah dengan ukuran tumor pada tingkat protein, yang menunjukkan peran suportif metabolisme energetik pada pertumbuhan tumor. Perhatikan bahwa Sistem Pementasan Kanker Komite Gabungan Amerika (AJCC) digunakan untuk menentukan kategori ukuran tumor dalam kumpulan data. Glioblastoma dalam kategori T4 (mengandung tumor lebih besar dari 7 cm) memiliki tingkat intensitas protein ANT yang secara signifikan lebih tinggi daripada kategori lainnya (Gbr. S2L ). Untuk karsinoma paru, tidak ada cukup titik data untuk uji statistik dalam kategori T4 (hanya 2 kasus), tetapi tren menunjukkan ketergantungan yang sama seperti untuk glioblastoma (Gbr. S2M ). Sebagai kesimpulan, data ini menunjukkan tidak ada korelasi erat antara tingkat transkrip dan protein untuk isoform ANT pada glioblastoma dan karsinoma paru. Dalam kedua kumpulan data, ketiga protein ANT saling berkorelasi kuat dan berkorelasi dengan massa mitokondria, seperti protein yang mengatur dinamika mitokondria dan mesin impor mitokondria.
3.3 Pengembangan penentuan kadar protein relatif ANT menggunakan spektrometri massa menunjukkan adanya peralihan antara isoform ANT1 dan ANT2 selama perkembangan penuaan akibat radiasi.
Berdasarkan nonkorelasi antara transkrip ANT dan kadar protein dan kurangnya antibodi yang spesifik untuk ketiga isoform ANT1–3, kami bertujuan untuk mengembangkan pendekatan yang cepat dan andal untuk menentukan kadar relatif isoform protein ANT individu dalam lisat protein sel. Untuk tujuan ini, kami menggunakan metode spektrometri massa berdasarkan kromatografi cair mikrobore yang digabungkan dengan pemantauan reaksi paralel ( μ LC-PRM). Karena ekspresi jaringan ANT4 yang terbatas, hanya ANT1, ANT2, dan ANT3 yang dipilih untuk identifikasi dengan analisis μ LC–MS/MS. Secara singkat, kami memilih tiga peptida yang unik untuk ANT1 dan dua yang unik untuk ANT2 atau ANT3 untuk deteksi spesifik protein ANT (Gbr. S3A dan Tabel S1 ). Kami melakukan analisis dasar untuk pemilihan peptida rasional untuk mengecualikan peptida yang tidak sesuai dari sudut pandang analitis (Gbr. S3B–H ). Kami mengoptimalkan analisis μ LC–MS/MS dari sel RPE-1 dan membuktikan bahwa ANT1, ANT2, dan ANT3 dapat dibedakan berdasarkan peptida unik ini bahkan dengan latar belakang lebih dari 1700 protein yang diidentifikasi dalam 6 μg lisat RPE-1 (Gbr. S3I–K ). Akhirnya, konsentrasi peptida berlabel berat ANT didefinisikan sebagai pengoptimalan metode μ LC-PRM (Gbr. S3L–Q ).
Untuk memvalidasi kegunaan μ LC-PRM, kami mengikuti perubahan dinamis pada tingkat protein isoform ANT menggunakan model mapan dari penuaan yang diinduksi radiasi pengion (IRIS) pada sel RPE-1 manusia yang diabadikan telomerase. Untuk tujuan ini, sel RPE-1 diekspos ke 20 Gy untuk menginduksi IRIS, seperti yang dijelaskan sebelumnya [ [ 25 , 48 ] ]. Setelah IR, sel RPE-1 kontrol dan yang diradiasi dipanen pada hari ke-2, 4, 8, 16, dan 32, dan tingkat transkrip dan protein ANT ditentukan menggunakan RT-PCR dan μ LC-PRM, masing-masing. Perkembangan fenotipe senescent dikonfirmasi oleh penentuan peningkatan aktivitas β-galaktosidase terkait penuaan (SA-β-gal) dan tidak adanya proliferasi sel dalam uji penggabungan EdU pada hari ke-14 (Gbr. S3R,S ). Seperti yang ditunjukkan pada Gambar 3A , tingkat mRNA ANT2 menurun secara signifikan selama perkembangan IRIS sesuai dengan pemeriksaan mRNA ANT2 sebelumnya sebagai respons terhadap induksi ketenangan dan penuaan yang disebabkan oleh stres oksidatif [ [ 11 , 17 ] ]. Sebaliknya, mRNA ANT1 berubah secara signifikan hanya pada titik waktu terakhir yang diamati, 32 hari setelah IR. Tingkat mRNA ANT3 tidak menunjukkan tren yang tegas, karena kami mengamati peningkatan yang signifikan (D4) tetapi juga penurunan (D8 dan D32) dibandingkan dengan kontrol yang berproliferasi.
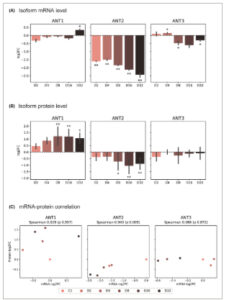
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Peralihan sebagian level protein ANT2 dengan ANT1 selama perkembangan IRIS. (A) mRNA ANT yang dideteksi oleh qPCR dan (B) level protein yang dideteksi oleh μ LC-PRM ditentukan dalam sel RPE-1 IRIS hingga 32 hari setelah radiasi γ (D2–D32) dan dibandingkan dengan kontrol (C1; berkembang biak) RPE-1. Setiap mRNA atau protein ANT dinyatakan sebagai rata-rata perubahan log 2 kali lipat antara RPE-1 yang diobati dan yang berkembang biak yang dihitung dari tiga replikasi biologis. Kesalahan standar digambarkan sebagai batang kesalahan. Perubahan protein yang signifikan selama perkembangan IRIS ditunjukkan dengan tanda bintang (* P ≤ 0,05, ** P ≤ 0,01). (C) Korelasi perubahan log 2 kali lipat mRNA ANT dan level protein. Koefisien korelasi Spearman ( Spearman ) dan nilai- P ditunjukkan. (A) Uji- t satu sampel , (B) ANOVA dua arah diikuti oleh uji Dunn untuk beberapa perbandingan, dan (C) koefisien korelasi peringkat Spearman digunakan untuk statistik.
Analisis μLC -PRM dari peptida isoform ANT (Gambar 3B dan Gambar S3T ) menunjukkan bahwa sinyal ANT2 terus menurun selama perkembangan IRIS, dengan penurunan tertinggi diamati 32 hari setelah IR. Sebaliknya, kadar protein ANT1 meningkat secara signifikan pada hari ke-8 setelah IR dibandingkan dengan sel RPE-1 yang berproliferasi. Tidak ada perubahan signifikan pada kadar protein ANT3 yang diamati selama perkembangan IRIS hingga 32 hari sesuai dengan kadar transkrip ANT3.
Selama perkembangan IRIS, korelasi antara transkrip ANT dan kadar protein menunjukkan kesesuaian yang rendah antara kadar mRNA dan protein untuk ANT1 dan ANT3. Sebaliknya, ANT2 menunjukkan penurunan regulasi yang signifikan pada kadar mRNA dan protein pada hari ke-16 dan ke-32 perkembangan IRIS. Dengan demikian, konsisten dengan analisis kami terhadap data pasien, perubahan kadar protein tidak berkorelasi dengan perubahan kadar transkrip (Gbr. 3C ).
Sebagai kesimpulan, μ LC-PRM terbukti menjadi metode yang tepat untuk memantau perubahan isoform protein ANT. Dengan bantuannya, kami menemukan bahwa IRIS disertai dengan penurunan ANT2 tetapi peningkatan kadar protein ANT1, yang dalam kasus ANT1 tidak diikuti oleh peningkatan kadar mRNA ANT1.
3.4 Sel RPE-1 pikun yang diinduksi radiasi menunjukkan fenotipe hipermetabolik
Kami selanjutnya menanyakan apakah perubahan pada tingkat protein isoform ANT selama IRIS akan tercermin dalam perubahan metabolisme energi. Jadi, kami memaparkan sel pada dosis tunggal IR 20 Gy dan membiarkan IRIS berkembang selama 14 hari. Kami memverifikasi perubahan pada peningkatan protein ANT1, penurunan protein ANT2, dan sedikit perubahan pada ANT3 oleh μ LC-PRM (Gbr. 4A ). Dalam kasus ini, kami juga menentukan tingkat protein ANT1 dan ANT2 menggunakan imunoblotting menggunakan antibodi yang tersedia secara komersial terhadap ANT1 dan ANT2 dan memperoleh hasil yang sama seperti dengan μ LC-PRM (Gbr. 4B ; spesifisitas antibodi ANT1 dan ANT2 divalidasi oleh interferensi RNA, lihat Gbr. S4A–C ). Seperti pada percobaan IRIS sebelumnya, kami memperoleh hasil yang sama saat mengukur tingkat transkrip isoform ANT (Gbr. 4C ). Perkembangan fenotipe IRIS dikonfirmasi oleh penentuan aktivitas SA-β-gal yang meningkat (Gbr. S4D ).
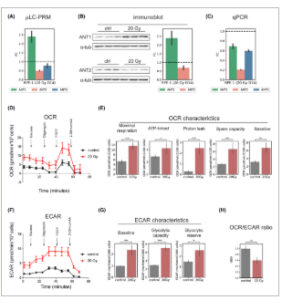
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Parameter metabolik sel IRIS RPE-1. Kadar protein ANT1, ANT2, dan ANT3 (A) yang dideteksi oleh μ LC-PRM, (B) kadar protein yang dideteksi oleh imunoblotting, dengan α-tubulin sebagai kontrol pemuatan, dan (C) kadar transkrip yang dinormalisasi ke β-aktin yang dideteksi oleh qPCR ditentukan untuk sel IRIS RPE-1 14 hari (D14) setelah radiasi γ (20 Gy) dan untuk kontrol proliferasi. Perubahan lipatan rata-rata antara perlakuan dan proliferasi RPE-1, dihitung dari tiga replikasi eksperimen, ditunjukkan. Kesalahan standar digambarkan sebagai batang kesalahan. Pada kondisi eksperimen yang sama, analisis glikolisis dan OXPHOS menggunakan penganalisa Seahorse pada sel IRIS RPE-1 (20 Gy; D14; tiga replikasi biologis) dilakukan. (D) laju konsumsi oksigen (OCR) dan karakteristik turunannya (E) bersama dengan laju pengasaman ekstraseluler (ECAR) (F) dan karakteristiknya (G) ditunjukkan. (H) Rasio OCR/ECAR menunjukkan ketergantungan pada glikolisis atau fosforilasi oksidatif. (D–H) Rata-rata yang diperoleh dari setidaknya tiga replikasi eksperimen dengan kesalahan standar ditunjukkan. (E, G, H) Uji Mann–Whitney–Wilcoxon digunakan untuk statistik.
Bersamaan dengan itu, perubahan dalam fenotipe metabolik seluler, seperti yang diwakili oleh laju konsumsi oksigen (OCR) dan laju pengasaman ekstraseluler (ECAR), ditentukan dalam sel-sel yang berkembang biak dan sel-sel pikun mereka menggunakan penganalisa metabolik waktu nyata Seahorse. Pengukuran OCR (Gbr. 4D,E ) menunjukkan peningkatan yang signifikan dalam respirasi dasar dan maksimal dalam sel-sel IRIS. Menariknya, sel-sel pikun menunjukkan peningkatan kebocoran proton, yang dapat mengindikasikan kerusakan mitokondria. Pengukuran ECAR (Gbr. 4F,G ) menunjukkan peningkatan glikolisis basal dan kapasitas glikolisis setelah induksi pikun. Secara keseluruhan, kami mengamati peningkatan OCR dan peningkatan yang lebih substansial dalam ECAR, yang menunjukkan pergeseran ke arah glikolisis dalam model IRIS (Gbr. 4H ).
Kesimpulannya, pengukuran OCR dan ECAR menunjukkan fenotipe hipermetabolik pada sel-sel pikun yang dipicu radiasi.
3.5 Peningkatan kadar protein ANT1 merupakan ciri umum perkembangan penuaan
Bahasa Indonesia: Untuk mengonfirmasi apakah perubahan dalam kadar ANT merupakan fitur umum sel-sel pikun, kami menganalisis beberapa jenis pikun tambahan dalam sel-sel normal, tidak bertransformasi, dan kanker. Secara khusus, kami memeriksa: (a) fibroblas kulit manusia normal BJ yang diinduksi menjadi pikun yang diinduksi obat (DIS) oleh docetaxel (DTX); (b) fenotip seperti pikun dalam sel-sel RPE-1 yang diinduksi oleh ekspresi ektopik yang diatur doksisiklin (DOX) dari penghambat protein CDK p21 waf1 (p21) atau p16 INK4A (p16; [ [ 25 , 26 ] ]); dan (c) fenotip seperti pikun dalam dua lini sel glioblastoma, U-87 MG dan A-172, yang diinduksi oleh obat antikanker temozolomide (TMZ). Pembentukan pikun divalidasi oleh uji SA-β-Gal (Gbr. S5A–E ). Selain itu, penuaan seluler pada sel RPE-1 dibandingkan dengan masa istirahat yang disebabkan oleh penghambatan kontak.
Dalam semua populasi sel pikun dan diam, analisis μ LC-PRM mengungkapkan peningkatan kadar protein ANT1 yang terkait dengan sel yang tidak diobati. Namun, ANT2 dan ANT3 menunjukkan perubahan yang berbeda tergantung pada jenis sel dan penginduksi penuaan (Gbr. 5A ). Perhatikan bahwa analisis sel IRIS RPE-1 yang sudah disajikan (20 Gy; D14) ditampilkan lagi untuk perbandingan yang lebih mudah dari semua model pikun. Imunoblotting menggunakan antibodi yang tersedia secara komersial mengonfirmasi perubahan kadar protein ANT1 dan ANT2 (Gbr. S5F ). Khususnya, transkrip ANT yang ditentukan oleh RT-qPCR (Gbr. 5B ) sekali lagi tidak mencerminkan kadar isoform protein ANT di semua model. Analisis korelasi antara tingkat protein yang diukur dengan μ LC-PRM dengan mRNA yang ditentukan oleh RT-qPCR menunjukkan korelasi lemah yang tidak signifikan untuk ANT1 (Spearman 0,250, P = 0,589) dan korelasi signifikan yang kuat untuk ANT2 (Spearman 0,821, P = 0,023) dan ANT3 (Spearman 0,857, P = 0,014; Gambar 5C ).
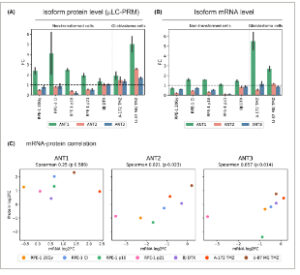
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Perubahan pada protein ANT1, ANT2, dan ANT3 serta tingkat transkrip dalam berbagai jenis penuaan seluler. Tingkat protein ANT1, ANT2, dan ANT3 (A) yang dideteksi oleh μ LC-PRM dan (B) tingkat transkrip yang dinormalisasi ke tingkat transkrip β-aktin yang dideteksi oleh qPCR ditentukan dalam berbagai model penuaan dan kontrol proliferasi yang sesuai. Rata-rata perubahan lipatan antara perlakuan dan kontrol proliferasi, dihitung dari tiga replikasi eksperimen, ditunjukkan. (A, B) Data sel IRIS RPE-1 (20 Gy; D14) dari Gambar 4A,C ditunjukkan lagi untuk memudahkan perbandingan semua model penuaan. Batang galat mewakili galat standar. (C) Korelasi log 2 kali lipat perubahan mRNA ANT dan tingkat protein dihitung. Koefisien korelasi Spearman (Spearman) dan nilai- P ditunjukkan. Model yang diuji meliputi inhibisi kontak (RPE-1 CI), IRIS (RPE-1 20 Gy), ekspresi berlebih p16 dan p21 CDK-inhibitor (RPE-1 p16 dan RPE-1 p21) dalam sel RPE-1, penuaan dini yang diinduksi docetaxel dalam fibroblas BJ normal (BJ DTX), dan penuaan dini yang diinduksi TMZ dalam lini sel glioblastoma (A-172 TMZ dan U-87 MG TMZ), dihitung dari tiga replikasi eksperimental. Koefisien korelasi peringkat Spearman digunakan untuk statistik.
Sebagai kesimpulan, analisis μ LC-PRM menunjukkan peningkatan kadar protein ANT1 selama pembentukan penuaan sel pada semua jenis penuaan yang diuji. Pada saat yang sama, ANT2 dan ANT3 menunjukkan perubahan yang bervariasi tergantung pada jenis penuaan. Peningkatan kadar protein ANT1 tidak diikuti secara dekat oleh peningkatan kadar transkrip ANT1.
3.6 Peningkatan aktivitas metabolisme sel-sel pikun berkorelasi dengan peningkatan kadar total protein ANT
Karena kami menunjukkan bahwa sel-sel IRIS RPE-1 mengungkapkan fenotipe hipermetabolik, selanjutnya, kami menentukan perubahan dalam fenotipe metabolik seluler (OCR dan ECAR) untuk sel-sel yang berkembang biak dan sel-sel yang dihambat pertumbuhannya di seluruh model yang diuji (lihat Gambar S6A, B untuk profil OCR dan ECAR, masing-masing, dan Gambar S6C, D untuk karakteristik metabolik turunan). Mirip dengan IRIS RPE-1, sel-sel pikun A-172 TMZ, dan U-87 TMZ menunjukkan peningkatan karakteristik OCR sebagai garis dasar, respirasi terkait ATP, respirasi maksimal, kapasitas cadangan, dan peningkatan kebocoran proton dibandingkan dengan kontrol proliferasi, sedangkan RPE-1 p21 dan BJ DTX menunjukkan peningkatan signifikan dalam beberapa karakteristik OCR yang diikuti. Khususnya, sel-sel RPE-1 p16 menunjukkan penurunan signifikan respirasi terkait ATP, respirasi maksimal, dan karakteristik OCR kapasitas cadangan. Selain itu, semua model penuaan (A-172 TMZ, U-87 TMZ, BJ DTX, dan RPE-1 p21) kecuali RPE-1 p16 menunjukkan peningkatan kapasitas glikolisis secara signifikan, serupa dengan yang diamati pada IRIS RPE-1. Perubahan pada karakteristik ECAR lainnya bervariasi. Analisis sel RPE-1 yang tidak aktif menunjukkan peningkatan respirasi maksimal, kebocoran proton, dan kapasitas cadangan dibandingkan dengan kontrol proliferasi, tren serupa seperti yang diamati pada IRIS RPE-1. Sebaliknya, sel RPE-1 yang tidak aktif menunjukkan penurunan kapasitas dasar dan glikolisis dibandingkan dengan kontrol.
Mengenai pemanfaatan OXPHOS mitokondria versus glikolisis sebagai sumber energi seluler, penghambatan kontak RPE-1, penuaan dini yang diinduksi p21, dan sel glioblastoma yang diobati dengan TMZ menunjukkan pergeseran signifikan secara keseluruhan ke arah metabolisme fosforilasi oksidatif (OXPHOS). Sebaliknya, penuaan dini yang diinduksi RPE-1 IRIS dan p16 menyebabkan pergeseran signifikan ke arah glikolisis sebagai sumber energi seluler (Gbr. S6E ).
Karena analisis bioinformatika kami mengungkap hubungan antara kadar protein ANT dan massa mitokondria, kami mengantisipasi korelasi antara kadar protein ANT dan OCR. Memang, perubahan lipatan gabungan ANT menunjukkan korelasi yang kuat (korelasi Spearman 0,929, P = 2,52e-03) dengan perubahan OCR, yang menunjukkan bahwa peningkatan protein ANT selama pembentukan penuaan seluler menyebabkan peningkatan laju konsumsi oksigen (Gbr. 6A ). Ketika dianalisis secara individual (Gbr. S6F ), kadar protein ANT1 tidak berkorelasi dengan OCR, sedangkan kadar ANT2 dan ANT3 menunjukkan korelasi yang kuat (korelasi Spearman 0,786, P = 0,036 dan korelasi Spearman 0,857, P = 0,014, berturut-turut). Menariknya, hasil kami menunjukkan bahwa ECAR tidak berkorelasi dengan protein ANT individu (Gbr. S6G ) atau protein ANT gabungan (Gbr. 6B ). Karena kami mengamati peningkatan OCR kebocoran proton pada sel-sel pikun, kami membandingkan kadar ANT dengan OCR kebocoran proton. Namun, baik perubahan protein ANT individual maupun total tidak berkorelasi secara signifikan dengan perubahan OCR kebocoran proton (Gbr. 6C dan Gbr. S6H ).

Gbr. 6
Buka di penampil gambar
Kekuatan Gambar
Korelasi perubahan protein ANT yang dideteksi oleh μ LC-PRM dan OCR respirasi maksimal. Kadar protein ANT diukur dalam RPE-1 yang tenang (inhibisi kontak; CI) dan berbagai model penuaan (IRIS RPE-1; 20 Gy), ekspresi berlebih penghambat CDK (p16) dan (p21) dalam sel RPE-1, penuaan yang diinduksi docetaxel (DTX) dalam fibroblas BJ normal dan penuaan yang diinduksi TMZ dalam lini sel glioblastoma A-172 dan U-87 MG. Perubahan lipatan gabungan kadar protein ANT dikorelasikan dengan OCR respirasi maksimal (A), ECAR kapasitas glikolisis (B), dan OCR kebocoran proton (C). Koefisien korelasi Spearman ( Spearman ) dan nilai- P yang dihitung dari tiga replikasi eksperimen ditunjukkan. (A–C) Koefisien korelasi peringkat Spearman digunakan untuk statistik.
Kesimpulannya, sel-sel yang menua meningkatkan aktivitas metabolismenya secara keseluruhan. Perubahan kumulatif pada kadar protein ANT sesuai dengan perubahan laju konsumsi oksigen setelah induksi penuaan.
3.7 Massa mitokondria dan kadar protein ANT meningkat pada garis sel glioblastoma setelah penuaan yang diinduksi temozolomide
Untuk menyelidiki efek yang lebih luas dari induksi penuaan pada perubahan proteom seluler, kami menganalisis seluruh proteom dari garis sel glioblastoma manusia (U-87 MG) sebelum dan setelah pengobatan dengan TMZ (100 μ m ) menggunakan kromatografi cair dua dimensi yang digabungkan dengan analisis spektrometri massa yang bergantung pada data (LC–MS/MS 2D). Seribu enam ratus empat puluh sembilan protein mengalami peningkatan regulasi dalam proteom sel U-87 MG yang diinduksi TMZ. Pada saat yang sama, 829 protein mengalami penurunan regulasi setelah mengobati sel dengan TMZ setelah 14 hari paparan. Di antara ini, ANT1, ANT2, dan ANT3 serta protein yang dikode genom mitokondria (MT-ND1, MT-ND2, MT-ND4, MT-ND5, MT-ND6, MT-CYB, MT-CO1, MT-CO2, MT-CO3, MT-ATP6, MT-ATP8) menunjukkan peningkatan regulasi yang signifikan (Gbr. 7A ). Perhatikan bahwa ANT4 tidak terdeteksi. Selain itu, semua protein yang dianalisis terkait dengan dinamika mitokondria (GDAP1, DNM1L, OPA1, MFN1, MFN2, IMMT) dan protein membran mitokondria (TOMM70, TOMM40, TOMM22, TOMM20, TOMM5, TIMM50, TIMM44, TIMM29, TIMM23, TIMM22, TIMM21, TIMM13, TIMM10, TIMM9, TIMM8A) mengalami peningkatan regulasi, dengan sebagian besar menunjukkan perubahan signifikan (Gbr. 7A ). Seperti dalam kasus dataset glioblastoma dan karsinoma paru, korelasi protein ANT lebih kuat dengan protein mitokondria (dari MitoCarta3.0) dibandingkan dengan semua protein (Gbr. 7B ). Protein ANT bahkan berkorelasi kuat dengan sebagian besar protein mitokondria. Khususnya, interkorelasi antara protein ANT berbeda antara sel kontrol U-87 MG dan sel pasca-TMZ (Gbr. 7C ). Pada sel kontrol U-87 MG, ANT1 menunjukkan korelasi positif yang kuat dengan ANT2 dan korelasi negatif yang kuat dengan ANT3. Akan tetapi, ANT2 dan ANT3 tidak berkorelasi pada sel kontrol. Sebaliknya, pada sel pasca-TMZ, ketiga ANT menunjukkan interkorelasi positif yang kuat, serupa dengan pengamatan kami pada kumpulan data pasien glioblastoma. Dengan mempertimbangkan ekspresi ANT1, ANT2, dan ANT3 yang diinduksi TMZ, dan menurut hasil μ LC-PRM kami, interkorelasi yang kuat diinduksi oleh peningkatan semua ANT bersamaan dengan peningkatan massa mitokondria total.
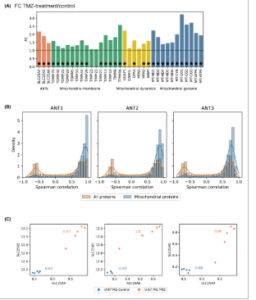
Gbr. 7
Buka di penampil gambar
Kekuatan Gambar
Analisis proteomik sel U-87 MG yang terpapar TMZ. (A) Perubahan protein ANT dan protein membran mitokondria, dinamika mitokondria, dan genom mitokondria setelah pengobatan TMZ. Tanda bintang menunjukkan signifikansi statistik menurut statistik t yang dimoderasi Empiris Bayes . (B) Korelasi Spearman protein ANT dengan semua protein dan protein mitokondria. (C) Korelasi Pearson antara protein ANT individual dalam sel U-87 MG kontrol dan sel pasca-TMZ. Data dihitung dari lima replikasi eksperimen, dan setiap titik mewakili satu replikasi eksperimen.
Kesimpulannya, protein ANT berkorelasi secara signifikan dengan protein mitokondria. Sebagai respons terhadap pengobatan TMZ, peningkatan kadar protein ANT terjadi bersamaan dengan peningkatan massa mitokondria.
4 Diskusi
Translokase ATP/ADP bertanggung jawab untuk mengangkut ATP dan ADP melintasi membran mitokondria, memainkan peran penting dalam metabolisme energi seluler. Meskipun isoform ANT1, ANT2, dan ANT3 berbagi hampir 90% dari struktur primer, beberapa laporan menunjukkan mereka memiliki fungsi yang berbeda. Secara khusus, ANT1 dan ANT3 memfasilitasi pertukaran ATP yang diproduksi mitokondria untuk ADP sitosol selama fosforilasi oksidatif dalam sel-sel yang berdiferensiasi. Sebaliknya, ANT2 dikaitkan dengan metabolisme glikolitik, karakteristik sel normal dan kanker yang sedang tumbuh. Peran spesifik ANT2 yang diusulkan adalah pengangkutan ATP ke dalam mitokondria sebagai ganti ADP [ [ 49 ] ]. Di luar pengangkutan ATP/ADP, bukti yang muncul menunjukkan bahwa ANT individu memiliki peran tambahan, termasuk fungsi yang berlawanan dalam mengatur kematian sel. Sementara ANT2 menunjukkan aktivitas anti-apoptosis, ekspresi berlebihan ANT1 dan ANT3 menyebabkan hilangnya potensial membran mitokondria dan aktivasi kaspase [ [ 17 ] ]. Perlu dicatat, penekanan ANT1 dan ANT2 baru-baru ini dikaitkan dengan transisi selular menuju penuaan [ [ 17 , 20 ] ], yang menunjukkan bahwa ANT berperan dalam perubahan metabolisme energi yang terkait dengan timbulnya penuaan selular.
Penelitian sebelumnya menunjukkan bahwa komponen jalur pensinyalan TGF-beta secara aktif menekan transkripsi ANT2 selama induksi kondisi penekan pertumbuhan in vitro [ [ 47 ] ], termasuk penuaan sel [ [ 17 ] ]. Namun, analisis sembilan set data transkriptom dari sel-sel senesens in vitro yang berbeda yang diperoleh dari basis data yang tersedia untuk umum mengonfirmasi penurunan kadar transkrip ANT2 pada sel-sel senesens hanya dalam dua kondisi: penuaan yang diinduksi erlotinib pada sel epitel bronkial manusia normal (NHBE) dan penuaan replikatif sel endotel arteri koroner manusia (HCAEC). Menariknya, analisis transkriptom tumor jinak manusia, di mana keberadaan sel-sel senesens diasumsikan, tidak secara konsisten menunjukkan penurunan kadar transkrip ANT2 di semua jenis yang dianalisis, kecuali untuk adenoma usus besar. Khususnya, perbedaan signifikan pada kadar transkrip diamati pada ketiga isoform ANT dibandingkan dengan jaringan normal mengenai peningkatan regulasi dan penurunan regulasi untuk ketiga isoform ANT. Pola serupa muncul saat memeriksa berbagai jenis tumor otak.
Mengingat bahwa tingkat transkrip dan protein tidak selalu menunjukkan korelasi positif (lihat, misalnya, [ [ 22 ] ]), kami menganalisis dua set data di mana transkriptom dan proteom diukur secara bersamaan [ [ 38 , 39 ] ]. Secara khusus, kami mengkorelasikan tingkat transkrip dan protein ANT1, ANT2, dan ANT3. Dalam set data glioblastoma, kami mengamati korelasi sedang untuk ANT1, sedangkan pada karsinoma paru, korelasi untuk ANT2 dan ANT3 lemah. Menariknya, data μ LC-PRM kami dari model senescent mengungkapkan korelasi yang kuat antara ANT2 dan ANT3. Perlu dicatat bahwa korelasi antara mRNA dan kelimpahan protein dalam studi skala besar umumnya sedang, dan salah satu faktor yang memengaruhi korelasi ini mungkin adalah tantangan reproduktifitas yang terkait dengan pengukuran protein dan transkrip [ [ 50 ] ]. Temuan ini menggarisbawahi bahwa tingkat protein ANT tidak selalu mencerminkan tingkat transkripnya.
Kami mengeksplorasi korelasi lebih lanjut dalam kedua set data untuk memahami mekanisme pengaturan yang mengatur kadar isoform ANT individu. Sebuah temuan mengejutkan muncul: kadar ketiga isoform ANT secara konsisten dipertahankan dalam proporsi terhadap total proteom pada glioblastoma dan karsinoma paru-paru. Selain itu, kadar protein ANT menunjukkan korelasi positif dengan sebagian besar protein mitokondria, seperti komponen yang dikodekan mitokondria dari rantai fosforilasi oksidatif, protein yang terlibat dalam mengatur dinamika mitokondria, dan protein membran mitokondria bagian dalam dan luar, termasuk sistem transportasi untuk penggabungan protein mitokondria. Korelasi ini menunjukkan bahwa ukuran kompartemen mitokondria memainkan peran penting dalam menentukan kadar protein ANT. Pertanyaan tentang bagaimana proses ini terkait secara mekanistis memerlukan penelitian lebih lanjut.
Menariknya, tidak seperti jaringan otak normal di mana rasio kadar protein di antara isoform ANT individu mengikuti urutan dari tertinggi ke terendah (ANT1 ke ANT3 dan ANT2), glioblastoma dan karsinoma paru-paru menunjukkan rasio yang bervariasi. Namun, variabilitas ini secara konsisten berkorelasi dengan massa mitokondria, yang menyiratkan bahwa isoform ANT individu dapat dipertukarkan untuk mempertahankan kapasitas transpor ATP/ADP secara keseluruhan. Penjelasan alternatif untuk fenomena ini bisa jadi adalah heterogenitas populasi sel jaringan tumor. Khususnya, tren serupa diamati dalam analisis sel MG U-87 pikun yang diinduksi temozolomide. Ketiga isoform ANT berkorelasi dengan massa mitokondria, dinamika, dan mesin impor. Lebih jauh, dalam sel pasca-TMZ, ketiga isoform ANT menunjukkan interkorelasi yang kuat.
Lebih jauh, kami meneliti hubungan antara kadar isoform ANT individual dan karakteristik klinikopatologis pasien individu dengan glioblastoma dan kanker paru-paru. Dalam kedua kasus, peningkatan kadar ANT berkorelasi dengan ukuran tumor pada saat diagnosis. Selain itu, mRNA ANT2 berkorelasi positif dengan waktu dari diagnosis hingga kematian. Namun, dalam kasus glioblastoma, ukuran tumor tidak berkorelasi positif dengan indikator prognosis buruk seperti skor Eastern Cooperative Oncology Group Performance Status (ECOG), skor KP, dan jumlah hari dari diagnosis hingga kematian. Temuan ini sulit ditafsirkan. Salah satu kemungkinan penjelasannya adalah bahwa pertumbuhan glioblastoma yang kompak dan kurang menyebar memungkinkan pengangkatan bedah yang lebih efisien, yang menyebabkan kekambuhan penyakit yang tertunda. Secara bersamaan, tumor yang lebih besar berdampak signifikan pada fungsi fisiologis pasien, yang mengakibatkan skor pasien yang lebih buruk. Sebaliknya, ukuran tumor berkorelasi negatif secara lemah tetapi signifikan dengan usia, berat badan, dan BMI, yang menunjukkan bahwa pasien dengan tumor yang lebih besar biasanya lebih muda dan lebih ramping, yang berpotensi berkontribusi pada harapan hidup mereka yang lebih panjang.
Karena tingkat protein ANT tidak berkorelasi dengan tingkat transkripnya secara andal, analisis berbasis mRNA tidak dapat digunakan untuk menilai tingkat protein ANT. Sebaliknya, mengukur protein berdasarkan tingkat peptida relatif yang diproses melalui pencernaan triptik menawarkan pendekatan yang lebih baik. Metode ini mengukur protein berdasarkan urutan peptida unik yang spesifik untuk protein atau isoform yang sesuai [ [ 51 ] ]. Namun, pembuatan spektrum massa tandem dalam mode akuisisi yang bergantung pada data bergantung pada intensitas sinyal ion, yang menghasilkan pengurutan hanya prekursor peptida yang paling intens. Pendekatan pengumpulan data stokastik ini kurang efektif ketika deteksi MS yang konsisten dari protein tertentu diperlukan. Khususnya untuk protein yang diatur turun, ada risiko informasi penting yang hilang dalam kumpulan data akhir. Untuk mengatasi hal ini, pemantauan reaksi paralel (PRM) adalah metode yang sangat selektif untuk kuantifikasi protein yang ditargetkan. PRM secara bersamaan memantau semua ion terfragmentasi dari prekursor peptida yang dipilih [ [ 52 , 53 ] ]. Dalam menilai tingkat protein ANT, pemantauan PRM yang ditargetkan terhadap ANT telah terbukti berharga, seperti yang ditunjukkan di sini dalam pengaturan biologis seperti pengembangan IRIS. Kami memanfaatkan penyesuaian sistem ( μ )LC-MS konvensional yang beroperasi pada laju aliran puluhan μL·min −1 , yang sebelumnya telah menunjukkan kinerja yang unggul dalam studi proteomik bottom-up [ [ 52 ] ]. Penilaian μ LC-PRM menawarkan platform yang kuat dan hemat waktu untuk pemantauan ANT yang ditargetkan, hanya membutuhkan 6 μg lisat sel.
Untuk memvalidasi deteksi protein ANT berbasis μ LC-PRM, kami menganalisis perubahan isoform ANT selama pembentukan IRIS dalam sel RPE-1. Temuan kami mengonfirmasi bahwa tingkat mRNA ANT2 menurun selama perkembangan IRIS, dan penurunan regulasi tingkat protein ANT2 menyertai penurunan transkrip ANT2 ini. Menariknya, penurunan kadar protein ANT2 bertahan sepanjang perjalanan waktu perkembangan penuaan, yang meluas hingga setidaknya hari ke-32. Pengamatan ini menggarisbawahi bahwa perkembangan fenotipe penuaan adalah proses jangka panjang. Pemantauan yang ditargetkan dari ketiga isoform ANT mengungkapkan bahwa penurunan regulasi ANT2 dan ANT3 diikuti oleh peningkatan kadar protein ANT1 dan peningkatan karakteristik OCR, yang menunjukkan kemungkinan kompensasi antara isoform ANT dan perubahan metabolisme energi. Sebelumnya, penghapusan ANT2 dalam sel HEK-293 menyebabkan penurunan respirasi maksimal. Namun, respirasi basal, kapasitas cadangan, dan OCR terkait ATP tidak terpengaruh. Menariknya, penghapusan ANT2 menyebabkan penurunan OCR kebocoran proton. Dihipotesiskan bahwa kadar rendah isoform ANT lain atau translocator lain cukup untuk metabolisme sel basal [ [ 54 ] ]. Menariknya, penghapusan ANT3 pada sel epitel tubulus proksimal ginjal yang diabadikan secara kondisional manusia menyebabkan penurunan jumlah mitokondria per sel, tetapi luas mitokondria per sel tetap tidak terpengaruh [ [ 55 ] ]. Lebih jauh, Hoogstraten et al . menunjukkan bahwa penghapusan ANT3 tidak meningkatkan sensitivitas sel terhadap penghambatan ANT, yang menunjukkan kompensasi fungsional di antara isoform ANT [ [ 55 ] ]. Penelitian lain juga telah menjelaskan kompensasi pada tingkat protein setelah penurunan isoform ANT individu [ [ 56 , 57 ] ], yang menekankan perlunya memantau dengan cermat perubahan pada tingkat isoform ANT lainnya. Data kami juga menunjukkan bahwa peningkatan keseluruhan isoform ANT, bukan isoform individual mana pun, bertanggung jawab atas peningkatan laju konsumsi oksigen selama perkembangan penuaan sel, yang selanjutnya menyoroti pertukaran isoform individual. Khususnya, pada tikus dengan penghapusan semua isoform ANT somatik, ekspresi isoform ANT4 tikus (yang sesuai dengan ANT4 manusia) diinduksi dalam sel somatik [ [ 56 ] ].
Secara umum, kami mengamati peningkatan regulasi metabolik di semua model pikun yang diuji selain dari sel RPE-1 yang mengekspresikan p16. Ekspresi berlebihan p16 mengurangi kapasitas respirasi maksimal, konsisten dengan peningkatan kapasitas respirasi maksimal yang dijelaskan sebelumnya setelah penurunan regulasi p16 [ [ 58 ] ]. Fenotipe hipermetabolik yang diamati dari sel-sel pikun konsisten dengan laporan lain [ [ 59 – 61 ] ]. Lebih jauh lagi, sel RPE-1 yang tenang menunjukkan tingkat glikolisis yang lebih rendah dan tingkat respirasi maksimal yang lebih tinggi, yang menunjukkan metabolisme yang lebih hemat energi pada sel-sel yang tenang. Temuan ini sejalan dengan laporan sebelumnya pada sel-sel melanoma yang tenang [ [ 62 ] ]. Secara luas diterima bahwa mitokondria meningkat dalam ukuran dan volume pada sel-sel pikun. Namun, peningkatan massa mitokondria ini terutama disebabkan oleh akumulasi mitokondria yang tidak berfungsi [ [ 63 ] ]. Akibatnya, OCR OXPHOS yang meningkat diamati di semua model yang dianalisis di sini kecuali penuaan yang diinduksi p16. Temuan ini sejalan dengan banyak laporan lain yang menunjukkan disfungsi mitokondria dan defisiensi OXPHOS pada sel-sel pikun, seperti yang baru-baru ini ditinjau di tempat lain [ [ 64 ] ]. Menariknya, proton leak OCR berkontribusi pada peningkatan total OXPHOS OCR. Namun, kami tidak menemukan korelasi signifikan antara perubahan kadar ANT individu atau total dan proton leak OCR, meskipun peran ANT sebagai proton gradient uncoupler diketahui [ [ 65 , 66 ] ]. Sebelumnya, ekspresi ANT2 dikaitkan dengan metabolisme glikolisis [ [ 2 – 4 , 18 , 67 ] ]. Namun, kami tidak mengamati hubungan ANT2 dengan glikolisis yang diukur dalam analisis ECAR dalam kumpulan data kami. Karena ekspresi inhibitor CDK selama pembentukan penuaan juga memengaruhi metabolisme seluler [ [ 58 , 62 ] ], hubungan antara ANT, penuaan seluler, dan metabolisme bersifat kompleks dan memerlukan studi lebih lanjut.
Konsisten dengan temuan kami, peningkatan volume mitokondria dengan pengurangan aktivitas OXPHOS mitokondria dan peningkatan sejumlah besar protein mitokondria (ANT1–3, protein genom mitokondria, metabolisme, dinamika, dan pensinyalan) diamati dalam analisis proteom mitokondria terkini pada sel-sel pikun [ [ 68 ] ]. Di sisi lain, protein translokase kecil dari membran mitokondria bagian dalam (TIMM9, TIMM10, TIMM13) mengalami penurunan regulasi pada sel-sel pikun, dan protein translokase dari membran mitokondria bagian luar (TOMM20, TOMM22, TOMM40, TOMM70) tidak mengalami perubahan signifikan dalam penelitian ini. Namun, protein-protein ini dalam analisis proteomik kami terhadap sel-sel MG U-87 mengalami peningkatan regulasi setelah TMZ mirip dengan protein mitokondria lainnya [ [ 68 ] ].
Data kami menunjukkan bahwa semua isoform ANT1, ANT2, dan ANT3 berkontribusi pada peningkatan respirasi selama induksi penuaan. Perubahan pada kadar protein totalnya, bukan perubahan pada isoform tertentu, berkorelasi dengan perubahan pada OCR respirasi maksimal (Gbr. 6A ), yang mendukung pertukarannya untuk respirasi. Pertukaran tersebut tidak mengejutkan, mengingat ANT1, ANT2, dan ANT3 menunjukkan sifat kinetik yang serupa ketika diekspresikan dalam ragi [ [ 69 ] ].
Mengingat bahwa membran dalam mitokondria jenuh dengan protein [ [ 70 ] ], kami mengantisipasi bahwa peningkatan dalam kumpulan ANT total terutama terkait dengan perluasan massa mitokondria total dalam sel. Inferensi ini didukung oleh korelasi antara protein ANT dan protein mitokondria lainnya dalam analisis kami terhadap data proteomik manusia normal dan tumor. Dalam sel kanker prostat, ANT2 ditemukan mengalami deasetilasi oleh SIRT4 pada lisin 105, yang mendorong degradasi ANT2 yang dimediasi ubiquitin [ [ 71 ] ]. Pada tikus, ANT1 dan ANT2 terbukti menghambat translocase TIM23, yang mengarah pada stabilisasi PINK1, yang menargetkan mitokondria untuk mitofagi dengan merekrut ligase ubiquitin E3 Parkin [ [ 72 ] ]. Pada fibroblas dermal diploid manusia, ekspresi berlebihan ANT2 menginduksi peningkatan mitofagi [ [ 18 ] ]. Untuk tinjauan peran ANT dalam mitofagi, lihat [ [ 15 ] ]. Oleh karena itu, protein ANT mengatur massa mitokondria total, yang mungkin berkontribusi pada korelasi tinggi antara ekspresi ANT dan massa mitokondria total yang diamati dalam analisis kami. Lebih jauh lagi, karena protein ANT yang terhenti selama impor mitokondria dibersihkan bukan oleh proteasom tetapi oleh protease mitokondria Yme1p dalam ragi [ [ 73 ] ], kami berharap bahwa proses intramitokondria memainkan peran penting dalam mempertahankan kadar ANT dalam mitokondria manusia. Secara keseluruhan, interaksi kompleks antara ANT dan mitofagi kemungkinan berkontribusi pada kurangnya regulasi ketat ekspresi ANT pada tingkat transkrip, yang bermanifestasi dalam korelasi mRNA-protein yang buruk dari protein mitokondria.
Peningkatan tingkat protein ANT1 yang diamati dalam semua model senescent yang digunakan dalam penelitian kami menarik, mengingat bahwa ANT1 biasanya dianggap sebagai protein pro-apoptosis. Namun, perubahan kompensasi pada komponen lain dari pori transisi permeabilitas mitokondria (MPTP) dapat mengurangi efek pro-apoptosis ANT1. Sementara protein ANT tidak penting untuk pembentukan MPTP, mereka mengaturnya, seperti yang ditinjau secara ekstensif [ [ 15 ] ]. Khususnya, ANT1 telah diidentifikasi sebagai sensor tegangan MPTP [ [ 74 ] ]. Pada sel-sel senescent, pembukaan MPTP meningkat, dan produksi ROS memicu proses ini. Selanjutnya, produksi ROS yang diinduksi MPTP membentuk ‘lingkaran setan’ [ [ 75 ] ]. Menariknya, sel-sel senescent menunjukkan resistensi yang lebih tinggi terhadap apoptosis [ [ 76 ] ], dan peran perlindungan paradoks dari pembukaan MPTP jangka pendek dan jarang dapat berkontribusi pada resistensi ini [ [ 77 ] ]. Sebagai alternatif, ekspresi berlebihan ANT1 dapat meningkatkan kelangsungan hidup sel kanker dalam kondisi terbatas oksigen. Misalnya, pada jantung tikus, ekspresi berlebihan ANT1 mengurangi produksi ROS dan stres oksidatif selama iskemia, yang pada akhirnya meningkatkan tingkat kelangsungan hidup tikus yang mengalami infark [ [ 78 ] ].
5 Kesimpulan
Studi ini menganalisis kumpulan data transkriptom dan proteom dari pasien dengan glioblastoma dan karsinoma paru untuk menilai kadar transkrip ANT dan protein. Kami menemukan korelasi yang lemah antara kadar transkrip ANT dan protein, tetapi korelasi yang kuat antara massa mitokondria dan mesin impor mitokondria.
Untuk mengukur kadar isoform ANT secara akurat, kami mengembangkan alat μ LC-PRM, yang memungkinkan kami menentukan rasio stoikiometri isoform ANT secara individual. Dengan menggunakan beberapa model penuaan sel secara in vitro , kami menunjukkan bahwa perkembangan penuaan disertai dengan keadaan hipermetabolik, yang ditandai dengan peningkatan kadar protein ANT secara global, khususnya ANT1. Selama transisi ini, ANT diatur secara pascatranskripsi daripada pada tingkat transkripsi.

