
Abstrak
Studi ini (NCT04537715) menyelidiki itrakonazol (penghambat kuat sitokrom P450 [CYP] 3A) dan rifampin (penginduksi kuat CYP3A) pada farmakokinetik tazemetostat. Pada Bagian 1, pasien menerima tazemetostat 400 mg secara oral pada Hari ke-1, 15, dan 36, dan 400 mg dua kali sehari pada Hari ke-3-14 dan Hari ke-21-35. Itrakonazol 200 mg secara oral sekali sehari diberikan pada Hari ke-18-38. Pada Bagian 2, pasien menerima tazemetostat 800 mg secara oral sekali sehari pada Hari ke-1, 15, dan 24, dan 800 mg dua kali sehari pada Hari ke-3-14 dan Hari ke-17-23. Rifampisin 600 mg secara oral sekali sehari diberikan pada Hari ke-17-25. Dua puluh satu pasien di setiap bagian yang diselesaikan memiliki konsentrasi plasma yang diukur untuk penilaian farmakokinetik. Pemberian bersama itrakonazol menghasilkan paparan tazemetostat yang lebih tinggi setelah dosis tunggal (Hari ke-21/Hari ke-1) dan kondisi stabil (Hari ke-36/Hari ke-15). Dibandingkan dengan tazemetostat saja, itrakonazol meningkatkan konsentrasi plasma maksimum rata-rata (Cmax ) dan area di bawah kurva konsentrasi-waktu dari waktu 0 hingga 12 jam (AUC 0-12 jam ) masing-masing sebesar 2,00 dan 3,12 kali lipat, setelah dosis tunggal. Setelah pemberian dosis dua kali sehari, itrakonazol meningkatkan Cmax kondisi stabil rata-rata dan AUC 0-12 jam masing-masing sebesar 1,86 dan 2,47 kali lipat. Pemberian bersama rifampin menurunkan kondisi stabil tazemetostat (Cmax ) dan AUC 0-12 jam sekitar 84% (Hari ke-24/Hari ke-15). Itrakonazol meningkatkan paparan tazemetostat sebanyak 2-3 kali lipat, dan rifampin menurunkan paparan tazemetostat sebanyak 84%, yang menunjukkan bahwa pemberian bersamaan tazemetostat dengan penghambat atau penginduksi CYP3A yang kuat harus dihindari.
Pengaturan epigenetik ekspresi gen melalui metilasi DNA, modifikasi histon, dan remodeling kromatin merupakan proses yang dinamis dan reversibel yang tidak melibatkan perubahan pada urutan DNA yang mendasarinya. 1 , 2 Modifikasi histon yang abnormal telah diamati pada banyak jenis kanker karena menyebabkan aktivasi onkogen yang tidak tepat dan inaktivasi penekan tumor, yang berkontribusi pada inisiasi dan perkembangan tumor. 3 – 5 Mengingat peran penyimpangan epigenetik dalam tumorigenesis dan reversibilitas penyimpangan, penyelidikan dan pengembangan penghambat epigenetik telah menarik perhatian yang luas. 6 , 7
Enhancer of zeste homolog 2 (EZH2) merupakan histone methyltransferase yang telah diidentifikasi sebagai subunit katalitik dari polycomb repressive complex 2 untuk trimetilasi histone 3 pada lisin 27, yang dikaitkan dengan represi ekspresi gen dan keterlibatan dalam perkembangan jaringan dan penentuan nasib sel induk. 1 , 8 EZH2 diekspresikan secara abnormal dalam berbagai tumor ganas; oleh karena itu, EZH2 merupakan target terapi yang tepat. 8 , 9
Tazemetostat adalah penghambat metiltransferase oral EZH2 dan terapi epigenetik pertama di kelasnya yang disetujui oleh Badan Pengawas Obat dan Makanan AS untuk pasien dengan limfoma folikular dan sarkoma epiteloid. 10 Tazemetostat menerima persetujuan yang dipercepat berdasarkan aktivitas klinis yang ditunjukkan dalam 2 uji coba Fase II berlabel terbuka yang menyelidiki tazemetostat pada pasien dengan limfoma folikular yang dikonfirmasi secara histologis setelah 2 atau lebih terapi sistemik sebelumnya, dan menyelidiki tazemetostat pada pasien berusia 16 tahun atau lebih dengan sarkoma epiteloid metastasis atau stadium lanjut yang dikonfirmasi secara histologis. 10 – 12
Tazemetostat diserap dengan cepat setelah diberikan, dengan waktu rata-rata untuk mencapai konsentrasi plasma maksimum (tmax ) 1-2 jam. Paparan sistemik tazemetostat kira-kira sebanding dengan dosis pada dosis 200-1600 mg dua kali sehari. In vitro, tazemetostat terutama dimetabolisme oleh sitokrom P450 (CYP), famili 3, subfamili A (CYP3A) untuk membentuk metabolit tidak aktif, EPZ-6930 dan EPZ006931. EPZ-6930 mengalami metabolisme lebih lanjut oleh CYP3A. 3 , 10 , 13 Agar dokter dapat mengelola pasiennya dengan tepat, penting untuk memahami potensi interaksi obat-obat (DDI) antara tazemetostat dan penginduksi dan penghambat CYP3A.
Rifampisin adalah antibiotik yang digunakan untuk pengobatan tuberkulosis paru dan penginduksi isoform CYP; khususnya, merupakan penginduksi kuat CYP3A. Akibatnya, rifampin telah digunakan secara luas dalam studi klinis sebagai penginduksi prototipe enzim metabolisme obat. 14 Sebuah studi DDI yang khas menggunakan dosis rifampin 600 mg sekali sehari, diberikan secara oral. 15 , 16 Itrakonazol adalah antijamur yang digunakan untuk pengobatan infeksi jamur dan penghambat kuat CYP3A. 17 Studi DDI sebelumnya telah menggunakan dosis itrakonazol mulai dari 200 hingga 400 mg secara oral sekali sehari. Namun, terdapat sedikit perbedaan dalam penghambatan CYP3A antara itrakonazol 400 dan 200 mg. 18
Di sini, kami menyajikan hasil dari studi DDI (EZH-108; NCT04537715), yang mengevaluasi efek penghambatan CYP3A oleh itrakonazol dan induksi CYP3A oleh rifampisin pada profil farmakokinetik (PK) dan keamanan tazemetostat pada pasien dengan keganasan refrakter pengobatan tingkat lanjut.
Metode
Desain Studi
Ini adalah studi Fase I, multisenter, berlabel terbuka, 2 bagian yang mencakup desain urutan tetap yang bertujuan untuk mengkarakterisasi PK tazemetostat ketika diberikan sebagai dosis oral tunggal dan dua kali sehari saja atau dalam kombinasi dengan itrakonazol (Bagian 1) atau rifampin (Bagian 2). Tujuan sekunder adalah untuk mengevaluasi profil keamanan tazemetostat ketika diberikan bersamaan dengan itrakonazol (Bagian 1) atau rifampin (Bagian 2).
Penelitian ini dilakukan di 10 lokasi penelitian di Amerika Serikat (n = 7) dan Spanyol (n = 3). Lokasi penelitian di Amerika Serikat adalah California Cancer Associates for Research and Excellence, Inc. (Encinitas, CA), Angeles Clinical and Research Institute (Los Angeles, CA), Northwestern University-Robert H. Lurie Comprehensive Cancer Center (Chicago, IL), South Texas Accelerated Research Therapeutics Midwest (Grand Rapids, MI), Gabrail Cancer Center (Canton, OH), University of Cincinnati Medical Center (Cincinnati, OH), dan Mary Crowley Cancer Research (Dallas, TX). Dewan peninjau institusional (IRB) dari lokasi penelitian di Amerika Serikat adalah WIRB/Copernicus Group (WCG) IRB (Puyallup, WA), Mary Crowley Medical Research Center Institutional Review Board (Dallas, TX), dan Salus IRB (Austin, TX). Lokasi penelitian di Spanyol adalah Rumah Sakit Universitario Vall d’Hebron (Barcelona), Rumah Sakit Fundacion Jimenez Diaz (Madrid), dan Onkologikoa (Donostia). Komite etika independen (IEC) untuk situs di Spanyol adalah CEIm La Fe Valencia (Valencia).
Protokol penelitian dan amandemen serta formulir persetujuan dan pembaruan ditinjau dan disetujui oleh IEC atau IRB sebelum dimulainya penelitian dan selama penelitian jika berlaku. Penelitian dilakukan berdasarkan ketentuan Deklarasi Helsinki Versi 2013, sesuai dengan Pedoman Konsolidasi tentang Praktik Klinis yang Baik dari Konferensi Internasional tentang Harmonisasi, Judul 21 Bagian 312 Badan Pengawas Obat dan Makanan, serta mematuhi IEC/IRB dan peraturan persetujuan. Semua pasien yang terdaftar dalam penelitian memberikan persetujuan tertulis dan berdasarkan informasi.
Populasi Studi
Pasien yang memenuhi syarat adalah orang dewasa berusia 18 tahun atau lebih dengan tumor padat metastasis lanjut atau tidak dapat direseksi yang dikonfirmasi secara histologis dan/atau sitologis yang telah berkembang setelah pengobatan dan tidak ada terapi standar yang tersedia, atau dengan keganasan hematologi yang dikonfirmasi secara histologis dan/atau sitologis, yang telah kambuh atau refrakter, setelah menjalani 2 atau lebih terapi sistemik standar dan tidak ada terapi standar yang tersedia. Semua pasien yang memenuhi syarat memiliki status kinerja Eastern Cooperative Oncology Group 0-2, memiliki harapan hidup lebih dari 3 bulan, telah menyelesaikan pengobatan sebelumnya sebelum masuk studi, dan secara klinis stabil pada saat persetujuan.
Kriteria eksklusi mencakup, tetapi tidak terbatas pada, metastasis sistem saraf pusat atau leptomeningeal, diatesis perdarahan yang signifikan secara klinis, atau koagulopati, termasuk gangguan fungsi trombosit yang diketahui, penyakit bersamaan yang tidak terkontrol, atau menerima pengobatan yang diketahui sebagai penginduksi atau penghambat CYP3A.
Jadwal Dosis dan Administrasi
Bagian 1 dari penelitian ini mengevaluasi DDI antara tazemetostat dan itraconazole. Pada pagi hari ke-1 dan ke-15, pasien menerima dosis tunggal tazemetostat 400 mg secara oral. Pada Hari ke-3 hingga ke-14, pasien menerima tazemetostat 400 mg dua kali sehari (pagi dan sore). Pada Hari ke-18 hingga ke-20, pasien menerima itraconazole 200 mg secara oral sekali sehari pada pagi hari. Pada Hari ke-21 hingga ke-35, tazemetostat 400 mg dua kali sehari diberikan bersamaan pada pagi hari dengan dosis tunggal itraconazole 200 mg. Pada Hari ke-36, pasien menerima dosis tunggal tazemetostat 400 mg yang diberikan bersamaan pada pagi hari dengan dosis tunggal itraconazole 200 mg. Pada Hari ke-37 dan ke-38, pasien menerima dosis tunggal itraconazole 200 mg (Gambar 1A ). Sepanjang Bagian 1, pemberian itrakonazol terjadi 1 jam setelah makan.

Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Desain studi untuk (A) Bagian 1: tazemetostat diberikan bersamaan dengan itrakonazol dan (B) Bagian 2: tazemetostat diberikan bersamaan dengan rifampin. Dua kali sehari, dua kali sehari, sekali sehari.
Bagian 2 dari penelitian ini mengevaluasi DDI antara tazemetostat dan rifampin. Pada pagi hari ke-1 dan ke-15, pasien menerima dosis tunggal tazemetostat 800 mg secara oral. Pada Hari ke-3 hingga ke-14, pasien menerima tazemetostat 800 mg dua kali sehari. Pada Hari ke-17 hingga ke-23, pasien menerima tazemetostat 800 mg dua kali sehari, diberikan bersamaan di pagi hari dengan dosis tunggal rifampin 600 mg secara oral. Pada pagi hari ke-24, pasien menerima dosis tunggal tazemetostat 800 mg yang diberikan bersamaan dengan rifampin 600 mg. Pada pagi hari ke-25, pasien menerima rifampin 600 mg (Gambar 1B ). Sepanjang Bagian 2, pemberian rifampin terjadi 1 jam sebelum makan.
Pada Bagian 1 dan 2, pasien yang menyelesaikan studi dapat menghentikan studi atau melanjutkan pengobatan tazemetostat oral pada dosis terapi yang dianjurkan sebesar 800 mg dua kali sehari dalam siklus 28 hari sejak Hari ke-40 hingga terjadi perkembangan klinis, toksisitas yang tidak dapat diterima, atau hingga kriteria penghentian lainnya terpenuhi.
Penilaian Farmakokinetik
Pada Bagian 1, konsentrasi plasma tazemetostat setelah pemberian dosis tazemetostat pada Hari ke-1, 15, 21, dan 36 dikuantifikasi untuk analisis PK sebelum pemberian dosis (0 jam), dan pada 0,5, 1, 1,5, 2, 4, 6, 8, 12, 24 (Hari ke-21-22), 36, 48 (Hari ke-1-3), dan hingga 72 jam setelah pemberian dosis (Hari ke-15-18 dan Hari ke-36-39).
Pada Bagian 2, konsentrasi plasma tazemetostat setelah pemberian dosis tazemetostat pada Hari ke-1, ke-15, dan ke-24 dikuantifikasi untuk analisis PK sebelum pemberian dosis (0 jam) dan pada jam ke-0,5, 1, 1,5, 2, 4, 6, 8, 12, 24, 36, dan 48.
Konsentrasi plasma tazemetostat, pada rentang 1,00-2000 ng/mL, diukur dengan kromatografi cair yang sepenuhnya tervalidasi dengan metode analisis deteksi spektrometri massa tandem. Sampel yang tidak memiliki puncak yang dapat dideteksi atau memiliki konsentrasi terhitung <1,00 ng/mL dilaporkan berada di bawah batas bawah pengukuran. Analisis tazemetostat terdiri dari ekstraksi dan pemisahan presipitasi protein menggunakan fase gerak 100 mM amonium format/air (1:9 v/v) (fase gerak A) dan 100 mM amonium format/asetonitril (1:9 v/v) (fase gerak B). Deteksi dicapai menggunakan spektrometer massa API-5500 (AB Sciex) menggunakan ionisasi elektrospray (mode ion positif) dalam mode pemantauan reaksi ganda. Transisi m/z mode pemantauan reaksi ganda yang dipantau adalah 287,2/351,2 untuk tazemetostat dan waktu tunggu ditetapkan pada 300 milidetik. Keakuratan dan presisi intra dan interassay untuk konsentrasi yang diuji semuanya berada dalam kriteria penerimaan yang ditetapkan (±15,0% dari konsentrasi nominal pada batas bawah kuantifikasi dan koefisien variasi [CV] adalah 15,0% atau kurang).
Data konsentrasi plasma-waktu untuk tazemetostat dianalisis dengan analisis nonkompartemen menggunakan program perangkat lunak tervalidasi Phoenix WinNonlin Professional Versi 8.3 (Certara Inc., Mountain View, CA).
Ukuran PK untuk tazemetostat termasuk t max ; C max yang terjadi pada t max ; area di bawah kurva konsentrasi-waktu (AUC) dari waktu terakhir pemberian dosis hingga konsentrasi terukur terakhir yang diestimasikan menggunakan metode linear-up/log-down (AUC last ); AUC selama interval pemberian dosis dari 0 hingga 12 jam setelah pemberian dosis, diestimasikan menggunakan metode linear-up/log-down (AUC 0-12h ); AUC yang diekstrapolasi hingga tak terhingga (AUC 0-inf ), dihitung sebagai jumlah AUC dari waktu terakhir pemberian dosis hingga konsentrasi terukur terakhir dan C last /λ z , di mana C last adalah konsentrasi terukur terakhir dan λ z adalah konstanta laju orde pertama yang dikaitkan dengan bagian terminal (log-linear) kurva; waktu paruh eliminasi terminal nyata (t 1/2 ); rasio akumulasi C max , dihitung sebagai rasio C max pada kondisi tunak dibagi dengan C max selama interval pemberian dosis awal (RacC max ); dan rasio akumulasi AUC, dihitung sebagai rasio AUC 0-12 jam pada kondisi stabil dibagi dengan AUC 0-12 jam selama interval pemberian dosis awal (RacAUC).
Analisis Keamanan
Keamanan dinilai dengan memantau kejadian buruk yang muncul akibat pengobatan (TEAE) dan tanda-tanda vital, elektrokardiografi, dan uji laboratorium klinis. TEAE didefinisikan sebagai kejadian buruk yang dimulai atau memburuk tingkat keparahannya pada atau setelah tanggal dosis pertama obat studi hingga 30 hari setelah dosis terakhir. TEAE terkait pengobatan dirangkum berdasarkan masing-masing obat studi untuk kedua bagian studi. Kejadian buruk dikodekan menggunakan Medical Dictionary for Regulatory Activities Version 23.1 dan dinilai berdasarkan Common Terminology Criteria for Adverse Events Version 5.0.
Hasil
Populasi Pasien
Sebanyak 42 pasien didaftarkan, dengan 21 pasien menerima tazemetostat yang diberikan bersamaan dengan itraconazole (Bagian 1) dan 21 pasien menerima tazemetostat yang diberikan bersamaan dengan rifampin (Bagian 2). Dari 21 pasien di setiap bagian, 16 pasien memiliki data konsentrasi PK yang cukup untuk menghitung parameter PK steady-state di Bagian 1 (Hari ke-15 dan ke-36) dan Bagian 2 (Hari ke-15 dan ke-24) dan tidak memiliki penyimpangan protokol mayor yang dianggap sangat mengubah paparan steady-state terhadap tazemetostat, itraconazole, atau rifampin. Di Bagian 1, 16 (76,2%) pasien menyelesaikan penelitian. Lima pasien tidak memberikan data konsentrasi PK yang cukup untuk menghitung parameter PK steady-state karena pengumpulan sampel PK yang terlewat. Di Bagian 2, 16 (76,2%) pasien menyelesaikan penelitian. Lima pasien tidak memberikan data konsentrasi PK yang cukup untuk menghitung parameter PK steady-state. Satu pasien tidak diberikan rifampin karena AE, 1 pasien berpartisipasi dalam penelitian hanya selama 3 hari, 2 pasien tidak diberikan rifampin dan melewatkan pengambilan sampel PK, dan 1 pasien melewatkan dosis obat penelitian. Karakteristik dasar untuk Bagian 1 dan 2 disajikan dalam Tabel S1 .
Pada Bagian 1 (Siklus 1), durasi rata-rata paparan tazemetostat adalah 5,14 minggu (kisaran, 2,1-5,1 minggu). Lima belas (71,4%) pasien menerima 90% atau lebih dari dosis tazemetostat yang direncanakan. Empat belas pasien terus menerima tazemetostat mulai dari Siklus 2 dan seterusnya.
Pada Bagian 2 (Siklus 1), durasi rata-rata paparan tazemetostat adalah 3,43 minggu (kisaran, 0,1-3,7 minggu). Delapan belas (85,7%) pasien menerima 90% atau lebih dari dosis tazemetostat yang direncanakan. Tujuh belas pasien terus menerima tazemetostat sejak Siklus 2 dan seterusnya.
Efek Itrakonazol terhadap PK Tazemetostat
Dosis Tunggal (Hari ke-21 vs Hari ke-1)
Bahasa Indonesia: Setelah dosis tunggal tazemetostat dengan (Hari ke-21) dan tanpa (Hari ke-1) pemberian bersamaan itrakonazol, paparan tazemetostat meningkat, dengan rasio rata-rata geometrik kuadrat terkecil (geoLSM) sebesar 2,00 dan 3,12 untuk Cmax dan AUC 0-12 jam , masing-masing (Gambar 2A ). Tazemetostat t 1/2 (rata-rata geometrik CV%) lebih pendek dengan (2,86 jam [28,9]) dibandingkan tanpa (5,97 jam [25,6]) pemberian bersamaan itrakonazol (Tabel 1 ). Median t max tazemetostat serupa dengan (1,53 jam) dan tanpa (1,44 jam) pemberian bersamaan itrakonazol.

Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Konsentrasi plasma tazemetostat untuk Bagian 1 setelah pemberian bersamaan itrakonazol dengan (A) dosis tunggal dan (B) dosis ganda tazemetostat dan untuk (C) Bagian 2 setelah pemberian bersamaan rifampin dengan dosis ganda tazemetostat. D, Hari; SD, simpangan baku.
Tabel 1. Ringkasan Tazemetostat PK, Diberikan Bersamaan Dengan Itraconazole atau Rifampin
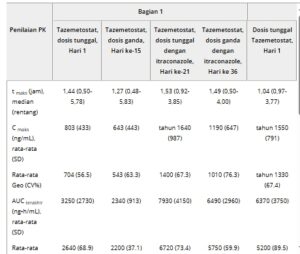
AUC terakhir , area di bawah kurva konsentrasi-waktu dari waktu terakhir pemberian dosis hingga konsentrasi terukur terakhir; AUC 0-12 jam , area di bawah kurva konsentrasi-waktu pada interval 0 hingga 12 jam setelah pemberian dosis; C maks , konsentrasi plasma maksimum; CV, koefisien variasi; geoLSM, rata-rata geometrik kuadrat terkecil; GeoMean, rata-rata geometrik; NA, tidak berlaku; PK, farmakokinetik; RacAUC, rasio akumulasi yang teramati; RacC maks , rasio akumulasi C maks ; SD, deviasi standar; t maks , waktu hingga konsentrasi plasma maksimum; t 1/2 , waktu paruh eliminasi terminal nyata.
Diperkirakan selama interval pemberian dosis 12 jam.
b Hari ke-21 versus Hari ke-1.
c Hari ke-36 versus Hari ke-15.
Hari ke-24 versus Hari ke-15.
Hari ke-15 versus Hari ke-1.
Kondisi Stabil (Hari ke-36 vs Hari ke-15)
Pemberian itrakonazol bersamaan dengan tazemetostat menghasilkan paparan tazemetostat yang lebih tinggi pada kondisi stabil (Hari ke-36) dibandingkan dengan tazemetostat saja (Hari ke-15) (Gambar 2B ). Rasio geoLSM untuk Cmax dan AUC 0-12 jam masing-masing adalah 1,86 dan 2,47. Tazemetostat t 1/2 (rata-rata geometris [CV%]) sedikit lebih lama dengan (11,9 jam [43,8]) dibandingkan tanpa (8,01 jam [39,3]) pemberian itrakonazol bersamaan (Tabel 1 ). Median t max tazemetostat sedikit lebih lambat dengan (1,49 jam) dibandingkan tanpa (1,27 jam) pemberian itrakonazol bersamaan.
Setelah beberapa dosis tazemetostat dua kali sehari saja, paparan tazemetostat rata-rata (Hari ke-15) lebih rendah daripada setelah dosis tazemetostat tunggal (Hari ke-1), dengan rasio geoLSM sebesar 0,771 dan 0,842 untuk RacC maks dan RacAUC 0-12 jam , masing-masing (Tabel 1 ).
Pengaruh Rifampisin terhadap PK Keadaan Tetap Tazemetostat (Hari ke-24 vs Hari ke-15)
Pemberian rifampin bersamaan dengan tazemetostat (Hari ke-24) menghasilkan paparan tazemetostat yang lebih rendah pada kondisi stabil dibandingkan dengan pemberian tazemetostat saja (Hari ke-15) (Gambar 2C ). Rasio geoLSM untuk Cmax dan AUC 0-12 jam masing-masing adalah 0,164 dan 0,163. Tazemetostat t 1/2 (rata-rata geometrik [CV%]) lebih pendek dengan (4,86 jam [31,7]) dibandingkan tanpa (7,55 jam [20,3]) pemberian rifampin bersamaan (Tabel 1 ). Median t max tazemetostat serupa dengan (1,01 jam) dan tanpa (1,00 jam) pemberian rifampin bersamaan.
Setelah beberapa dosis tazemetostat dua kali sehari saja, paparan tazemetostat rata-rata (Hari ke-15) lebih rendah daripada setelah dosis tazemetostat tunggal (Hari ke-1), dengan rasio geoLSM sebesar 0,828 dan 0,816 untuk RacC maks dan RacAUC 0-12 jam , masing-masing (Tabel 1 ).
Keamanan
Pada Bagian 1, 20 (95,2%) pasien melaporkan sedikitnya 1 TEAE, yang mana 13 (61,9%) pasien mengalami TEAE yang dianggap terkait dengan obat studi oleh peneliti (Tabel S2 ). TEAE yang paling sering dilaporkan (terjadi pada 20% atau lebih subjek) pada Bagian 1 adalah nafsu makan menurun dan dispnea (masing-masing 33%), anemia, kelelahan, dan mual (masing-masing 28,6%), dan konstipasi (23,8%). TEAE Grade 3/4 terkait pengobatan yang dialami pada Bagian 1 adalah anemia (n = 2; 9,5%; terkait dengan tazemetostat atau itraconazole pada kedua pasien), dan hiponatremia (n = 1; 4,8%; terkait dengan tazemetostat). Dua kematian dilaporkan pada pasien akibat TEAE serius (adenokarsinoma paru dan sindrom vena cava superior) dalam 30 hari setelah dosis terakhir obat penelitian pada pasien yang menerima tazemetostat dengan itraconazole; tidak satu pun dari ini dianggap terkait dengan pengobatan.
Pada Bagian 2, semua pasien melaporkan sedikitnya 1 TEAE, yang mana 18 (85,7%) mengalami TEAE yang dianggap terkait dengan obat studi oleh peneliti (Tabel S2 ). TEAE yang paling sering dilaporkan adalah kelelahan (42,9%), diare (33,3%), batuk (28,6%), anemia, mual, dan konstipasi (masing-masing 23,8%). TEAE Grade 3/4 terkait Tazemetostat yang dialami pada Bagian 2 adalah diare (n = 1; 4,8%), peningkatan alanine aminotransferase (n = 1; 4,8%), aspartate aminotransferase (n = 1; 4,8%), sinkop (n = 1; 4,8%), cedera ginjal akut (n = 1; 4,8%), hipertensi, dan anemia (n = 2; 9,5%). Jumlah limfosit yang menurun (n = 2; 9,5%) merupakan TEAE Tingkat 3/4 yang terkait dengan tazemetostat pada 1 pasien dan rifampin pada pasien lainnya. Tidak ada kematian akibat TEAE pada Bagian 2.
Diskusi
Studi Fase I, 2 bagian ini dilakukan untuk mengkarakterisasi PK tazemetostat oral saat diberikan sebagai dosis tunggal dan dua kali sehari saja atau dalam kombinasi dengan itrakonazol (Bagian 1) atau rifampisin (Bagian 2) pada pasien dengan keganasan lanjut.
Pada Bagian 1, pemberian bersamaan inhibitor kuat CYP3A, itrakonazol, mengakibatkan paparan tazemetostat yang lebih tinggi setelah dosis tunggal (Hari ke-21 vs Hari ke-1) dan pada kondisi stabil (Hari ke-36 vs Hari ke-15). Ketika diberikan sebagai dosis tunggal, itrakonazol meningkatkan rata-rata Cmax dan AUC 0-12 jam masing-masing sebesar 2,00 dan 3,12 kali lipat, dibandingkan dengan tazemetostat saja. Pada kondisi stabil, pemberian bersamaan meningkatkan rata-rata Cmax sebesar 1,86 kali lipat dan AUC 0-12 jam sebesar 2,47 kali lipat. Median tmax serupa dengan ada atau tidaknya itrakonazol dengan tazemetostat dosis tunggal atau kondisi stabil, sedangkan t 1/2 kira-kira 4 jam lebih lama pada kondisi stabil dengan pemberian bersamaan itrakonazol. Peningkatan paparan tazemetostat ini diharapkan dengan pemberian bersamaan inhibitor CYP3A yang kuat, mengingat bahwa tazemetostat terutama dimetabolisme oleh CYP3A secara in vitro. 10 Namun, besarnya peningkatan paparan tazemetostat dengan adanya itraconazole secara signifikan lebih rendah dari yang diharapkan dari inhibitor yang kuat. Direkomendasikan bahwa pemberian bersamaan tazemetostat dengan inhibitor CYP3A yang kuat harus dihindari, dan ketika pemberian bersamaan tidak dapat dihindari, dosis tazemetostat harus dikurangi. 19 Namun, meskipun ada rekomendasi terhadap pemberian bersamaan dengan inhibitor CYP3A yang kuat, penting untuk mengakui potensi penghambatan mereka yang bervariasi. Pemberian bersamaan tazemetostat dengan obat-obatan dengan aktivitas penghambatan CYP3A yang lebih besar, seperti ketoconazole, ritonavir, atau cobicistat, 20 mungkin telah mengakibatkan peningkatan yang lebih substansial dalam paparan tazemetostat.
Pada Bagian 2, pemberian bersamaan dengan rifampin, penginduksi CYP3A yang kuat, menghasilkan paparan yang lebih rendah terhadap tazemetostat pada kondisi stabil (Hari ke-24 vs. Hari ke-15). Paparan tazemetostat pada kondisi stabil menurun sekitar 84% ketika diberikan bersamaan dengan rifampin pada kondisi stabil. Rasio geoLSM untuk Cmax dan AUC 0-12 jam masing-masing adalah 0,164 dan 0,163. Hal ini menunjukkan bahwa tazemetostat sangat sensitif terhadap induksi CYP3A oleh rifampin, sehingga membenarkan penghindaran pemberian bersamaan dengan penginduksi CYP3A yang kuat. 21
Baik di Bagian 1 maupun 2, sifat dan tingkat keparahan TEAE yang dialami konsisten dengan profil keamanan tazemetostat yang diketahui. Tidak ada kejadian buruk yang menjadi perhatian khusus yang ditetapkan dalam protokol, dan tidak ada sinyal keamanan potensial baru yang diidentifikasi selama penelitian. Durasi median paparan tazemetostat yang terbatas, dengan sebagian besar pasien menghentikan penelitian karena perkembangan penyakit, konsisten dengan populasi pasien yang sebelumnya telah diobati dengan sangat parah dengan keganasan lanjut.
Keterbatasan penelitian ini adalah ukuran sampel untuk setiap bagian penelitian relatif kecil mengingat besarnya variabilitas penilaian PK tazemetostat.
Secara keseluruhan, hasil penelitian ini memperkuat bahwa kehati-hatian harus dilakukan saat memberikan tazemetostat bersamaan dengan penghambat atau penginduksi CYP3A yang kuat karena efeknya terhadap paparan tazemetostat.

