
ABSTRAK
Latar belakang
Anemia aplastik berat (SAA) adalah kelainan hematologi yang mengancam jiwa yang ditandai dengan kegagalan sumsum tulang dan gangguan kekebalan tubuh.
Tujuan
Menyelidiki peran makrofag yang mengekspresikan reseptor Toll-like 4 (TLR4) dalam imunopatogenesis SAA.
Metode
Tingkat ekspresi makrofag TLR4 dideteksi melalui reaksi berantai polimerase kuantitatif transkripsi balik (RT-qPCR) dan western blotting (WB). Ekspresi makrofag TLR4 yang ditekan atau dihambat, kadar piroptosis (IL-1β, IL-18, NLRP3, caspase-1, gasdermin D) dideteksi melalui RT-qPCR dan WB. Menggunakan sekuensing RNA untuk menemukan gen dan jalur diferensial. Sel T CD8+ yang dikultur bersama dengan makrofag yang menekan atau menghambat TLR4, dan tingkat ekspresi perforin dan granzim B pada sel T CD8+ dideteksi melalui flow cytometry. Sel T CD8+ selanjutnya dikultur bersama dengan K562, dan laju apoptosis K562 dideteksi.
Hasil
TLR4 dalam makrofag sumsum tulang pasien dengan SAA yang tidak diobati secara signifikan lebih tinggi daripada yang ada dalam kelompok remisi dan kontrol, dan berkorelasi negatif dengan indikator klinis. Pengurutan RNA makrofag dengan knockdown TLR4 menunjukkan bahwa gen yang diekspresikan secara diferensial diperkaya dalam jalur pensinyalan kemotaksis inflamasi dan imun bawaan. Setelah knockout TLR4 atau penambahan inhibitor TLR4 dalam makrofag sumsum tulang pasien dengan SAA yang tidak diobati, tingkat ekspresi mRNA dan protein dari penanda piroptosis interleukin (IL)-1β, IL-18, NLRP3, caspase-1, dan gasdermin D secara signifikan lebih rendah daripada yang ada dalam kelompok kontrol. Ketika sel T CD8+ dikultur bersama dengan makrofag yang knockdown TLR4 atau yang ditambahkan inhibitor, ekspresi perforin dan granzim B dalam sel T CD8+ berkurang secara signifikan, dan sitotoksisitas sel T CD8+ menurun.
Kesimpulan
Penghambatan ekspresi makrofag TLR4 pada pasien SAA dapat meringankan respons imun seluler yang terlalu aktif pada pasien SAA dengan mengurangi tingkat piroptosis.
1 Pendahuluan
Anemia aplastik berat (SAA) adalah kegagalan sumsum tulang yang disebabkan oleh kelainan pada imunitas seluler [ 1 ]. Mekanisme imun anemia aplastik meliputi ketidakseimbangan rasio Th1/Th2 di bawah stimulasi antigen yang tidak diketahui, peningkatan sekresi regulator negatif hematopoietik, proliferasi, dan aktivasi berlebihan limfosit T sitotoksik (CTL), yang secara abnormal menyerang sel induk/progenitor hematopoietik dan akhirnya menyebabkan kegagalan sumsum tulang [ 2 – 5 ].
Toll-like receptor 4 (TLR4) adalah anggota keluarga TLR yang menginduksi respons inflamasi dalam tubuh [ 6 ]. TLR4 dapat diaktifkan oleh komponen eksogen yang dikenal sebagai pola molekuler terkait patogen (PAMP), yang memulai respons pro-inflamasi untuk menghilangkan patogen selama infeksi [ 7 ]. TLR4 juga dapat diaktifkan oleh senyawa endogen yang dikenal sebagai pola molekuler terkait kerusakan (DAMP), yang mengaktifkan TLR4 dalam kondisi non-infeksi untuk menginduksi perbaikan jaringan [ 6 , 8 ]. Namun, keseimbangan antara sinyal pro-inflamasi dan anti-inflamasi yang dipicu oleh TLR4 sulit dipertahankan. Aktivasi TLR4 yang berlebihan selama infeksi dapat memperkuat kaskade sinyal inflamasi, yang berpotensi menyebabkan sepsis, syok septik, atau bahkan kematian [ 9 ]. Sebaliknya, aktivasi TLR4 yang berkelanjutan dalam keadaan homeostasis yang tidak teratur dapat mengakibatkan peradangan kronis yang bergantung pada TLR4, yang berkontribusi terhadap perkembangan dan progresi penyakit autoimun, gangguan metabolisme, dan tumor [ 10 – 12 ].
Makrofag merupakan komponen penting dari sistem imun bawaan dan berfungsi sebagai jembatan antara imunitas bawaan dan adaptif. Sebagai pemrakarsa dan pelaksana respons imun adaptif, makrofag memainkan peran penting dalam berbagai proses fisiologis, termasuk respons inflamasi, toleransi imun, dan fagositosis sel apoptosis [ 13 ]. Disfungsi makrofag merupakan penyebab utama perkembangan dan progresi penyakit autoimun. Penelitian telah menunjukkan bahwa TLR menginduksi produksi NLRP3 (protein 3 yang mengandung domain NOD, LRR, dan pyrin) pada makrofag, yang menyebabkan respons imun dan inflamasi [ 14 ]. Selain itu, aktivasi TLR pada makrofag dapat mengakibatkan peningkatan signifikan glikolisis aerobik dan gangguan siklus asam trikarboksilat, yang mendorong respons pro-inflamasi spesifik [ 15 ].
Pyroptosis juga terkait erat dengan peradangan. Pyroptosis adalah bentuk kematian sel terprogram yang dimediasi oleh gasdermin dan merupakan produk dari ekspansi sel terus-menerus hingga sitomembran pecah, yang mengakibatkan pelepasan isi sel yang dapat mengaktifkan respons inflamasi dan imun yang kuat [ 16 ]. Pyroptosis sel yang berlebihan dapat menyebabkan peradangan akut atau sindrom pelepasan sitokin, yang dapat mengakibatkan kerusakan jaringan dan disfungsi organ [ 17 ]. Penelitian telah menunjukkan bahwa penyakit autoimun Rheumatoid Arthritis (RA) telah dikaitkan dengan pyroptosis makrofag, yang menunjukkan bahwa hal itu merupakan pendorong patogenesis penyakit [ 18 ].
Berdasarkan hal ini, kami menyelidiki tingkat ekspresi TLR4 pada makrofag yang berasal dari sumsum tulang pasien dengan SAA dan efeknya pada sel T CD8+ untuk menjelaskan peran ekspresi TLR4 makrofag dalam imunopatogenesis SAA.
2 Bahan dan Metode
2.1 Peserta Studi
Studi ini melibatkan 32 pasien dengan SAA yang baru didiagnosis dan 20 pasien dengan SAA dalam remisi, yang dirawat di Departemen Hematologi, Rumah Sakit Umum Universitas Kedokteran Tianjin, dari September 2017 hingga Januari 2021. Data dasar pasien ditunjukkan pada Tabel 1. Selain itu, studi ini melibatkan 48 relawan sehat, 28 pria dan 20 wanita, dengan usia rata-rata 48 tahun (berkisar antara 4 hingga 78 tahun). Tidak ada perbedaan signifikan dalam usia dan jenis kelamin antara kelompok kontrol sehat dan kelompok SAA.
TABEL 1. Karakteristik Dasar Pasien dengan SAA.
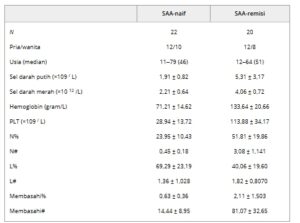
Singkatan: Hb, hemoglobin; L#, nilai limfosit absolut; L%, persentase limfosit; N#, nilai neutrofil absolut; N%, persentase granulosit neutrofilik; PLT, trombosit; RBC, sel darah merah; Ret#, nilai retikulosit absolut; Ret%, persentase retikulosit; SAA, anemia aplastik berat; WBC, sel darah putih.
Protokol penelitian disetujui oleh komite etik rumah sakit. Semua peserta berpartisipasi secara sukarela dalam penelitian dan menandatangani formulir persetujuan (Tabel 1 ).
2.2 Induksi Makrofag In Vitro
Sel mononuklear sumsum tulang diekstraksi menggunakan sentrifugasi gradien densitas (Human Peripheral Blood Lymphocyte Separation Solution; Beijing Solarbio Science & Technology Co. Ltd., Tiongkok). Sel-sel tersebut dikultur dalam medium Eagle yang dimodifikasi Dulbecco (DMEM) yang mengandung 10% serum sapi janin dan 1% penisilin-streptomisin (Gibco, AS) selama 6 jam pada suhu 37°C, 5% CO 2 untuk membuang sel-sel yang tidak melekat. Selanjutnya, 50 ng/mL faktor perangsang koloni makrofag (Miltenyi Biotec, Jerman) ditambahkan, dan sel-sel tersebut dikultur selama 7 hari tambahan sebelum dipanen.
2.3 Sitometri Aliran
Reagen yang digunakan untuk flow cytometry meliputi CD14-FITC, CD68-PE, CD68-APC, CD8-FITC, CD8-APC, perforin-PE, granzyme B-PE, IgG1-FITC, IgG1-PE, dan IgG1-APC, IntraSure Kit untuk deteksi integritas membran, dan Annexin V-FITC Apoptosis Detection Kit (BD Biosciences, AS). Sampel dan data dianalisis menggunakan flow cytometer Beckman CytoFLEX.
2.4 Ekstraksi Total RNA, Transkripsi Balik cDNA, dan PCR Kuantitatif Real-Time (RT-qPCR)
Total RNA diekstraksi menggunakan metode TRIzol. Transkripsi balik untuk mensintesis cDNA dilakukan menggunakan cDNA First Strand Synthesis Kit, dan reaksi berantai polimerase kuantitatif (qPCR) transkripsi balik RT dilakukan menggunakan SuperReal PreMix Plus (SYBR Green) Kit (Tiangen, Tiongkok). Small interfering RNA digunakan untuk merobohkan ekspresi TLR4 seluler, dengan eksperimen yang disusun dalam kelompok tiga replikasi. Pustaka spesifik untai diurutkan secara bipartit (pola PE150) menggunakan platform Illumina Novaseq 6000, mengikuti protokol standar. Data eksperimen diselaraskan dengan genom referensi menggunakan Hisat2, dan karakteristik ekspresi gen dalam dan antar kelompok dianalisis secara statistik. Tingkat ekspresi gen dikuantifikasi menggunakan nilai FPKM (Fragmen Per Kilobase Juta) sebagai metrik utama.
2.5 Western Blotting
Total protein dari makrofag diekstraksi menggunakan penyangga radioimunopresipitasi (RIPA) dan fenilmetilsulfonil fluorida (PMSF) (Beijing Solarbio Science and Technology Co. Ltd., Tiongkok). Antibodi primer berikut digunakan: kelinci anti-β-aktin manusia, kelinci anti-gliseraldehida 3-fosfat dehidrogenase manusia (GAPDH), kelinci anti-interleukin (IL)-1β manusia, kelinci anti-IL-18 manusia, kelinci anti-NLRP3 manusia, kelinci anti-caspase-1 manusia, dan kelinci anti-gasdermin D manusia (GSDMD), semuanya dibeli dari Cell Signaling Technology (CST, AS). Antibodi primer kelinci anti-TLR4 manusia diperoleh dari Abcam (Cambridge, Inggris). IgG kambing anti-kelinci yang terkonjugasi peroksidase lobak dibeli dari Beyotime (Shanghai, Tiongkok). Gambar dianalisis menggunakan perangkat lunak ImageJ.
2.6 Penurunan Ekspresi TLR4 siRNA pada Makrofag Sumsum Tulang dari Pasien SAA
SiRNA TLR4 dirancang dan dibangun oleh Suzhou GenePharma (Shanghai, Tiongkok). Penurunan TLR4 pada makrofag dicapai dengan menggunakan Lipofectamine 3000 (Invitrogen) dan Opti-MEM (Gibco).
2.7 Intervensi Dengan TLR4-IN-C34 Pada Makrofag Sumsum Tulang Dari Pasien SAA
Makrofag sumsum tulang yang diinduksi dikumpulkan untuk intervensi. Kelompok perlakuan menerima 10 mM inhibitor TLR4 TLR4-IN-C34 (MCE, AS), sementara kelompok kontrol diobati dengan dosis setara dimetil sulfoksida (DMSO) (Beijing Solarbio Science & Technology Co. Ltd., Tiongkok). Kedua perlakuan diterapkan pada suhu 37°C dengan 5% CO 2 selama 6 jam.
2.8 Isolasi Sel T CD8+ Dari Sumsum Tulang Penderita SAA Menggunakan Metode Immunomagnetic Bead
Sel mononuklear sumsum tulang diekstraksi menggunakan sentrifugasi gradien densitas (Human Peripheral Blood Lymphocyte Separation Solution; Beijing Solarbio Science & Technology Co. Ltd., China). Untuk setiap 10 7 sel mononuklear, 80 μL buffer MACS dan 20 μL antibodi imunomagnetik CD8 ditambahkan, diikuti dengan inkubasi pada suhu 4°C dalam gelap selama 15 menit. Sel T CD8+ diisolasi menggunakan pemisah MACS dan kolom MS. Kemurnian sel yang diisolasi dinilai menggunakan Beckman CytoFLEX flow cytometer.
2.9 Ko-kultur Makrofag Sumsum Tulang dengan Sel CD8+ T dan K562 dari Pasien SAA
Sel T CD8+ yang telah disortir disuspensikan kembali dalam medium lengkap yang mengandung 1000 IU IL-2 (84% medium RPMI 1640, 15% serum sapi janin, dan 1% penisilin-streptomisin). Untuk setiap 106 sel , ditambahkan 10 μL reagen aktivasi dan proliferasi sel T (Miltenyi Biotec, Jerman). Makrofag, baik yang tidak diobati, yang mengalami knockdown siRNA TLR4, atau yang diobati dengan TLR4-IN-C34 untuk menghambat TLR4, dikultur bersama dengan sel T CD8+ pada rasio 1:1 selama 48 jam. Sel T CD8+ dari setiap kelompok dikumpulkan dan dikultur bersama dengan sel K562 pada rasio 1:1 selama 48 jam.
2.10 Analisis Statistik
Analisis statistik data eksperimen dilakukan menggunakan GraphPad Prism 7.0 dan IBM SPSS 23.0. Data tersebut dijelaskan sebagai berikut:
Untuk data kuantitatif yang terdistribusi normal: rata-rata ± deviasi standar.
Untuk data kuantitatif distribusi miring: median (rentang interkuartil).
Untuk data kategorikal: jumlah dan persentase.
Perbedaan antara dua kelompok sampel independen dinilai menggunakan uji- t . Korelasi antara variabel dianalisis menggunakan uji korelasi Pearson. Signifikansi statistik ditetapkan pada p < 0,05.
3 Hasil
3.1 Tingkat Ekspresi TLR4 pada Makrofag Sumsum Tulang Pasien SAA dan Korelasinya dengan Tingkat Keparahan Penyakit
3.1.1 Ekspresi TLR4 pada Makrofag Pasien SAA
Tingkat ekspresi relatif mRNA TLR4 pada makrofag dari pasien SAA dengan SAA dinilai menggunakan qRT-qPCR. Hasilnya menunjukkan bahwa ekspresi relatif mRNA TLR4 secara signifikan lebih tinggi pada kelompok SAA yang baru didiagnosis dibandingkan pada kelompok remisi ( p = 0,0038) dan kelompok kontrol ( p = 0,0323). Tidak ada perbedaan signifikan dalam ekspresi mRNA TLR4 antara kelompok remisi dan kelompok kontrol ( p = 0,2031) (Gambar 1B ).

GAMBAR 1
Buka di penampil gambar
Presentasi PowerPoint
Tingkat ekspresi TLR4 dalam makrofag sumsum tulang pasien dengan SAA dan korelasi dengan tingkat keparahan penyakit. SAA Signifikansi penggunaan ∗ p < 0,05; ∗∗ p < 0,01 menunjukkan signifikansi statistik.
Analisis western blot mengungkapkan bahwa tingkat ekspresi protein TLR4 lebih tinggi pada kelompok SAA yang baru didiagnosis dibandingkan pada kelompok remisi dan kontrol (Gambar 1C ).
3.1.2 Korelasi TLR4 dengan Indikator Klinis pada Pasien SAA
Tingkat ekspresi relatif TLR4 pada makrofag dari pasien dengan SAA berkorelasi negatif dengan indikator klinis, termasuk WBC ( p = 0,0013, r = −0,4016), RBC ( p = 0,0233, r = −0,2346), Hb ( p = 0,0193, r = −0,2445), dan PLT ( p = 0,0001, r = −0,4205) (Gambar 1D ).
3.2 TLR4 Dapat Berkontribusi pada Perkembangan Penyakit Autoimun dengan Mengaktifkan Jaringan Sinyal Pyroptosis–Inflamasi
Untuk menjelaskan peran mekanistik ekspresi TLR4 pada makrofag dalam imunopatogenesis SAA, kami melakukan analisis RNA-seq makrofag dari kelompok kontrol dan siTLR4.
3.2.1 Analisis GO
Analisis Gene Ontology (GO) mengungkapkan bahwa gen yang diekspresikan secara berbeda diperkaya dalam jalur yang terkait dengan pensinyalan reseptor kemokin dan kemotaksis sel imun, seperti sel pembunuh alami, limfosit, dan monosit (Gambar 2B ).

GAMBAR 2
Buka di penampil gambar
Presentasi PowerPoint
Perubahan dalam ekspresi gen jalur terkait peradangan imun setelah penekanan makrofag TLR4.
3.2.2 Analisis KEGG
Analisis Kyoto Encyclopedia of Genes and Genomes (KEGG) mengungkapkan perubahan signifikan pada jalur pensinyalan IL-17, sitokin dan reseptor, reseptor mirip NOD, dan TLR (Gambar 2C ).
3.2.3 Analisis GSEA
Analisis Pengayaan Set Gen (GSEA) menunjukkan bahwa gen yang terlibat dalam presentasi antigen, pensinyalan TLR, dan jalur nekrosis terprogram mengalami penurunan regulasi, sedangkan gen dalam jalur pensinyalan IL-17 dan Jak–STAT mengalami peningkatan regulasi (Gambar 2D ).
Kami berspekulasi bahwa dalam konteks disregulasi imun pada penyakit autoimun, jalur imun bawaan yang dimediasi TLR4 diaktifkan secara abnormal, yang memicu piroptosis. Hal ini mengakibatkan pelepasan sejumlah mediator inflamasi intraseluler dan pola molekuler terkait kerusakan (DAMP). Yang terakhir, yang bertindak sebagai ligan endogen untuk TLR4, memperkuat jaringan sinyal piroptosis-inflamasi dan memperburuk perkembangan dan progresi inflamasi autoimun.
3.3 Tingkat Ekspresi TLR4 pada Makrofag Pasien SAA dan Pengaruhnya terhadap Piroptosis Makrofag
3.3.1 Perubahan Ekspresi Gen Jalur Terkait Peradangan Imun Setelah Knockout Makrofag TLR4
Kami mengintegrasikan gen diferensial RNA-seq dan jalur pensinyalan TLR (Gambar 3A , sumber: KEGG ), dan melakukan validasi RT-qPCR pada gen yang terkait dengan imunitas bawaan, jalur pensinyalan TLR, jalur Jak–STAT, dan jalur faktor nuklir kappa-B (NF-κB) klasik. Hasil penelitian menunjukkan bahwa setelah penurunan ekspresi TLR4 pada makrofag, ekspresi gen jalur pensinyalan inflamasi, seperti TLR4 , MyD88 , STAT1 , STAT2 , dan CCR7 , diturunkan, sedangkan gen yang terkait dengan protein yang diinduksi interferon dan keluarga interferon dalam jalur imun bawaan meningkat. Hal ini menunjukkan bahwa TLR4 memainkan peran penting dalam keseimbangan antara respons pro- dan anti-inflamasi, yang berpotensi memperkuat jaringan pensinyalan inflamasi tubuh dengan menginduksi piroptosis makrofag.
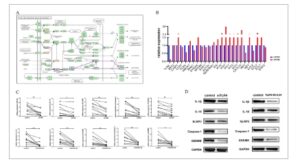
GAMBAR 3
Buka di penampil gambar
Presentasi PowerPoint
Efek penurunan atau penghambatan ekspresi makrofag TLR4 pada piroptosis pada pasien SAA. Signifikansi penggunaan ∗ p < 0,05; ∗∗ p < 0,01 menunjukkan signifikansi statistik.
3.3.2 Efek Knockdown atau Inhibisi Ekspresi TLR4 Makrofag terhadap Pyroptosis pada Pasien SAA
Berdasarkan hasil RNA-seq dan RT-qPCR, kami menurunkan ekspresi TLR4 pada makrofag dari pasien yang baru didiagnosis dengan SAA dan mengukur penanda terkait piroptosis. Kami menemukan bahwa setelah menurunkan TLR4, tingkat ekspresi mRNA relatif IL-1β, IL-18, NLRP3, caspase-1, dan GSDMD menurun (Gambar 3C ). Hasil western blot mengonfirmasi bahwa tingkat ekspresi IL-1β, IL-18, NLRP3, caspase-1, dan GSDMD pada makrofag dari pasien dengan SAA yang baru didiagnosis secara signifikan lebih rendah daripada yang ada pada kelompok kontrol setelah penghapusan TLR4 (Gambar 3D ).
TLR4-IN-C34 merupakan inhibitor TLR4. Setelah menambahkan TLR4-IN-C34 ke dalam sistem kultur, tingkat ekspresi relatif IL-1β, IL-18, NLRP3, caspase-1, dan GSDMD pada makrofag secara signifikan lebih rendah daripada yang ada pada kelompok kontrol (Gambar 3C ). Hasil Western blot mengonfirmasi bahwa setelah menambahkan TLR4-IN-C34, tingkat ekspresi protein IL-1β, IL-18, NLRP3, caspase-1, dan GSDMD pada makrofag secara signifikan lebih rendah daripada yang ada pada kelompok kontrol (Gambar 3D ).
3.4 Pengaruh Perubahan Kadar TLR4 Makrofag terhadap Efektivitas Pembunuhan Sel T CD8+ pada Pasien SAA
3.4.1 Perubahan Tingkat Ekspresi Perforin dan Granzyme B serta Fungsi Sitotoksiknya Setelah Ko-Kultur Sel T CD8+ dengan Makrofag Knockdown TLR4
Sel T CD8+ diisolasi dari pasien yang baru didiagnosis dengan SAA menggunakan manik imunomagnetik (Gambar 4A ).
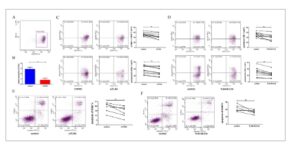
GAMBAR 4
Buka di penampil gambar
Presentasi PowerPoint
Pengaruh perubahan kadar TLR4 makrofag terhadap efektivitas pembunuhan sel T CD8+ pada pasien SAA. Signifikansi penggunaan ∗ p < 0,05; ∗∗ p < 0,01 menunjukkan signifikansi statistik.
Sel T CD8+ dikultur bersama dengan makrofag knockdown atau non-knockdown TLR4 dari pasien dengan SAA pada rasio 1:1 selama 48 jam. Analisis flow cytometry menunjukkan bahwa ekspresi perforin dalam sel T CD8+ secara signifikan lebih rendah pada kelompok knockdown (44,88% ± 10,29%) dibandingkan dengan kelompok kontrol (52,35% ± 7,159%) ( p = 0,0018), dan ekspresi granzyme B juga secara signifikan lebih rendah pada kelompok knockdown dibandingkan pada kelompok kontrol ( p = 0,0017) (Gambar 4C ).
Sel T CD8+ dikultur bersama dengan sel K562 selama 48 jam. Tingkat apoptosis sel K562 pada kelompok knockdown (13,85% ± 5,586%) secara signifikan lebih rendah dibandingkan dengan kelompok kontrol (18,64% ± 5,025%) ( p = 0,0090) (Gambar 4E ).
3.4.2 Perubahan Tingkat Ekspresi Perforin dan Granzyme B serta Fungsi Sitotoksiknya Setelah Ko-Kultur Sel T CD8+ dengan Makrofag yang Diobati dengan Inhibitor TLR4
Sel T CD8+ dari pasien dengan SAA yang baru terdiagnosis diisolasi menggunakan manik imunomagnetik.
Sel T CD8+ dikultur bersama dengan makrofag yang diobati dengan atau tanpa inhibitor TLR4 dari pasien dengan SAA pada rasio 1:1 selama 48 jam. Analisis flow cytometry menunjukkan bahwa ekspresi perforin pada sel T CD8+ secara signifikan lebih rendah pada kelompok inhibitor (40,69% ± 11,75%) dibandingkan pada kelompok kontrol (51,21% ± 9,415%) ( p = 0,0024), dan ekspresi granzim B juga secara signifikan lebih rendah pada kelompok inhibitor (23,16% ± 9,626%) dibandingkan dengan kelompok kontrol (30,15% ± 13,07%) ( p = 0,0023) (Gambar 4D ).
Sel T CD8+ dikultur bersama dengan sel K562 selama 48 jam. Tingkat apoptosis sel K562 pada kelompok inhibitor (16,57% ± 2,700%) secara signifikan lebih rendah dibandingkan dengan kelompok kontrol (21,70% ± 4,307%) ( p = 0,0343) (Gambar 4F ).
4 Diskusi
Imunopatogenesis SAA melibatkan ketidakseimbangan rasio Th1/Th2 di bawah stimulasi antigen yang tidak diketahui [ 19 ], peningkatan sekresi faktor regulasi negatif hematopoietik, dan proliferasi serta aktivasi berlebihan CTL, yang menyebabkan serangan abnormal pada sel induk/progenitor hematopoietik dan kegagalan sumsum tulang. Aktivasi abnormal sel T CD8+ yang menyerang sel induk/progenitor hematopoietik merupakan faktor penting dalam induksi pansitopenia [ 20 ].
Dalam penelitian ini, kami menyelidiki tingkat ekspresi TLR4 pada makrofag pasien dengan SAA dan efeknya pada sel T CD8+. Kami menemukan bahwa ekspresi TLR4 meningkat pada makrofag sumsum tulang pasien dengan SAA yang baru didiagnosis. Dengan menggunakan RNA pengganggu kecil untuk menekan atau menggunakan inhibitor guna mengurangi ekspresi TLR4 pada makrofag dari pasien dengan SAA, kami mengamati penurunan signifikan dalam ekspresi perforin dan granzim B pada sel T CD8+ setelah kultur bersama, yang mengakibatkan penurunan sitotoksisitas.
Oleh karena itu, kami yakin bahwa ekspresi tinggi TLR4 pada makrofag pasien SAA terkait dengan tingkat piroptosis-inflamasinya. Penghambatan ekspresi TLR4 dapat mengurangi piroptosis makrofag, mengganggu jaringan sinyal piroptosis-inflamasi, dan sebagian meringankan respons imun seluler yang diaktifkan secara berlebihan pada pasien SAA, sehingga memperbaiki gejala klinis.
TLR merupakan bagian dari keluarga reseptor pengenalan pola transmembran dan merupakan molekul kunci dalam aktivasi respons imun bawaan. TLR berpartisipasi dalam aktivasi sistem imun bawaan, termasuk respons nonspesifik (seperti produksi sitokin pro-inflamasi dan fagositosis) dan respons spesifik (termasuk respons spesifik terhadap patogen yang dimediasi oleh limfosit T dan B dalam sistem imun adaptif) [ 21 , 22 ]. Penelitian sebelumnya telah menunjukkan bahwa antibodi anti-double-stranded DNA (dsDNA) pada pasien dengan lupus nephritis dapat meningkatkan ekspresi dan aktivasi TLR4 dalam sel stroma, sehingga meningkatkan produksi titer tinggi antibodi DNA anti-double-stranded (anti-dsDNA) [ 23 ]. TLR4 diekspresikan secara tinggi dalam jaringan sinovial dan sel-sel fibrokartilago pasien dengan artritis reumatoid (RA) dan diperkirakan memainkan peran kunci dalam aktivasi fibroblas sinovial RA, yang menyebabkan peradangan kronis dan kerusakan sendi [ 24 ]. Zhang menemukan bahwa histone methyltransferase MLL1 menginduksi ekspresi TLR4 dengan memediasi H3K4me3 dalam promotor TLR4, sehingga mengaktifkan jalur pensinyalan TRIF/NF-κB, mendorong migrasi dan invasi sinoviosit mirip fibroblas pada pasien dengan RA, dan memperburuk perkembangan RA. Studi kami menemukan bahwa tingkat ekspresi TLR4 meningkat secara signifikan pada makrofag sumsum tulang pasien dengan SAA dan berkorelasi negatif dengan jumlah darah tepi, yang menunjukkan bahwa semakin tinggi ekspresi TLR4 pada makrofag, semakin parah kondisi SAA. Penurunan lebih lanjut dalam ekspresinya mengungkapkan bahwa kemampuan sitotoksik sel T CD8+ yang diaktifkan secara abnormal menurun pada pasien dengan SAA. Oleh karena itu, ekspresi TLR4 yang tinggi pada makrofag mungkin terlibat dalam ketidakseimbangan jaringan sinyal inflamasi dan aktivasi berlebihan sel T CD8+ pada SAA.
Pyroptosis adalah mekanisme kematian sel terprogram yang merupakan bagian dari respons imun bawaan terhadap invasi bakteri. Inflamasom adalah kompleks multiprotein yang disusun oleh reseptor pengenalan pola sitoplasma [ 8 ] dan merupakan komponen penting dari sistem imun bawaan. Mereka mengenali PAMP dan DAMP yang berasal dari inang. Sejumlah penelitian telah mengkonfirmasi bahwa stimulasi TLR dapat menginduksi aktivasi inflamasom NLRP3 [ 25 , 26 ]. Wang et al. [ 27 ] menemukan bahwa TLR4 mikroglia mengatur ekspresi dan fosforilasi TAK1, yang mengarah pada aktivasi NLRP3 dengan memodulasi neuroinflamasi dan mendorong perkembangan toleransi morfin. Hal ini menunjukkan bahwa menargetkan jalur pensinyalan TLR4-TAK1-NLRP3 untuk mengatur neuroinflamasi dapat menjadi terapi dan strategi alternatif untuk toleransi analgesik kronis yang diinduksi morfin. Penelitian telah menunjukkan bahwa inflammasome NLRP3 dapat mengaktifkan caspase-1, memecah pro-IL-1β dan pro-IL-18 menjadi bentuk matangnya, sehingga mengeluarkan sejumlah besar IL-1β dan IL-18 dan memicu piroptosis yang bergantung pada caspase-1. Lebih jauh lagi, caspase-1 yang teraktivasi memecah protein GSDMD, melepaskan domain GSDMD-N, yang berkumpul dengan lapisan dalam membran plasma, meningkatkan permeabilitas membran dan tekanan osmotik intraseluler, yang menyebabkan respons imun-inflamasi lokal. Bersamaan dengan itu, DAMP intraseluler dilepaskan secara ekstraseluler melalui struktur GSDMD-N, bertindak sebagai aktivator TLR4 endogen yang menstimulasi ulang TLR4 untuk menginduksi aktivasi inflammasome NLRP3 [ 26 ], sehingga memperkuat respons kaskade inflamasi dan memicu respons imun-inflamasi sistemik [ 9 – 13 ]. Kami berhipotesis bahwa pada pasien dengan SAA, inflammasome NLRP3 diaktifkan oleh antigen yang tidak diketahui, yang menginduksi piroptosis makrofag dan memperluas jaringan sinyal piroptosis-inflamasi, yang berkontribusi pada aktivasi berlebihan sel T CD8+. Oleh karena itu, kami merobohkan atau menghambat ekspresi TLR4 pada makrofag dari pasien dengan SAA secara in vitro dan mengukur kadar penanda terkait jalur piroptosis. Kami menemukan bahwa setelah knockdown atau penghambatan TLR4, kadar ekspresi IL-1β, IL-18, NLRP3, caspase-1, dan GSDMD menurun (Gambar 3C ), yang menunjukkan bahwa ekspresi TLR4 yang tinggi pada makrofag meningkatkan ketidakseimbangan imun-inflamasi melalui induksi piroptosis.
Dalam penelitian ini, kami menemukan bahwa TLR4 terkait erat dengan makrofag pada pasien SAA. Menghentikan TLR4 atau menggunakan inhibitor TLR4 secara signifikan mengurangi piroptosis makrofag dari pasien SAA. Lebih jauh, kultur bersama sel T CD8+ dengan makrofag dengan ekspresi TLR4 yang dihambat mengungkapkan bahwa sekresi perforin dan granzim B oleh sel T CD8+ berkurang secara nyata, dan aktivitas sitotoksiknya terhadap sel target menurun secara signifikan. Oleh karena itu, kami percaya bahwa ekspresi tinggi TLR4 pada makrofag pasien SAA terkait dengan tingkat piroptosis-inflamasinya. Penghambatan ekspresi TLR4 dapat mengganggu jaringan pensinyalan piroptosis-inflamasi, sehingga mengurangi respons imun seluler yang diaktifkan secara berlebihan sampai batas tertentu pada pasien SAA.
5 Kesimpulan
Peningkatan ekspresi TLR4 dalam makrofag pasien SAA memicu piroptosis dan memperkuat kaskade sinyal inflamasi, yang pada akhirnya menyebabkan proliferasi berlebihan dan aktivasi CTL. Aktivasi abnormal ini mengakibatkan serangan pada sel induk/progenitor hematopoietik, yang menyebabkan kegagalan sumsum tulang. Temuan kami menunjukkan bahwa TLR4 memainkan peran penting dalam imunopatogenesis SAA dan dapat berfungsi sebagai target potensial untuk imunoterapi.

