
Abstrak
Kanker ovarium (OC) merupakan penyebab utama kematian akibat kanker ginekologi pada wanita. Respons pasien yang buruk terhadap pengobatan menyoroti perlunya pemahaman yang lebih baik tentang bagaimana lingkungan mikro tumor memengaruhi perkembangan OC. Bukti yang berkembang menunjukkan peran penting komponen non-kanker, seperti fibroblas terkait kanker, dalam membangun jaringan interaksi seluler dan molekuler yang kompleks, yang memengaruhi perkembangan kanker dan respons terhadap pengobatan. Oleh karena itu, dalam penelitian ini, kami berusaha mengkarakterisasi dampak fibroblas pada perilaku sel OC dan respons obat. Dengan menggunakan sistem ko-kultur sel langsung dan tidak langsung, kami mengamati perubahan yang jelas dalam proliferasi, morfologi, dan sekretom sel kanker dengan adanya fibroblas. Lebih jauh lagi, penyaringan obat berbasis pencitraan dengan hasil tinggi dari 528 senyawa onkologi mengungkapkan beberapa obat yang menunjukkan kemanjuran yang berubah dalam kondisi ko-kultur, yang menunjukkan peran fibroblas dalam mendorong resistensi sel kanker terhadap pengobatan. Yang terpenting, data kami mengidentifikasi dua kombinasi obat Birinapant atau Vorinostat dengan Carboplatin sebagai pengobatan yang menjanjikan, memanfaatkan fenotipe sel kanker yang berubah dalam kultur bersama. Temuan ini didukung oleh peningkatan sensitivitas kultur ex vivo terhadap kombinasi ini.
Singkatan
ANAK-ANAK1
lampiran A1
AREA
amfiregulin
BRCA1/2
protein kerentanan kanker payudara tipe ½
BSA
albumin serum sapi
CA-125
antigen kanker 125 (musin-16)
CAF (Cafe Afrika)
fibroblas terkait kanker
Bahasa Indonesia: CD31
molekul adhesi trombosit dan sel endotel
CD90
antigen permukaan sel thy-1
CK8/18
keratin 8/18
cm
media terkondisi
CNA (Komunitas Perawat Nasional)
perubahan nomor salinan
CP
Analis CellProfiler
CPE
karboksipeptidase E
Bahasa Indonesia: CTSV
cathepsin V
D-CC
budaya bersama secara langsung
DMSO
dimetil sulfoksida
ECM
komponen matriks ekstraseluler
Asam EDTA
asam etilendiamintetraasetat
Petugas medis
transisi epitel-mesenkim
Kamera Ep
molekul adhesi sel epitel
Nomor ERBB4
reseptor tirosin kinase erb-b4
FBS
serum janin sapi
Klub Sepak Bola
lipat perubahan
FIMM
Institut Kedokteran Molekuler Finlandia
Sudut Pandang
bidang pandang
FSP-1
protein spesifik fibroblast-1
Gal-1
galektin-1
GPNMB
glikoprotein transmembran NMB
Bahasa Indonesia: HDAC
histon deasetilase
HGF
faktor pertumbuhan hepatosit
HGSOC
kanker ovarium serosa tingkat tinggi
hK8
kallrikrein-8
SDM
defisiensi rekombinasi homolog
saya-CC
budaya bersama tidak langsung
IC
Perangkat lunak IncuCyte ®
JIKA
imunofluoresensi
Bahasa Indonesia: ITGB5
integrin beta-5
JAK1
Janus kinase 1
KUH
Rumah Sakit Universitas Karolinska
MEK
mitogen-activated protein kinase kinase
MoA
mekanisme aksi
mTORC1/2
target mamalia rapamycin kompleks 1/2
Tidak ada
fibroblas non-kanker
NGI
infrastruktur genomik nasional
NPX
Ekspresi Protein yang Dinormalkan
PARP
poli (ADP-ribosa) polimerase
Bahasa Indonesia: PBS
garam penyangga fosfat
PDF dalam Bahasa Inggris
Fibroblas yang berasal dari pasien
PDPN
obat podoplanin
PEGPH20
Hialuronidase manusia rekombinan pegylated
PFA
paraformaldehida
PI3K
fosfoinositida 3-kinase
RSPO3
R-spondin
RT
suhu ruangan
SD
simpangan baku
SDSS
skor sensitivitas obat selektif
SMAC
aktivator caspases kedua yang berasal dari mitokondria
SMAD5
ibu-ibu menentang homolog decapentaplegik 5
SPARC
protein yang disekresikan bersifat asam dan kaya akan sistein
ssGSEA
analisis pengayaan set gen sampel tunggal
STAT
transduser sinyal dan aktivator transkripsi
STR
pengulangan tandem pendek
TFPI-2
penghambat jalur faktor jaringan 2
TGF-β
transformasi faktor pertumbuhan beta
TLR3
reseptor tipe tol 3
Waktu
lingkungan mikro tumor,
TRM
tetrametilrodamin, metil ester, perklorat
TNFRSF1
reseptor faktor nekrosis tumor 1
TP53
protein tumor53
Sayuran
faktor pertumbuhan endotel vaskular A
VIM
vimentin
WFDC2
protein epididimis-4
WISP-1
Protein 1 jalur pensinyalan yang dapat diinduksi WNT1
Bahasa Inggris XIAP
Protein penghambat apoptosis terkait kromosom X
SMA alfa
aktin otot polos alfa α-SMA
Perkenalan
Kanker ovarium serosa tingkat tinggi (HGSOC) adalah subtipe OC yang paling umum dan prevalen [ [ 1 , 2 ] ]. Hal ini ditandai dengan perubahan jumlah salinan (CNA) yang tinggi dan sedikit mutasi genetik berulang pada gen yang terkait dengan terapi yang ditargetkan. Sebaliknya, 95% pasien mengalami mutasi pada TP53 , yang menyebabkan gangguan perbaikan DNA, perubahan regulasi siklus sel, dan peningkatan proliferasi sel [ [ 3 ] ]. Saat ini, sebagian besar pasien menjalani operasi pengurangan massa sel secara sitoreduktif diikuti oleh kemoterapi platinum–taxol. Sementara respons awal terhadap pengobatan baik untuk sebagian besar pasien, sekitar 80% kambuh dalam waktu 5 tahun dengan waktu kekambuhan rata-rata 18 bulan [ [ 4 ] ]. Penatalaksanaan penyakit sekunder biasanya melibatkan kemoterapi berbasis platinum tambahan, tetapi banyak pasien mengembangkan resistensi, sehingga pilihan pengobatan terbatas [ [ 5 ] ]. Pemahaman yang lebih baik tentang perubahan genetik, seperti mutasi BRCA1/2 dan prevalensi tinggi defisiensi perbaikan rekombinasi homolog pada HGSOC telah menyebabkan penggunaan inhibitor poli (ADP-ribosa) polimerase (PARP) dan obat antiangiogenik [ [ 6 ] ]. Namun, tingkat kelangsungan hidup jangka panjang untuk pasien ini belum membaik secara signifikan [ [ 7 ] ], yang menyoroti perlunya mengeksplorasi kerentanan HGSOC di luar sel kanker dan perubahan genetiknya.
Bukti yang berkembang menunjukkan pentingnya komponen non-kanker, seperti fibroblas, adiposit, dan sel imun, dalam membentuk perkembangan tumor dan respons terhadap pengobatan [ [ 8 ] ]. Meskipun demikian, penelitian dalam pengembangan terapi kanker secara tradisional berfokus pada kerentanan sel kanker intrinsik. Sementara pendekatan ini telah memajukan pemahaman kita tentang HGSOC dan mekanisme penyakit yang dapat ditargetkan, pendekatan ini mengabaikan kompleksitas tumor dan lingkungannya, sehingga berpotensi kehilangan peluang untuk pengembangan strategi pengobatan baru [ [ 9 ] ]. Fibroblas terkait kanker (CAF), komponen utama dari lingkungan mikro tumor (TME), memainkan peran penting dalam perkembangan kanker dan respons obat. Sel-sel ini mengeluarkan komponen matriks ekstraseluler (ECM) (seperti kolagen, laminin, dll.) dan dengan demikian menginduksi perubahan pada sifat biomekanik tumor. Hal ini kemudian dapat menghalangi pengiriman obat ke sel kanker. Selain itu, molekul sekretori dan eksosom dari CAF menyediakan sel kanker dengan sinyal yang menghambat apoptosis atau menyebabkan resistensi obat melalui ekspresi gen yang diubah, yang pada akhirnya menyebabkan peningkatan kelangsungan hidup sel [ [ 10 , 11 ] ]. Oleh karena itu, upaya baru-baru ini telah diarahkan pada pengembangan perawatan yang ditargetkan yang mengganggu sinyal yang berasal dari TME dan dengan demikian meningkatkan pembunuhan sel tumor. Strategi ini termasuk menargetkan penanda fibroblas untuk menghilangkan CAF, membalikkan fenotipe CAF, atau memodulasi efek hilir CAF. Namun, ini tetap menjadi tujuan yang sulit dipahami, dan ada kebutuhan untuk memahami cara memanfaatkan kerentanan ini untuk meningkatkan pengobatan OC [ [ 10 ] ].
Dalam studi ini, kami bertujuan untuk mengkarakterisasi dampak fibroblas pada perilaku sel OC. Mengingat kurangnya model representatif untuk mempelajari efek CAF, kami telah membuat sistem kultur bersama in vitro yang memungkinkan penggunaan fibroblas yang berasal dari pasien dan fibroblas normal. Dengan menggunakan sistem ini, kami mengevaluasi efek langsung dan tidak langsung dari fibroblas pada proliferasi, morfologi, dan profil sekresi sel kanker. Lebih lanjut, kami melakukan skrining obat berthroughput tinggi untuk mengidentifikasi obat yang membuat sel kanker lebih sensitif dalam pengaturan kultur bersama. Pengujian kami mengidentifikasi penghambat histone deacetylase (HDAC), Vorinostat, dan mimetik aktivator kaspase turunan mitokondria kedua (SMAC), Birinapant, sebagai obat dengan potensi pembunuhan selektif yang lebih tinggi dalam kultur bersama. Relevansi klinis obat-obatan ini divalidasi dalam kultur OC ex vivo , yang menyarankan studi lebih lanjut untuk memvalidasi potensi penggunaannya dalam kombinasi dengan Carboplatin untuk pasien dengan OC.
Bahan dan metode
Ikhtisar studi
Garis sel OC ( n = 5) dan fibroblast ( n = 5) digunakan untuk penelitian ini. Untuk menilai perubahan yang disebabkan oleh interaksi sel, kami merancang sistem kultur bersama yang memungkinkan kami untuk menangkap efek populasi sel kanker dan fibroblast dalam pengaturan sel hidup dan tetap (Gbr. 1A ). Untuk menyelidiki efek yang bergantung pada kontak, sel dikultur dalam kultur bersama langsung (D-CC), sedangkan untuk efek yang tidak bergantung pada kontak, sel kanker ditumbuhkan dalam media yang dilengkapi dengan media terkondisi fibroblast (CM), yang menciptakan kultur bersama tidak langsung (I-CC). Kultur bersama dan monokultur digunakan untuk menentukan perubahan dalam proliferasi sel kanker, morfologi, profil sekresi sitokin, sensitivitas obat, dan temuan lebih lanjut divalidasi menggunakan kultur sferoid ex vivo yang mewakili pasien HGSOC.
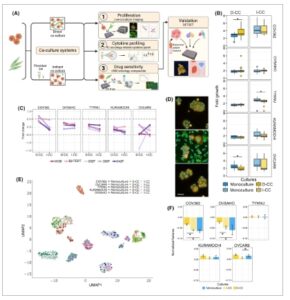 Gbr. 1
Gbr. 1
Buka di penampil gambar
Presentasi PowerPoint
Interaksi sel kanker dan fibroblas mengubah proliferasi dan morfologi sel kanker. (A) Gambaran skematis metode yang digunakan dalam penelitian ini untuk mengkarakterisasi dan mempelajari interaksi kanker dan fibroblas (Gambar dibuat dengan Biorender.com ). (B) Lipatan perubahan pertumbuhan sel kanker setelah 72 jam dalam monokultur dan ko-kultur dirata-ratakan untuk semua kultur fibroblas pada rasio 1 : 1. Data disajikan sebagai mean ± SD ( n = 8 untuk setiap kondisi), * P < 0,05 dari uji Mann-Whitney U. (C) Perbandingan antara ko-kultur langsung (D-CC) dan ko-kultur tidak langsung (I-CC) untuk sel kanker setelah 72 jam dalam kultur dengan lima fibroblas berbeda pada rasio 1 : 1. (D) Gambaran representatif morfologi sel OVSAHO dalam monokultur (atas), panel D-CC (tengah), I-CC (bawah), skala batang 200 μm (kuning adalah sel kanker yang telah diwarnai sebelumnya, hijau adalah sel fibroblas yang telah diwarnai sebelumnya, dan biru kehijauan adalah pewarnaan nukleus). (E) Representasi UMAP dari distribusi 318 fitur morfologi yang diekstraksi dari gambar sel kanker dalam berbagai kondisi kultur. Setiap lini sel dan kondisi kultur direpresentasikan oleh skema warna yang ditemukan dalam legenda gambar. Setiap titik merepresentasikan fitur sel kanker yang dirata-ratakan per sumur, n = 4–8 replikasi. (F) Perbandingan fitur morfologi yang dinormalisasi ( n = 318) antara kondisi monokultur dan ko-kultur untuk setiap lini sel kanker, dirata-ratakan untuk semua ko-kultur fibroblas ( n = 4–8 untuk setiap kondisi). Data disajikan sebagai mean ± SD ( n = 4–8 untuk setiap kondisi), * P < 0,05 dari uji Mann–Whitney U.
Kultur sel
Lini sel OC KURAMOCHI (RRID:CVCL_1345), OVCAR8 (RRID:CVCL_1629) dan OVSAHO (RRID:CVCL_3114) dipelihara dalam medium RPMI (BioWest, Sigma-Aldrich, Burlington, MA, AS); COV362 (RRID:CVCL_2420) (Sigma-Aldrich, AS) dan TYKNU (RRID:CVCL_1776) dikultur dalam medium DMEM (Sigma-Aldrich). Semua media lini sel kanker dilengkapi dengan 10% serum sapi janin (FBS) (Gibco, Thermo Fisher Scientific, Waltham, MA, AS), antibiotik 1x (streptomisin/penisilin) (Gibco, Thermo Fisher Scientific) dan 1X L-glutamin (Gibco, Thermo Fisher Scientific). Garis sel fibroblas kulit BJHTERT ( RRID:CVCL_6573 ) dipelihara dalam DMEM yang ditambah dengan 14,5% FBS, 16,5% Medium 199 (Sigma-Aldrich), dan antibiotik 1X; garis sel fibroblas paru WI38 ( RRID:CVCL_0579 ) (VWR, AS) dikultur dalam MEM/EBSS (Gibco, Thermo Fisher Scientific) yang ditambah dengan 10% FBS, 1x antibiotik, dan 1x asam amino nonesensial (Sigma-Aldrich). Fibroblas yang berasal dari pasien (PDF) dikultur dalam media DMEM yang dilengkapi dengan 10% FBS, 1x antibiotik, 1x l -glutamin, 5 μg·mL −1 insulin (Merk, Jerman), 0,4 μg·mL −1 hidrokortison (Sigma-Aldrich), dan 5 ng·mL −1 faktor pertumbuhan fibroblas dasar (Peprotech, Thermo Fisher Scientific). Semua sel dipelihara dalam inkubator 5% CO 2 -humidified pada suhu 37 °C dan dibagi setelah konfluensi mencapai ~70%. Lini sel kanker dan fibroblas BJHTERT diperoleh dari Institute Molecular Medicine Finland (FIMM) dan disediakan oleh Dr. Astrid Muramägi. Semua lini sel komersial (Tabel S1 ) divalidasi dengan short-tandem repeat (STR) sequencing (Eurofins, Luxembourg) dalam 3 tahun terakhir. Sel-sel disaring secara teratur untuk mengetahui adanya kontaminasi mikoplasma (Lonza, Swiss) sesuai dengan protokol pabrik. Semua percobaan dilakukan dengan sel-sel yang bebas mikoplasma.
Pembentukan model fibroblast yang berasal dari pasien
Fibroblas yang berasal dari pasien berasal dari bahan jaringan tumor pasien OC. Sampel diperoleh dari Rumah Sakit Universitas Karolinska (KUH) di Stockholm. Penelitian ini dilakukan berdasarkan izin etik yang disetujui (no. 2016/1197–31/1, no. 2018/2642–32 dan no. 2018/118–32) dari Otoritas Peninjauan Etika Swedia (Etikprövningsmyndigheten). Pasien menandatangani persetujuan sebelum pengumpulan bahan. Sampel diproses seperti yang dijelaskan oleh Åkerlund et al. [ [ 12 ] ] menggunakan kit disosiasi jaringan gentleMACS (Miltenyi, Jerman). Setelah disosiasi jaringan, sel ditanam ke dalam labu kultur sel. Setelah labu mencapai konfluensi 70–80%, tripsinisasi diferensial dilakukan. Secara khusus, setelah inkubasi selama 3 menit dengan TrypLE (Invitrogen, Waltham, MA, AS), fraksi sel yang terdisosiasi dikumpulkan, disuspensikan kembali dalam media kultur fibroblas, dan diputar. Setelah proliferasi yang konsisten tercapai, sel-sel ini diperbanyak untuk penyimpanan biologis dan validasi. Informasi klinis yang menjelaskan karakteristik bahan pasien disediakan dalam Tabel S1 .
Karakterisasi mutasi fibroblast yang berasal dari pasien
Jaringan tumor beku cepat, darah, asites, dan pelet sel PDF digunakan untuk melakukan pengurutan target. DNA diekstraksi dengan kit DNA/RNA AllPrep (Qiagen, Hilden, Jerman) menggunakan rekomendasi pabrik, konsentrasi dinilai dengan fluorometer Qubit (Invitrogen). Persiapan material lebih lanjut, pengurutan, dan analisis dilakukan di National Genomics Infrastructure (NGI) seperti yang dijelaskan sebelumnya [ [ 13 ] ]. Secara singkat, persiapan pustaka dilakukan dengan Kapa DNA HyperPrep (Roche, Bazel, Swiss) pengurutan berbasis target lebih lanjut dari panel ProBio (v3) dilakukan menggunakan pengurutan berpasangan Illumina pada sistem Nova Seq (Illumina, San Diego, CA, AS). Pemrosesan data selanjutnya dilakukan menggunakan jalur bioinformatika internal AutoSeq.
Pewarnaan kultur sel hidup
Sebelum pelapisan untuk pencitraan sel hidup dalam kultur bersama, sel diberi label dengan PKH-26 dan PKH-67 (Sigma-Aldrich), mengikuti rekomendasi pabrik. Konsentrasi pewarna dioptimalkan untuk setiap lini sel secara individual, berkisar dari 10 hingga 20 mm . Sel COV362, OVSAHO, dan TYKNU diwarnai dengan konsentrasi PKH-26 10, 15, dan 20 mm , berturut-turut. KURAMOCHI dan OVCAR8 diwarnai dengan PKH-67 10 mm . Fibroblas diwarnai dengan 10 mm dengan salah satu pewarna tergantung pada pasangan sel kanker. Proliferasi sel tidak terpengaruh oleh pewarnaan (Gbr. S1A ). Untuk pencitraan, total 2000 sel per sumur disemai ke pelat 384 sumur (CLS3764; Corning, New York, AS). Ketika tumbuh dalam D-CC, rasio sel kanker terhadap sel fibroblas yang berbeda diuji (1 : 4, 1 : 2, 1 : 1, 2 : 1, 4 : 1) dalam kombinasi dengan BJHTERT atau WI38; ketika dikultur dengan PDF, hanya satu rasio yang digunakan (1 : 1). Untuk I-CC, media sel kanker dilengkapi dengan 75% media terkondisi fibroblas. Untuk mempertahankan kondisi pertumbuhan sel kanker yang konsisten, kultur bersama tumbuh dalam media sel kanker masing-masing. Perubahan proliferasi minimal diamati antara fibroblas yang ditransformasi yang tumbuh dalam media yang direkomendasikan dibandingkan dengan media sel kanker yang digunakan dalam kultur bersama. Proliferasi PDF 032F dan 030F sedikit menurun dalam kultur dengan media DMEM/RPMI; namun, aktivitas metabolik yang diukur dengan CellTiter-Glo ® (CTG, Promega, Madison, WI, AS) tetap tidak berubah (Gbr. S1B ). Viabilitas sel diukur pada pembaca pelat Ensight (PerkinElmer, Shelton, CT, AS).
Persiapan media yang dikondisikan
Untuk mengumpulkan CM, sel-sel ditanam dalam tabung kultur T75 pada konsentrasi 1 × 106 sel dalam 13 mL media kultur sel kanker masing-masing. Sel-sel diinkubasi selama 72 jam untuk mencapai konfluensi 60–90%. Kemudian CM dikumpulkan, disentrifugasi selama 5 menit pada 700 xg, disaring melalui saringan 0,2 mm, dan sebagian disimpan pada suhu -80 °C hingga digunakan.
Olink menargetkan 96 pengujian onkologi II dan analisis data
Sampel dikumpulkan dari sel dalam monokultur dan D-CC seperti dijelaskan di atas. Sampel murni (tidak diencerkan) dianalisis menggunakan panel Onkologi II seperti yang dijelaskan oleh Olink Biosciences (Uppsala, Swedia) [ [ 14 ] ]. Hasil dari 92 sitokin diberikan sebagai nilai Ekspresi Protein Ternormalisasi (NPX), disajikan sebagai log 2 (Tabel S2, S3 ). Untuk menilai perubahan spesifik ko-kultur, perubahan lipatan ganda (dualFC) dihitung berdasarkan perbandingan monokultur kanker dan fibroblas. Untuk melakukan ini, pertama, nilai teoritis dihitung berdasarkan hasil monokultur, yang kemudian dibandingkan dengan nilai ko-kultur dari uji Olink. Hal ini memungkinkan kami untuk menentukan profil sekresi yang muncul dari ko-kultur sambil memperhitungkan efek monokultur.

Pewarnaan imunofluoresensi dan pengobatan obat
Pewarnaan imunofluoresens (IF) digunakan untuk menentukan sensitivitas obat sel kanker, untuk mengevaluasi ekspresi penanda PDF dan mengukur efek WISP-1 pada respons sel terhadap rapalog. Untuk skrining obat, sel ditanam dalam rasio sel kanker terhadap sel fibroblas 1 : 1 dan dipaparkan ke pustaka yang berisi 528 senyawa yang disetujui dan sedang diteliti yang diperoleh dari FIMM HTB [ [ 15 ] ]. Untuk evaluasi efek WISP-1, sel KURAMOCHI, OVCAR8, dan OVSAHO disuspensikan kembali dalam media yang mengandung 0, 10, dan 200 pg·mL −1 WISP-1 dan disemai ke pelat yang berisi obat yang diinginkan. Semua obat ditambahkan ke pelat 384-well (6 007 688, Revvity, Waltham, MA, AS) menggunakan sistem pengeluaran cairan akustik Echo550 (Beckman/Labcyte, Brea, CA, AS). Sel-sel ditanam ke dalam pelat obat yang telah diberi titik menggunakan Multidrop Combi (Thermo Fisher Scientific) dan dirawat selama 72 jam dalam inkubator. Sel-sel difiksasi dengan 4% PFA/PBS (Thermo Fisher Scientific) selama 10 menit setelah permeabilisasi 10 menit dengan 0,3% Triton-100X/PBS (Thermo Fisher Scientific) dan pemblokiran selama 1 jam dengan PBS yang mengandung 3% bovine serum albumin (Sigma-Aldrich). Pelat diinkubasi semalaman pada suhu 4 °C dengan antibodi primer yang diencerkan dalam 1% BSA dalam 0,1% Tween-20 (Thermo Fisher Scientific). Pada hari berikutnya, antibodi sekunder ditambahkan dan diinkubasi selama 1 jam pada suhu kamar. Setelah selesai, sel-sel diwarnai dengan Hoechst 33342 (Invitrogen) selama 15 menit pada suhu RT. Pencucian dilakukan di antara setiap langkah menggunakan mesin cuci pelat otomatis Biotek EL405 (AH Diagnostics, Aarhus, Denmark). Pelat dicitrakan dalam waktu 1 minggu setelah pewarnaan. Protokol pewarnaan ini juga digunakan untuk studi ekspresi penanda PDF, sementara sel dengan WISP-1 diwarnai hanya untuk Hoechst 33342. Antibodi dan konsentrasi yang digunakan dalam semua pengujian dinyatakan dalam Tabel S4 .
Pencitraan
Proliferasi sel hidup diukur setiap 12 jam selama 72 jam menggunakan sistem IncuCyte ® S3 (Sartorius, Jerman) (IC) yang menghasilkan urutan gambar 7 titik waktu. Gambar diperoleh pada 4x, menangkap 1 bidang pandang (FOV) dalam saluran fluoresensi merah, dan hijau. Set data yang tersisa dicitrakan menggunakan sistem penyaringan konten tinggi OperaPhenix (Revvity, AS). Gambar morfologi sel diperoleh pada 20x menggunakan 9 FOV dengan tumpang tindih 3% 72 jam setelah kultur. PDF yang diwarnai IF, monokultur kanker, dan kultur bersama dicitrakan pada 10x, menangkap 4 FOV dengan tumpang tindih 5% 72 jam setelah perawatan obat. Kultur ex vivo hidup-mati diperoleh pada 10x, mengukur 1 FOV dari 20 bidang tumpukan-z pada 0 dan 72 jam setelah perawatan obat.
Analisis gambar
Analisis gambar proliferasi sel hidup dilakukan dengan perangkat lunak IC (Sartorius, Jerman) atau analis CellProfiler v4.2.4 [ [ 16 ] ] (CP) untuk mengekstrak area yang ditutupi sel kanker berdasarkan keberadaan pewarna yang berbeda. Modul keluaran untuk IC disebut “Total Area (mm2/Image)” dan “Confluence%”, sedangkan keluaran CP adalah: “AreaOccupied”.
Untuk menganalisis jumlah sel dan ciri morfologi dari pengujian monokultur dan kultur bersama, pertama-tama kami menggabungkan semua FOV menggunakan pustaka Python3 PIL untuk membuat gambar sumur utuh. Gambar yang digabungkan ini kemudian dikoreksi untuk iluminasi yang tidak merata menggunakan modul CP “CorrectIlluminationCalculate” dan “CorrectIlluminationApply”. Selanjutnya, kami menerapkan algoritma pembelajaran mendalam Stardist2D (2D_versitile_fluo) untuk menyegmentasikan inti, yang menyediakan jumlah inti total dalam pengujian kultur bersama. Selanjutnya, untuk memahami perubahan morfologi pada sel kanker yang disebabkan oleh kondisi D-CC dan I-CC, kami menggunakan CP untuk mengekstraksi ciri morfologi sel tunggal, termasuk intensitas, ukuran dan bentuk objek, dan granularitas, yang menghasilkan total 318 ciri per gambar. Keluaran akhir berisi nilai rata-rata agregat yang dinormalisasi ke kontrol DMSO yang mewakili setiap sumur.
Gambar yang mewakili eksperimen validasi PDF dianalisis menggunakan perangkat lunak Harmony v5.2 (Revvity). Pertama, inti sel dan saluran antibodi difilter menggunakan Gaussian smoothing untuk mengurangi noise. Selanjutnya, masker inti sel dibuat (metode “M”) yang digunakan untuk menemukan sitoplasma sel (metode “B”). Terakhir, pemilihan populasi dilakukan untuk memperhitungkan autofluoresensi. Data akhir menentukan jumlah inti sel dengan ekspresi penanda positif per sumur.
Citra sel sferoid eks vivo dianalisis menggunakan perangkat lunak Harmony. Di sini, wilayah citra yang mewakili sel positif TMRM dan POPO-1 dihasilkan, dan volume sferoid dihitung dengan mengurangi wilayah sel hidup dan mati. Keluaran akhir mencakup fitur yang menggambarkan agregat 3D.
Analisis data
Analisis data dan visualisasi dilakukan menggunakan R v4.3.1 dan Prism9 v10 (GraphPad Software, Boston, MA, USA). Untuk menentukan profil mutasi sel kanker, data ekspresi gen dan variasi jumlah salinan (CNV) diambil dari portal DepMap (22Q2) ( https://depmap.org/portal ) [ [ 17 ] ]. Untuk mengevaluasi pertumbuhan lipatan proliferasi sel hidup, titik waktu 12 jam digunakan sebagai dasar untuk menentukan perubahan proliferasi dari waktu ke waktu. Koreksi kelompok uji morfologi sel dilakukan menggunakan paket R “Harmony” v1.2.0. Validasi CAF menunjukkan persentase sel positif penanda berdasarkan jumlah inti total. Skor sensitivitas obat dihitung untuk skrining obat menggunakan perangkat lunak Breeze berbasis web (FIMM, Finlandia) dengan metode DSS2 dan kurva logika 4-parametrik (4-PL) [ [ 18 ] ]. Kualitas skrining obat dinilai dengan menghitung Z’ (Tabel S5 ). Sinergi dievaluasi dengan menghitung skor sinergi ZIP menggunakan paket R “synergyfinder” v3.8.2. Analisis statistik dilakukan dalam R v4.3.1. Perbedaan antara kelompok yang dibandingkan dianalisis dengan uji Mann–Whitney U (jumlah peringkat Wilcox) dua sisi; hasilnya dianggap signifikan secara statistik jika P < 0,05. Data eksperimen disajikan sebagai rata-rata ± simpangan baku (SD), dari dua hingga delapan replikasi teknis tergantung pada pengujian.
Pengujian obat ex vivo
Pengujian obat dilakukan seperti yang dijelaskan sebelumnya oleh Åkerlund et al. [ [ 12 ] ] dengan beberapa modifikasi. Singkatnya, sel-sel setelah disosiasi tumor dibekukan secara layak. Untuk pengujian obat, sel-sel dicairkan dan ditanam ke dalam pelat 384-sumur (Corning) dengan perubahan media setelah 48 jam dan perawatan obat setelah 5 hari pasca-penanaman. Perawatan sel dilakukan dengan menggunakan Apricot ® S3 (SPT LabTech, Inggris) untuk mengangkat obat yang diencerkan dalam media dari pelat yang telah diberi bintik (Greiner, Austria) pada pelat sel. Pelat pengujian dicitrakan pada 3 jam dan 72 jam setelah perawatan dengan menilai sinyal sel hidup (TMRM) dan mati (POPO-1).
Karakterisasi sferoid eks vivo menggunakan flow cytometry
Setelah mencairkan sampel pasien, sebagian sel digunakan untuk flow cytometry guna menentukan komposisi sel. Pertama, sampel dicuci dengan PBS dan dipisahkan menjadi sel tunggal menggunakan TrypLE (Thermo Fisher). Setelah inkubasi selama 15–30 menit, sel dicuci dengan media sel primer (RockiT), diikuti dengan pencucian dalam PBS, dan akhirnya disuspensikan kembali dalam buffer MACS (0,5% BSA, 2 m m EDTA, PBS) pada konsentrasi ~1 × 106 sel ·mL −1 . Suspensi sel diblokir selama 10 menit dengan Human TrueStain FcX™ (BioLegend, AS), dan 100 ⎧L suspensi dipindahkan ke sumur dalam pelat 96 sumur (Greiner, Austria) dan disentrifugasi. Berikutnya, sel-sel disuspensikan kembali dalam koktail antibodi (Tabel S4 ) dan diinkubasi selama 20 menit pada suhu 4 °C dalam gelap. Ini diikuti oleh pencucian dengan buffer MACS dan pewarna 7-AAD (BD Biosciences, AS) selama 7 menit. Sel-sel kemudian disuspensikan kembali dalam 200 ⎧L buffer MACS. Akuisisi data dilakukan dengan menggunakan flow cytometer Attune NxT dengan autosampler CytKick (ThermoFisher, AS) dan dianalisis menggunakan perangkat lunak FlowJo v10.6.0 (BD Biosciences). Kontrol fluoresensi minus satu (FMO) digunakan untuk mengoreksi tumpang tindih spektral, sementara kontrol isotipe yang cocok disertakan untuk menentukan sinyal latar belakang. Hamburan maju dan samping digunakan untuk menggerbangkan sel-sel tunggal. Populasi sel hidup ditentukan berdasarkan penanda 7-AAD (BD Biosciences). Untuk penggerbangan lebih lanjut, semua sel hidup dinilai untuk ekspresi CD45 dan EpCam. Sel CD45 + EpCam- digerbangkan untuk semua penanda yang tersisa guna menentukan populasi leukosit. Sel CD45-EpCam+ digerbangkan untuk semua penanda yang tersisa guna mengidentifikasi populasi EpCam+CD24 ±, sementara sel mirip EMT mengekspresikan penanda EpCam+ dan PDPN atau CD90. Terakhir, sel CD45-EpCam- digerbangkan untuk menentukan populasi sel endotel (CD31+), mesotel (PDPN+) dan sel stroma (CD90+).
Hasil
Proliferasi dan morfologi sel kanker berubah karena adanya fibroblas
Untuk menyelidiki interaksi antara sel kanker dan fibroblas, kami memilih panel lini sel yang mewakili HGSOC berdasarkan mutasi, ekspresi gen, dan profil CNV dari data yang tersedia untuk umum [ [ 17 , 19 ] ] yang mencakup fitur molekuler HGSOC yang relevan. Kami memastikan penggunaan lini sel yang membawa mutasi pada TP53 (Gbr. S1C ). Selain itu, sel kanker yang digunakan dalam penelitian ini memiliki status defisiensi rekombinasi homolog (HRD) yang berbeda (Gbr. S1D,E daftar gen yang dinilai dalam Tabel S6 ). Di antara lini sel yang dipilih, KURAMOCHI dan COV362 menunjukkan HRD yang paling terganggu, dan TYKNU paling sedikit. Panel lini sel menunjukkan profil ekspresi gen yang heterogen (Gbr. S1F ) dan CNV pada gen yang terkait dengan HGSOC (Gbr. S1G ). Untuk mengeksplorasi secara komprehensif dampak asal fibroblas, kami menggunakan fibroblas nonkanker (NF) yang tersedia secara komersial dan PDF yang diisolasi dari jaringan OC pasien primer.
Kemurnian PDF yang ditetapkan divalidasi melalui profil ekspresi penanda dan dikonfirmasi oleh tidak adanya mutasi terkait OC. Semua fibroblas mengekspresikan aktin otot polos alfa (α-SMA), vimentin (VIM), dan protein-1 spesifik fibroblas (FSP-1), meskipun pada tingkat yang bervariasi (Gbr. S1H,I ). Sementara kadar FSP-1 yang tinggi diamati pada semua fibroblas, hanya sel WI38 dan 032F yang menunjukkan ekspresi tinggi dari α-SMA dan VIM (≥45%). Sel-sel 030F positif untuk VIM, tetapi tidak untuk α-SMA (35%). Menariknya, sel-sel BJHTERT dan 042F menunjukkan α-SMA yang tinggi, tetapi VIM yang rendah (masing-masing 15% dan 44%). Khususnya, hanya sel-sel 042F yang mengekspresikan penanda sel epitel CK8/18 tingkat tinggi. Mengingat bahwa CAF dapat berasal dari berbagai jenis sel asal [ [ 20 ] ], profil ekspresi penanda 042F yang unik menunjukkan bahwa ia mungkin mewakili subtipe fibroblas berbeda yang berasal dari sel epitel dan menjalani transisi epitel-mesenkimal (EMT). Selain itu, temuan kami didukung oleh penelitian lain yang melaporkan bahwa fibroblas OC dapat menunjukkan ekspresi penanda sel epitel, termasuk sitokeratin 8, 18, dan 19 [ [ 21 ] ] . Meskipun ekspresi penanda bervariasi, mutasi somatik yang ditemukan pada jaringan kanker atau cairan asites yang sesuai tidak ada dalam populasi PDF, yang mengonfirmasi asal non-kanker mereka (Gbr. S1J ). Selain itu, PDF yang digunakan dalam penelitian ini berasal dari pasien yang didiagnosis dengan berbagai subtipe OC (Tabel S1 ), yang berpotensi menjelaskan heterogenitas yang diamati dalam ekspresi penanda.
Untuk memahami efek kontak antara sel kanker dan sel fibroblas, kami membuat uji ko-kultur fleksibel berdasarkan pencitraan sel hidup. Dengan menggunakan metode ini, kami menyelidiki efek ko-kultur langsung (Gbr. S1K ) dan tidak langsung (Gbr. S1L ), memantau dinamika proliferasi sel kanker selama 72 jam dan mengungkap pola ketergantungan yang berbeda. Secara khusus, sel COV362 menunjukkan peningkatan pertumbuhan dalam D-CC dibandingkan dengan monokultur (FC = 1,32, P = 0,0029 pada rasio 1 : 1) setelah 72 jam, sedangkan proliferasi OVCAR8 menurun dalam D-CC (FC = 0,76, P = 0,0002 pada rasio 1 : 1; Gbr. 1B ). Hanya sel TYKNU yang menunjukkan perubahan signifikan secara statistik dalam I-CC dibandingkan dengan monokultur ( P = 0,0018), meskipun perubahannya tidak substansial (FC = 0,9). Sebaliknya, sel KURAMOCHI dan OVSAHO tidak menunjukkan perubahan proliferasi signifikan dalam kultur bersama (FC = 0,93 dan 1,1, masing-masing pada rasio 1 : 1). Selain itu, untuk sebagian besar lini sel yang diuji, efek proliferasi tidak bergantung pada rasio sel kanker-fibroblas. Namun, peningkatan proliferasi secara bertahap diamati dalam OVSAHO dan WI38 D-CC. Di sini, proliferasi sel OVSAHO berlipat ganda pada rasio fibroblas yang lebih tinggi (FC = 4 pada 1 : 4 D-CC kanker:fibroblas masing-masing, dan FC = 1,9 dalam monokultur OVSAHO). Namun, tren ini tidak diamati dalam kultur bersama OVSAHO dengan fibroblas lain (Gbr. S1K ). Selain itu, efek yang diamati tampaknya tidak bergantung pada asal fibroblas, karena perubahannya bervariasi terutama berdasarkan sel kanker. Secara keseluruhan, kontak langsung dengan fibroblas memiliki efek yang lebih nyata pada proliferasi sel kanker dibandingkan dengan kontak tidak langsung (Gbr. 1C ).
Selain perubahan dalam kapasitas proliferatif, kami mengamati perubahan mendalam dalam morfologi sel kanker dalam lingkungan kultur bersama. Ada perubahan yang jelas dalam sitoplasma sel dan ukuran inti, serta kekompakan koloni sel pada D-CC (Gbr. 1D ). Untuk mengukur ini, kami melakukan analisis reduksi dimensionalitas dari 318 fitur morfologi sel, yang mengungkapkan pola unik untuk setiap lini sel kanker. Dalam kebanyakan kasus, sel monokultur dan sel I-CC cenderung mengelompok bersama (Gbr. 1E , Gbr. S1M ). Sementara monokultur TYKNU, COV362, dan KURAMOCHI mengelompok dengan sel I-CC secara terpisah dari D-CC, OVCAR8 dan OVSAHO menunjukkan tumpang tindih pengelompok antara kondisi kultur. Selain itu, kami mengukur deviasi dalam ruang fitur antara kondisi, di mana fitur morfologi sel COV362 dan OVSAHO dalam D-CC secara signifikan berbeda dibandingkan dengan monokultur dan I-CC, sementara morfologi sel OVCAR8 secara signifikan berbeda antara D-CC dan I-CC, tetapi tidak monokultur (Gbr. 1F ). Menariknya, perubahan morfologi sel TYKNU kecil, dan sementara kami melihat klaster D-CC terpisah dari monokultur dan I-CC, jarak antar klaster kecil. Kami juga mengamati korelasi negatif yang lemah antara profil morfologi dan perubahan proliferasi (Gbr. S1N ). Meskipun ekspresi penanda CAF bervariasi antara fibroblas, kami tidak menemukan perbedaan signifikan dalam morfologinya; morfologi 042F mirip dengan PDF yang tersisa, serta NF (Gbr. S1O ). Secara keseluruhan, proliferasi sel dan perubahan morfologi menunjukkan korelasi yang lemah, dengan sel yang menunjukkan tingkat proliferasi paling berubah (COV362 dan OVCAR8) morfologi di D-CC. Dengan demikian, temuan kami menggarisbawahi dampak interaksi langsung antara sel fibroblas dan sel kanker pada tingkat proliferasi dan morfologi. Dalam penelitian kami, perubahan ini tidak bergantung pada asal fibroblas, tetapi lebih dibentuk oleh sel kanker.
Profil sitokin mengungkapkan efek ko-kultur yang unik
Karena kami mengamati efek D-CC yang lebih kuat dibandingkan dengan I-CC, kami melakukan profil sitokin dari 92 molekul menggunakan platform Olink Biosciences pada D-CC dan monokultur untuk lebih jauh membedah hubungan molekuler antara kedua populasi ini. Analisis ini mengungkapkan perubahan sitokin yang signifikan dengan tanda tangan yang berbeda tergantung pada sel kanker dalam kultur (Gbr. 2A ; Gbr. S2A ). Pengelompokan hierarkis menunjukkan bahwa sel KURAMOCHI dan OVSAHO mengelompok bersama berdasarkan profil sekresi, sementara sel TYKNU mengelompok dengan monokultur fibroblas. Khususnya, berdasarkan analisis data ekspresi gen dari portal DepMap [ [ 17 ] ], kami mengamati bahwa KURAMOCHI dan OVSAHO memiliki tingkat ekspresi penanda sel mirip epitel yang lebih tinggi dibandingkan dengan lini sel kanker lainnya (Gbr. S2B ; Tabel S6 ). Selain itu, proyeksi set gen metastasis dan invasif menunjukkan bahwa OVCAR8, TYKNU, dan COV362 memiliki sifat EMT yang lebih tinggi daripada KURAMOCHI dan OVSAHO (Gbr. S2C ). Perbedaan ini menunjukkan bahwa status EMT dan tanda tangan ekspresi gen yang mendasarinya dapat memengaruhi profil sekresi yang diamati. Kami juga mengidentifikasi perbedaan dalam sekresi sitokin antara sel kanker dan sel fibroblas (Gbr. 2B ). Di antara itu, Cathepsin V (CTSV) (log 2 FC = 7,2, P = 0,002), suatu protease yang terlibat dalam degradasi ECM [ [ 22 ] ], disekresikan secara eksklusif oleh sel kanker. Sebaliknya, monokultur fibroblas menunjukkan kadar galectin-1 (Gal-1) yang signifikan lebih tinggi (log 2 FC = 3,0, P = 0,029), integrin beta-5 (ITGB5) (log 2 FC = 2,1, P = 0,017) dan protein yang disekresikan bersifat asam dan kaya akan sistein (SPARC) (log 2 FC = 1,6, P = 0,019), yang semuanya berperan dalam interaksi sel-sel dan sel-ECM [ [ 23 – 25 ] ] (Gbr. 2C ; Gbr. S2D ). Di antara fibroblas, 042F menunjukkan kadar sekresi sitokin total yang signifikan lebih tinggi (Gbr. 2D ). Perbandingan sekresi sitokin PDF memang menunjukkan bahwa 032F dan 030F memiliki profil yang lebih mirip (Gbr. S2E ), dibandingkan dengan 042F (Gbr. S2F ). Mengingat perbedaan dalam profil sekresi sitokin 042F dan profil ekspresi penanda CAF yang berbeda, 042F dikecualikan dari perbandingan berikutnya pada Gambar 2E,F . PDF yang tersisa (032F dan 030F) menunjukkan peningkatan sekresi sitokin yang terkait dengan metastasis dan penyebaran penyakit (ANAX1, CPE, GPNMB, VEGFA, VIM, WISP-1) [[ 26 – 28 ] ], dibandingkan dengan NF. Selain itu, PDF menunjukkan sekresi sitokin yang lebih tinggi yang terkait dengan efek tumorigenik pleotropik (SMAD5, TLR3, TFPI-2) [ [ 28 , 29 ] ] (Gbr. 2E ). Kami juga mengamati perbedaan dalam profil sekresi sel kanker mirip epitel (KURAMOCHI dan OVSAHO) dan mirip mesenkim (COV362, OVCAR8, TYKNU). Sel-sel mirip epitel menunjukkan sekresi protein terkait OC yang secara signifikan lebih tinggi, seperti tirosin kinase reseptor erb-b4 (ERBB4) (log 2 FC = 4,5, P = 0,002), kallikrein-8 (hK8) (log 2 FC = 6,2, P = 0,038) dan protein epididimis-4 (WFDC2) (log 2 FC = 7,1, P = 0,049) (Gbr. 2F ; Gbr. S2G ). ERBB4 dan hK8 dikaitkan dengan hasil OC yang lebih baik [ [ 30 , 31 ] ], sementara WFDC2 dapat berkontribusi pada perubahan TME yang menyebabkan perkembangan penyakit [ [ 32 ] ]. Perbandingan global menunjukkan kadar sitokin sekretori yang secara signifikan lebih tinggi dalam kultur bersama dibandingkan dengan kedua kultur tunggal (kanker monokultur P = 0,002, fibroblast monokultur P < 0,0001) (Gbr. 2G ). Untuk menyelidiki perubahan spesifik kultur bersama, perhitungan dualFC dilakukan. Analisis ini mengungkapkan bahwa faktor pertumbuhan hepatosit (HGF), protein jalur pensinyalan yang dapat diinduksi WNT1 1 (WISP-1), dan R-spondin (RSPO3) menunjukkan efek spesifik kultur bersama, meskipun ini tidak signifikan secara statistik (Gbr. 2H ; Gbr. S2H ). Kokultur sel KURAMOCHI, OVSAHO, dan OVCAR8 menunjukkan sekresi HGF yang lebih rendah dan peningkatan kadar WISP-1 dibandingkan dengan kedua kultur tunggal. Kedua protein ini terkait dengan pertumbuhan pada beberapa jenis kanker termasuk OC [ [ 33 , 34 ] ]. Validasi lebih lanjut mengonfirmasi peningkatan kadar WISP-1 dalam kultur bersama KURAMOCHI, OVSAHO, dan OVCAR8 seperti yang terdeteksi dalam uji Olink (dualFC rata-rata = 1,45) (Gbr. S2I ). Untuk lebih memahami dampak fungsional WISP-1, sel-sel KURAMOCHI, OVSAHO, dan OVCAR8 dipaparkan pada konsentrasi WISP-1 yang tinggi dan rendah (10 dan 200 pg·mL −1 ). Namun, WISP-1 sendiri tidak mengubah proliferasi sel secara signifikan (Gbr. S2J ). Meskipun demikian, WISP-1 mengubah respons sel terhadap inhibitor yang menargetkan mTORC1/2, salah satu jalur yang diaktifkan oleh WISP-1 [ [ 35 ]]. KURAMOCHI dan OVCAR8 menunjukkan sensitivitas tinggi terhadap Temsirolimus (penghambat mTORC1) dan Sapanisertib (penghambat mTORC1/2), sementara OVSAHO menunjukkan sensitivitas lebih rendah terhadap Temsirolimus daripada Sapanisertib (Tabel S7 ). Dengan adanya WISP-1 (10 atau 200 pg·mL −1 ), sel kanker menunjukkan peningkatan resistensi terhadap obat-obatan ini. Temsirolimus menunjukkan penurunan sitotoksisitas pada semua lini sel dengan adanya WISP-1; namun, dampak dari berbagai konsentrasi WISP-1 bervariasi di ketiga lini sel kanker. KURAMOCHI lebih resistan terhadap Temsirolimus dengan meningkatnya konsentrasi WISP-1 (DSS 25 dengan 10 dan 10 dengan 200 pg·mL −1 WISP-1) Sel OVSAHO paling resistan terhadap Temsirolimus dengan adanya 200 pg·mL −1 WISP-1 (DSS 7,5 tanpa WISP-1 dan 0,3 dengan 200 pg·mL −1 WISP-1), sementara sel OVCAR8 lebih resistan terhadap Temsirolimus pada konsentrasi WISP-1 yang lebih rendah (DSS 24,2 tanpa WISP-1 dan 6,6 dengan 10 pg·mL WISP-1). Sementara respons terhadap Sapanisertib menunjukkan tren yang sama, efek obat tetap tinggi dalam semua kondisi (DSS > 20) (Gbr. 2I ). Pengamatan ini menunjukkan bahwa WISP-1 mungkin berperan dalam peningkatan resistensi obat pada sel kanker dan mengubah jalur mTOR, pengatur utama pertumbuhan, kelangsungan hidup, dan metabolisme sel. Singkatnya, dengan menggunakan panel 92 sitokin, kami mengidentifikasi beberapa sitokin yang berubah dalam kondisi kultur bersama dan profil sekresi bersifat unik untuk setiap kultur bersama.
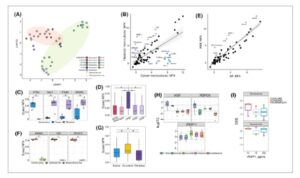
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Profil sitokin mengungkap perbedaan antara monokultur dan kokultur. (A) Plot UMAP dari profil sekresi sel monokultur dan kokultur. Titik-titik diwarnai berdasarkan kondisi kultur menurut legenda; lingkaran elips berwarna terang menandai sel kanker mirip epitel (merah)/mesenkim (hijau) dalam plot. (B) Plot sebar yang menyoroti perbedaan dalam profil sekresi antara monokultur sel kanker dan fibroblas untuk 92 sitokin yang diprofilkan. Setiap titik adalah ekspresi protein ternormalisasi rata-rata (NPX) untuk populasi sel. (C) Boxplot yang menunjukkan sitokin dengan perbedaan signifikan secara statistik antara monokultur kanker dan fibroblas, ditampilkan sebagai NPX berskala (0 hingga 1), * P < 0,05 dari uji Mann–Whitney U. (D) Kotak diagram yang menggambarkan perbedaan sekresi sitokin secara keseluruhan antara model fibroblas yang digunakan dalam penelitian ini, ditunjukkan sebagai NPX berskala (0 hingga 1), * P < 0,05 dari uji Mann–Whitney U. (E) Scatterplot yang menyoroti perbedaan profil sekresi antara monokultur fibroblas non-kanker (NF) dan yang berasal dari pasien (PDF), untuk 92 sitokin yang diprofilkan. Setiap titik adalah NPX rata-rata untuk populasi sel. (F) Kotak diagram yang menunjukkan perbedaan sekresi sitokin antara monokultur sel kanker mirip epitel/mesenkim, ditunjukkan sebagai NPX berskala (0 hingga 1), * P < 0,05 dari uji Mann–Whitney U. (G) Perbandingan profil sekresi antara dua monokultur dan kondisi ko-kultur, ditunjukkan sebagai NPX berskala (0 hingga 1), * P < 0,05 dari uji Mann–Whitney U. (H) Kotak diagram yang menggambarkan sitokin yang disekresikan paling berbeda antara kultur bersama dan kultur tunggal dari kedua jenis sel, dinyatakan sebagai dualFC, * P < 0,05 dari uji Mann–Whitney U. (I) Kotak diagram yang menggambarkan sensitivitas obat tanpa dan dengan media yang ditambah WISP-1.
Pemeriksaan kultur bersama menyoroti dampak fibroblas pada respons obat
Bahasa Indonesia: Untuk lebih jauh menentukan dampak ko-kultur pada sensitivitas obat sel kanker, kami melakukan penyaringan berbasis pencitraan konten tinggi untuk membandingkan respons obat dalam monokultur sel kanker dan D-CC. KURAMOCHI, model penyakit yang kurang agresif, dan OVCAR8, yang lebih agresif, dipilih untuk pengujian obat berdasarkan karakteristik molekuler dan kompatibilitasnya dengan pengujian (Gbr. S3A ). Dengan menggunakan pencitraan IF, kami dapat membedakan dua populasi sel dalam ko-kultur dan mengevaluasi responsnya terhadap 528 obat (Tabel S8 ). Perbandingan antara monokultur dan ko-kultur mengungkapkan sensitivitas obat yang secara signifikan lebih tinggi ( P = 0,018) dalam monokultur sel kanker (Gbr. 3A ), yang menunjukkan bahwa fibroblas, sebagai salah satu komponen TME, menginduksi resistensi kemoterapi [ [ 36 ] ]. Kami juga mengamati distribusi respons obat yang lebih besar dalam sel kanker dalam ko-kultur, yang menunjukkan respons heterogen tergantung pada konteks. Kami menemukan bahwa 65% ( n = 335) obat memiliki sensitivitas yang meningkat pada setidaknya satu kondisi kultur (skor respons obat (DSS) <4). Di antara obat yang diuji, 28% menunjukkan kemanjuran yang lebih besar dalam monokultur sel kanker, 17% dalam ko-kultur, dan 55% tidak menunjukkan perubahan dalam kemanjuran obat meskipun ada perubahan TME (DSS selektif (sDSS) > 2, Gambar 3B ). Menariknya, sel kanker dalam ko-kultur dengan fibroblas WI38 menunjukkan resistensi obat yang secara signifikan lebih tinggi ( P = 0,002), sementara keberadaan fibroblas BJHTERT memiliki efek yang kurang jelas ( P = 0,27). Sementara kedua ko-kultur menunjukkan sensitivitas obat sel kanker yang berkurang, sel KURAMOCHI memiliki penurunan sensitivitas yang lebih besar dibandingkan dengan OVCAR8 (sDSS = 1,25 dan 0,49 berturut-turut) (Gambar 3C ; Gambar S3B ). Khususnya, kami menemukan bahwa WI38 mengeluarkan kadar sitokin yang lebih tinggi dibandingkan dengan BJHTERT (Gbr. 3D ; Gbr. S3C ), yang mungkin berkontribusi terhadap perbedaan yang diamati dalam respons obat. Sel kanker dalam kultur bersama dengan BJHTERT lebih sensitif terhadap inhibitor MEK, PI3K, dan mTOR (Gbr. S3D ). Temuan ini dapat dikaitkan dengan sekresi GPNMB oleh sel BJHTERT, protein yang diketahui dapat meningkatkan jalur PI3K dan berpotensi mengubah respons terhadap inhibitor PI3K [ [ 37 ]]. Sebaliknya, WI38 mengeluarkan sitokin seperti HGF dan AREG, yang diketahui mengaktifkan jalur MEK, PI3K, dan mTOR. Memang, sel kanker dalam kultur bersama dengan WI38 menunjukkan peningkatan resistensi terhadap inhibitor yang menargetkan jalur ini. Hal ini menunjukkan adanya mekanisme alternatif dalam sel kanker yang memberikan perlindungan terhadap obat-obatan ini. Resistensi terhadap inhibitor MEK telah dikaitkan dengan HGF pada melanoma [ [ 38 ] ] sementara resistensi terhadap inhibitor PI3K telah dikaitkan dengan AREG, di antara faktor-faktor lainnya [ [ 39 ] ].
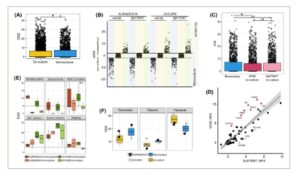
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Skrining ko-kultur mengungkap resistensi sel kanker terhadap obat-obatan di hadapan fibroblas. (A) Perbandingan respons obat antara monokultur sel kanker dan ko-kultur, dinyatakan sebagai skor sensitivitas obat (DSS), * P < 0,05 dari uji Mann-Whitney U. (B) Distribusi obat-obatan yang secara berbeda mensensitisasi ko-kultur dan mono-kultur, garis menunjukkan DSS selektif (sDSS) ± 2. (C) Perbandingan respons obat antara monokultur kanker dan ko-kultur dengan fibroblas BJHTERT dan WI38, * P < 0,05 dari uji Mann–Whitney U. (D) Perbandingan tingkat sekresi sitokin monokultur BJHTERT dan WI38, yang menyoroti sitokin yang disekresikan secara berbeda di antara sel-sel. (E) Subkelas obat yang menunjukkan respons obat yang paling berubah tergantung pada kondisi TME, * P < 0,05 dari uji Mann–Whitney U. (F) Kotak diagram yang menggambarkan respons obat monokultur dan kokultur KURAMOCHI dan OVCAR8 terhadap pengobatan standar.
Pustaka obat yang digunakan dalam penelitian ini terdiri dari delapan kelas obat yang mewakili 49 subkelas obat berdasarkan mekanisme aksi (MoA) (Tabel S9 ). Beberapa kelas MoA terwakili lebih banyak daripada yang lain, dengan subkelas terkecil berisi dua obat dan yang terbesar lebih dari 30. Meskipun demikian, kami telah mengamati beberapa tren (Gbr. S3E,F ). Monokultur adalah yang paling sensitif terhadap kemoterapi konvensional. Di antara berbagai MoA, agen alkilasi, glukokortikoid, dan inhibitor MEK1/2 menunjukkan efek pembunuhan pada monokultur KURAMOCHI dan OVCAR8. Menariknya, sel-sel KURAMOCHI dalam kultur bersama lebih sensitif terhadap rapalog, BET, dan inhibitor kinesin, sementara sel-sel OVCAR8 dalam kultur bersama menunjukkan resistensi yang lebih tinggi terhadap subkelas obat-obatan ini. Beberapa subkelas obat lain menunjukkan perbedaan antara kondisi monokultur dan kultur bersama (Gbr. 3E ; Gbr. S3G ); namun, perbedaan ini tidak signifikan. Khususnya, obat-obatan yang digunakan dalam manajemen OC standar juga dipengaruhi oleh kondisi ko-kultur (Gbr. 3F ; Gbr. S3H ). Sel-sel kanker dengan adanya fibroblas menunjukkan resistensi yang lebih tinggi terhadap pengobatan Carboplatin (sDSS keseluruhan = 5,2). Olaparib, yang digunakan untuk pengobatan HRD OC, menurunkan respons pada sel-sel KURAMOCHI dari DSS = 11,4 dalam monokultur menjadi 5,95 dalam ko-kultur (sDSS = 5,45). Menariknya, meskipun respons monokultur OVCAR8 terhadap Olaparib lebih lemah, sel-sel kanker dalam ko-kultur tidak terpengaruh seperti KURAMOCHI (sDSS = 0,7). Akhirnya, respons Paclitaxel meningkat setelah ko-kultur di kedua lini sel kanker (sDSS rata-rata = 7). Obat ini menargetkan sel-sel yang berkembang biak dengan cepat; namun, uji proliferasi kami menunjukkan yang sebaliknya – proliferasi (diukur berdasarkan area yang ditempati) menurun. Hasil ini menunjukkan bahwa keberadaan fibroblas meningkatkan kerentanan sel kanker terhadap obat ini melalui mekanisme alternatif. Secara keseluruhan, kami telah mengamati penurunan respons sel kanker terhadap pengobatan obat dalam kultur bersama, termasuk obat yang digunakan dalam pengaturan klinis.
Vorinostat dan Birinapant sebagai pengobatan kombinasi potensial untuk OC
Meskipun penyaringan obat tidak mengidentifikasi kelas obat spesifik yang secara konsisten memengaruhi sel kanker di bawah perubahan sistematis TME, data kami mengungkapkan beberapa obat yang lebih efektif dalam menargetkan sel kanker dalam kondisi ko-kultur. Secara khusus, kami memilih obat atau molekul kecil yang menunjukkan respons rendah dalam monokultur (DSS < 10), tetapi memiliki dampak yang lebih besar dalam ko-kultur (DSS >5 dengan sDSS≥4). Pendekatan ini mengarah pada identifikasi 10 obat yang menunjukkan kurva respons obat yang kuat dan sensitivitas diferensial tergantung pada kondisi ko-kultur (Gbr. 4A ). Menariknya, sebagian besar obat ini memiliki efek yang berlawanan pada lini sel KURAMOCHI dan OVCAR8. Namun, satu obat, penghambat HDAC Vorinostat, secara signifikan mensensitisasi kedua lini sel kanker dalam ko-kultur (sDSS = 4,1 dan 10,55, berturut-turut) di penyaringan (Gbr. S4B ). Efek ini juga terlihat dalam gambar fluoresensi (Gbr. S4A ). Selain itu, Birinapant menunjukkan efek yang kuat dalam kultur bersama OVCAR8 (sDSS = 9,0) (Gbr. S4C ). Analisis lebih lanjut menggunakan pengayaan jalur ssGSEA dari portal DepMap [ [ 17 ] ] mengungkapkan bahwa baik lini sel KURAMOCHI dan OVCAR8 menunjukkan peningkatan regulasi pada target HDAC (skor pengayaan masing-masing 0,15 dan 1,7), yang menunjukkan bahwa kedua lini sel tersebut secara inheren lebih responsif terhadap inhibitor HDAC. Sebaliknya, jalur respons apoptosis yang diatur SMAC-XIAP hanya diperkaya pada lini sel OVCAR8 (skor pengayaan 0,11), yang sejalan dengan data respons obat kami (Gbr. S4D ). Dari gen-gen dalam jalur ini, HDAC2 dan TNFRSF1, masing-masing, berkorelasi paling baik dengan pola respons yang diamati, dan penelitian masa depan yang menyelidiki ini sebagai biomarker potensial akan menarik (Gbr. S4E ).
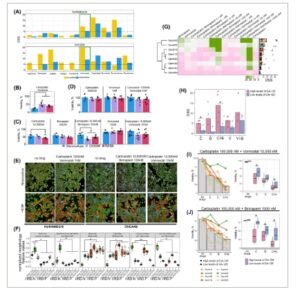
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Vorinostat dan Birinapant yang dikombinasikan dengan Carboplatin menunjukkan efek sinergis dalam kultur sel bersama dan spheroid ex vivo . (A) Seperangkat obat yang menunjukkan respons obat selektif terhadap sel kanker KURAMOCHI atau sel OVCAR8 dalam kultur bersama. Persegi panjang hijau menandai Vorinostat, obat yang menghambat pertumbuhan kedua sel kanker yang diuji dalam kultur bersama. Hasil eksperimen validasi selanjutnya, yang menunjukkan respons sel kanker KURAMOCHI dan OVCAR8 dalam monokultur dan kultur bersama. Batang menunjukkan viabilitas rata-rata setelah pengobatan 72 jam, setiap titik mewakili replikasi biologis dan teknis ( n = 9), * P < 0,05 dari uji Mann–Whitney U: (B) respons terhadap Carboplatin pada konsentrasi 10000 nm , (C) respons OVCAR8 terhadap pengobatan tunggal Carboplatin, Vorinostat, Birinapant dan kombinasinya, (D) respons KURAMOCHI terhadap Carboplatin, Vorinostat, pengobatan tunggal dan kombinasinya. (E) gambar imunofluoresensi yang mewakili kultur sel monokultur sel kanker dan kultur bersama dengan 030F, dengan dan tanpa pengobatan. Hijau pada gambar mewakili sel kanker, diwarnai dengan CK8/18, dan oranye – fibroblas diwarnai dengan vimentin, biru – inti diwarnai dengan Hoechst, skala batang 200 μm. (F) Ciri morfologi spheroid ex vivo yang dihasilkan dari material pasien, diagram kotak menunjukkan perbedaan antara setiap sampel, titik-titik menunjukkan replikasi teknis ( n = 12), * P < 0,05 dari uji Mann-Whitney U. (G) Gambaran umum peta panas respons ex vivo pasien terhadap Vorinostat, Carboplatin, dan Birinapant sebagai agen tunggal dan pengobatan kombinasi. Pengelompokan hierarki sampel tanpa pengawasan dilakukan dengan menggunakan metrik jarak Euclidean. Diagram batang di samping menunjukkan rata-rata respons obat secara keseluruhan. (H) Perbandingan respons obat sampel antara kelompok kadar CA-125 tinggi dan rendah, titik-titik menunjukkan setiap pasien, * P < 0,05 dari uji Mann-Whitney U. Di sini C sesuai dengan Carboplatin, V – Vorinostat, B – Birinapant. Respons obat sampel saat diobati dengan obat tunggal dan kombinasi. Batang di sisi kiri menunjukkan setiap perubahan viabilitas sampel saat diobati; batang menunjukkan nilai rata-rata. Sementara diagram kotak di sebelah kanan menggambarkan perbedaan antara viabilitas kelompok CA-125 tinggi dan rendah dalam pengobatan ( n = 3), * P < 0,05 dari uji Mann–Whitney U: I – menggambarkan hasil setelah pengobatan Carboplatin 100.000 nm dan Vorinostat 10.000 nm ; J – menggambarkan hasil setelah pengobatan Carboplatin 100.000 nm dan Birinapant 1000 nm . Di sini C sesuai dengan Carboplatin, V – Vorinostat, B – Birinapant.
Mengingat bahwa Vorinostat dan Birinapant lebih efektif dalam kultur bersama, kami berusaha untuk mengeksplorasi kombinasi mereka dengan Carboplatin sebagai strategi untuk meningkatkan rejimen terapi standar. Untuk mengevaluasi ini, kami menguji efek pada sel kanker dalam kultur bersama dengan WI38 dan 030F, fibroblas yang berasal dari HGSOC (Tabel S10 , Gambar S4F ). Pengobatan Carboplatin menunjukkan peningkatan sensitivitas pada sel KURAMOCHI, dengan perbedaan yang signifikan pada konsentrasi Carboplatin 10000 nm , menghasilkan viabilitas 24% dalam monokultur dan 47% dalam kultur bersama ( P = 0,0001) (Gambar 4B ). Namun, sel OVCAR8 tidak menunjukkan perbedaan yang signifikan, dengan viabilitas rata-rata 50% dalam semua kondisi (Gambar S4G ). Anehnya, dalam studi validasi ini, baik OVCAR8 dan KURAMOCHI tidak menunjukkan perbedaan yang signifikan dalam respons obat antara kondisi kultur ketika diobati dengan Vorinostat atau Birinapant (Gbr. S4H,I ), tidak seperti yang ditunjukkan sebelumnya. Kami mengamati bahwa kompleksitas kultur kanker dan fibroblas sulit dikendalikan antara replikasi biologis. Meskipun penghitungan sel yang ketat, kami menemukan bahwa rasio sel kanker dan fibroblas antara replikasi biologis yang terpisah bervariasi; satu replikasi mempertahankan rasio sel kanker dan fibroblas yang sama setelah 72 jam dalam kultur, sementara dua replikasi lainnya memiliki peningkatan rasio sel kanker dalam kultur bersama (Gbr. S4J,K ). Yang penting, ekspresi penanda fibroblas WI38 dan 030F konsisten di seluruh percobaan (Gbr. S4L ). Namun demikian, data kami mengungkapkan peningkatan sensitivitas obat terhadap kombinasi obat dalam kondisi kultur bersama. Pengobatan dengan kombinasi Carboplatin 10.000 nm dan Birinapant 100 nm menunjukkan penurunan yang signifikan dalam viabilitas sel OVCAR8 dalam kultur bersama ( P = 0,004) yang menghasilkan viabilitas rata-rata sebesar 42%. Pengobatan Vorinostat kurang efektif; namun, kombinasi Carboplatin 10.000 nm dan Vorinostat 10 nm menghasilkan perbedaan 23% dalam viabilitas sel antara kondisi kultur dalam sel OVCAR8 (Gbr. 4C ) Meskipun KURAMOCHI tidak menunjukkan sensitivitas yang kuat terhadap kombinasi obat ini, kombinasi Carboplatin 1000 nm dan Vorinostat 1 nm menurunkan viabilitas sel kanker hingga 17% dibandingkan dengan monokultur (Gbr. 4D ). Secara keseluruhan, sistem kultur bersama menyoroti tantangan dari desain eksperimen tersebut tetapi juga menunjukkan bahwa sel kanker memang dipengaruhi oleh keberadaan fibroblas dan penting dalam membentuk biologi sel kanker.
Bahasa Indonesia: Untuk lebih jauh mengeksplorasi potensi kombinasi Carboplatin dengan Vorinostat atau Birinapant, kami menggunakan material pasien untuk meniru kondisi in vivo dengan lebih baik. Kami menggunakan kultur 3D ex vivo dari jaringan tumor terdisosiasi dari pasien HGSOC representatif dengan stadium klinis serupa pada diagnosis dari biobank kami (Tabel S11 ) dan menerapkan platform DET3CT [ [ 12 ] ] untuk menentukan respons obat. Kami memilih total delapan pasien yang memiliki HGSOC stadium lanjut dan berbagai kadar CA-125 (160–7370 U·mL −1 ). Selain itu, sampel-sampel ini juga menunjukkan status HRD positif (HRD-P: Gem119, Gem030, Gem015, Gem129, Gem243) dan negatif (HRD-N: Gem105, Gem059, Gem031). Menariknya, status HRD tampaknya memengaruhi morfologi spheroid (Gbr. S4M ). Rata-rata, sampel HRD-P membentuk spheroid yang lebih kecil tetapi lebih bulat dibandingkan dengan sampel HRD-N (Gbr. 4F ). Analisis gambar kami mengidentifikasi perbedaan antara morfologi spheroid pasien HRD-N dan HRD-P, yang menunjukkan hubungan intrinsik antara status HRD dan arsitektur spheroid.
Pengobatan obat ex vivo menunjukkan bahwa sebagian besar pasien tidak merespons dengan baik terhadap monoterapi dengan Carboplatin, Vorinostat, atau Birinapant (rata-rata DSS = 3,3, 4,7, 4,2 berturut-turut) (Tabel S12 , Gambar G). Sementara Gem243 dan Gem031 adalah yang paling sensitif terhadap pengobatan obat tunggal (rata-rata DSS 9,7 dan 7,2 berturut-turut), sampel yang tersisa tidak menunjukkan respons yang signifikan (DSS <5). Selain itu, komposisi seluler bervariasi di antara sampel pasien (Gambar S4N ). Sementara Gem119 menunjukkan proporsi sel CD45+ yang tinggi (95% dari sel hidup), sampel yang tersisa mengandung persentase sel kanker yang lebih tinggi (setidaknya 45% dari semua sel hidup). Selain itu, semua sampel, kecuali Gem015, mengandung kompartemen sel stroma, meskipun tidak melebihi 13%. Menariknya, data kami mengungkap korelasi antara keberadaan populasi sel kanker mirip EMT dan peningkatan kadar CA-125, sementara tidak ada korelasi kuat yang diamati antara kadar CA-125 dan populasi sel EpCam+ lainnya (Gbr. S4O ). Secara keseluruhan, kelompok sampel CA-125 tinggi menunjukkan sensitivitas lebih tinggi terhadap obat yang diuji, khususnya untuk kombinasi Birinapant dan Carboplatin ( P = 0,013) (Gbr. 4H ). Untuk mengevaluasi respons kombinasi obat, skor sinergi ZIP dihitung (Tabel S13 ). Sinergi tinggi secara keseluruhan (ZIP>10) diamati pada Gem105 untuk kombinasi Vorinostat dan Birinapant dengan Carboplatin (ZIP 14,8 dan 12,4 berturut-turut). Gem031 dan Gem015 menunjukkan efek kombinasi obat antagonis (ZIP > −10) untuk kombinasi Vorinostat. Khususnya, sampel-sampel ini memiliki beberapa respons agen tunggal tertinggi terhadap Vorinostat. Untuk semua sampel yang tersisa, efek aditif (−10 < ZIP<10) diamati. Perlakuan obat menunjukkan efek yang kuat pada konsentrasi yang lebih tinggi pada kedua kombinasi obat (Gbr. S4O,P , Tabel S14 ). Pada 100.000 nm Carboplatin dan 10.000 nm Vorinostat , viabilitas sel turun di bawah 30% pada sebagian besar sampel, menunjukkan pembunuhan yang lebih besar dibandingkan dengan kedua efek obat tunggal, di mana viabilitas adalah 48 dan 37% untuk Carboplatin dan Vorinostat masing-masing (Gbr. 4I ). Meskipun kombinasi 100.000 nm Carboplatin dan 1000 nm Birinapant menunjukkan pembunuhan yang lebih sedikit (rata-rata 35%), peningkatan pembunuhan diamati di seluruh sampel pada konsentrasi obat ini, dengan pengecualian Gem059 (Gbr. 4J ). Perlakuan dengan 100.000 nm Carboplatin dan 1000 nmBirinapant menyebabkan penurunan viabilitas sel hingga 26,7%, dibandingkan dengan viabilitas 48 dan 62% untuk obat tunggal. Selain itu, kedua pengobatan kombinasi obat menunjukkan kemanjuran yang lebih besar dalam sampel dengan kadar CA-125 yang tinggi, khususnya dengan kombinasi Birinapant dan Carboplatin, di mana perbedaan antara kedua kelompok adalah tiga kali lipat.
Pengobatan kombinasi obat secara keseluruhan menunjukkan peningkatan kematian sel, terutama untuk kelompok sampel dengan kadar CA-125 yang tinggi; namun, responsnya bergantung pada dosis. Hasil kami memerlukan penelitian lebih lanjut dalam kelompok pasien yang lebih besar untuk menyempurnakan pemahaman tentang karakteristik pasien yang memprediksi respons yang baik terhadap pengobatan tersebut.
Diskusi
Dalam penelitian ini, tujuan kami adalah untuk memahami efek fibroblas pada perilaku sel OC dan respons obat. Perhatian yang semakin meningkat diarahkan pada dampak TME pada perkembangan kanker dan respons terhadap pengobatan [ [ 40 ] ]. CAF, sebagai komponen penting TME, telah terbukti memengaruhi perkembangan OC dan resistensi kemoterapi. Sementara upaya telah dilakukan untuk menargetkan ketergantungan kanker pada pensinyalan CAF yang mendukung, sayangnya, masih banyak tantangan [ [ 10 ] ]. Dengan demikian, sangat penting untuk memahami bagaimana sel kanker berubah dengan adanya CAF dan untuk mengidentifikasi kerentanan baru yang muncul pada interaksi ini.
Data kami menunjukkan bahwa sel kanker merespons CAF secara heterogen, yang menyebabkan perubahan dalam proliferasi dan morfologi sel. Kami mengamati peningkatan dan penurunan proliferasi sel kanker, terutama dalam kondisi D-CC, yang menunjukkan bahwa kontak sel-ke-sel memiliki dampak yang lebih besar daripada faktor yang disekresikan fibroblas saja. Di seluruh studi literatur, ada hasil yang saling bertentangan mengenai dampak CAF pada proliferasi dan pertumbuhan sel kanker. Misalnya, efek yang tidak bergantung pada kontak terbukti menyebabkan perubahan proliferasi pada sel kanker usus besar [ [ 41 ] ]; namun, pada sel kanker melanoma, CM meningkatkan invasi tetapi tidak proliferasi [ [ 42 ] ]. Variasi yang diamati kemungkinan bergantung pada pengaturan eksperimental, karena faktor yang disekresikan oleh fibroblas saja berbeda dari yang disekresikan ketika fibroblas terpapar pada sel kanker [ [ 43 ] ]. Ini sebagian dapat menjelaskan efek CM fibroblas yang lebih lemah dalam penelitian kami. Plastisitas dan heterogenitas morfologi sel kanker terkait dengan prognosis dan agresivitas penyakit [ [ 44 ] ]. Oleh karena itu, TME berperan dalam mengubah morfologi sel kanker yang tidak dapat ditiru dalam pengaturan monokultur. Misalnya, fibroblas secara langsung memengaruhi fleksibilitas fenotipik dan keseluruh sel kanker melanoma, yang menyebabkan penyakit yang lebih agresif [ [ 45 ] ]. Dalam penelitian ini, kami berfokus pada perubahan morfologi sel, yang telah terbukti menjadi cara yang ampuh untuk mempelajari kanker, mengungkap status sel kanker [ [ 46 ] ]. Data kami mengungkapkan pergeseran yang jelas dalam morfologi sel kanker dalam kondisi D-CC. Sebaliknya, fitur morfologi tetap mirip dengan monokultur pada I-CC. Yang penting, pergeseran morfologi dalam kultur bersama bergantung pada garis sel kanker, yang menunjukkan kompleksitas dan lintasan penyakit yang unik terhadap sifat genetik dan fenotipik individu. Peran pendukung CAF dalam perkembangan kanker juga memungkinkan kelangsungan hidup sel kanker setelah pengobatan. Dengan mengubah fitur ECM fisik dan mengeluarkan sitokin, CAF berkomunikasi dengan sel kanker [ [ 47 ] ]. Misalnya, sekresi VEGFA mendorong angiogenesis dan pertumbuhan tumor, IL6 mengaktifkan jalur STAT/JAK1 yang meningkatkan plastisitas sel kanker, dan TGF-β menginduksi EMT, kapasitas invasi sel dan resistensi terhadap pengobatan [ [ 9 ] ]. Data kami menunjukkan adanya sitokin ini dalam monokultur fibroblas, dengan tingkat VEGFA dan TGF-β yang jauh lebih tinggi dalam PDF, sel yang dididik secara in situ, menunjukkan kemampuan mereka yang aktif dan mendorong kanker. Selain itu, PDF mengeluarkan ITGB5 dan SPARC dalam jumlah yang lebih tinggi, yang keduanya diketahui memfasilitasi remodeling EMT dan ECM [ [ 24 , 48 ] ], serta Gal-2, yang berkontribusi terhadap imunosupresi tumor [ [ 49 , 50 ] ]. Yang penting, variabilitas dalam profil sekresi sitokin di antara fibroblas dapat dipengaruhi oleh asal mereka. Penelitian sebelumnya telah melaporkan perbedaan antara NF dan PDF pada tingkat transkriptomik [ [ 51 ] ] dan sekresi sitokin [ [ 52 ] ], yang menyoroti dampak asal fibroblas dalam peran mereka dalam TME. Asal fibroblas juga telah dilaporkan memengaruhi respons obat dalam kultur bersama [ [ 53 ] ]. Dalam penelitian ini, kami menyertakan NF dan PDF, yang memungkinkan perbandingan lebih lanjut antara model-model ini. PDF, pada gilirannya, dihasilkan dari pasien dengan diagnosis dan stadium kanker ovarium yang berbeda, yang juga dapat menjelaskan variabilitas dalam ekspresi penanda, karakteristik morfologi, dan profil sekresi sitokin. Khususnya, hanya satu sitokin; CTSV yang disekresikan secara tinggi oleh sel kanker saja. Protein ini telah terbukti berperan dalam degradasi ECM dan invasi sel dengan kadar tinggi yang dikaitkan dengan hasil yang buruk pada berbagai jenis kanker [ [ 54 – 56 ] ]. Kami mengamati sejumlah sitokin yang disekresikan secara berbeda antara monokultur sel kanker dan sel fibroblas; namun, profil sekresi dalam kultur bersama lebih kompleks, mengungkapkan pola unik untuk setiap kombinasi lini sel kanker–CAF. Misalnya, kami menemukan peningkatan kadar HGF yang mendorong tumor dalam kondisi D-CC. Pensinyalan HGF/MET dikaitkan dengan peningkatan proliferasi dan resistensi pengobatan, dan kadar HGF serum berkorelasi dengan kelangsungan hidup keseluruhan pada pasien OC dalam penelitian sebelumnya [ [ 57 ] ]. Menariknya, peningkatan kadar HGF hanya diamati pada kultur bersama sel mirip mesenkim yang lebih agresif (TYKNU dan COV362). Selain itu, kadar RSPO-3 meningkat pada TYKNU dan menurun pada kultur bersama KURAMOCHI mirip epitel. Peningkatan kadar ekspresi protein ini juga dikaitkan dengan perkembangan kanker [ [ 58 ] ]. Terakhir, tiga kultur bersama sel kanker menunjukkan peningkatan kadar WISP-1, protein yang mengaktifkan beberapa jalur seluler yang mengarah pada tumorigenesis dan perkembangan penyakit [ [ 33 , 59 ]]. Sementara keberadaan WISP-1 ekstraseluler dalam media kultur tidak secara langsung memengaruhi proliferasi sel, ia meningkatkan resistensi terhadap inhibitor mTORC1/2 di berbagai lini sel. WISP-1 intraseluler telah dikaitkan dengan perkembangan tumor dan prognosis penyakit yang buruk pada beberapa kanker [ [ 35 , 60 , 61 ] ]; namun, peran WISP-1 ekstraseluler masih kurang dipahami. Temuan kami menunjukkan bahwa WISP-1 sendiri dapat berkontribusi pada peningkatan resistensi terhadap perawatan obat tertentu, meskipun studi mekanistik lebih lanjut diperlukan untuk sepenuhnya menjelaskan dampaknya. Secara keseluruhan, sementara semua sitokin yang diidentifikasi terkait dengan penyakit progresif, profil sitokin unik untuk setiap lini sel kanker menunjukkan interaksi yang kompleks antara sitokin dan menentukan hasil penyakit. Ini menunjukkan bahwa penelitian menggunakan sampel autolog dari masing-masing pasien mungkin diperlukan untuk menjelaskan mekanisme berbeda yang aktif dalam perkembangan penyakit masing-masing pasien.
Kehadiran fibroblas dan faktor-faktor yang disekresikannya berkontribusi pada resistensi obat sel kanker. Untuk mengidentifikasi secara sistematis obat-obatan yang lebih efektif dalam pengaturan ko-kultur, kami melakukan penyaringan obat skala besar terhadap 528 obat pada 5 konsentrasi dosis. Data kami menunjukkan peningkatan resistensi terhadap hampir sepertiga obat dalam kondisi ko-kultur, konsisten dengan pengamatan pada sel kanker kolorektal, pankreas, payudara, dan melanoma [ [ 62 ] ]. Agen alkilasi adalah yang paling terpengaruh oleh lingkungan, menunjukkan peningkatan resistensi dalam ko-kultur, sejalan dengan temuan yang diamati pada glioblastoma [ [ 63 ] ]. Selain itu, inhibitor MEK1/2 menunjukkan resistensi karena sel stroma dalam melanoma [ [ 64 ] ], yang sesuai dengan temuan kami. Yang penting, data kami mengungkapkan bahwa respons terhadap obat-obatan yang relevan secara klinis juga terpengaruh. Menariknya, respons Paclitaxel meningkat setelah ko-kultur, menguatkan penelitian lain menggunakan garis sel OC. Namun, di sini, Pegylated recombinant human hyaluronidase (PEGPH20) digunakan untuk memecah TME untuk pengiriman obat yang lebih baik [ [ 65 ] ]. Selain itu, kami mengamati resistensi terhadap pengobatan lini depan Carboplatin dan Olaparib. Menariknya, studi co-culture lain melaporkan temuan serupa dan menunjukkan bahwa resistensi sel OC terhadap Carboplatin mungkin karena stemness yang diinduksi pada co-culture [ [ 56 ] ]. Resistensi terhadap Olaparib telah dikaitkan dengan peningkatan aktivasi CAF setelah pengobatan [ [ 66 ] ]. Oleh karena itu, resistensi obat dapat diubah oleh berbagai mekanisme: interaksi sel-sel/matriks, sekresi sinyal kelangsungan hidup dari CAF, atau faktor TME lain yang merangsang kelangsungan hidup sel [ [ 67 ] ]. Namun, kami mengidentifikasi obat-obatan, Vorinostat dan Birinapant, dengan peningkatan pembunuhan sel kanker dalam co-culture. Vorinostat, penghambat HDAC, mengganggu siklus sel, proliferasi, dan apoptosis dengan mengubah kondensasi kromatin [ [ 68 ] ]. Disetujui untuk limfoma [ [ 69 ] ], Vorinostat telah menunjukkan hasil yang lebih buruk pada tumor padat sebagai monoterapi. Kami menguji kombinasi Vorinostat dan Carboplatin, mengamati sinergi dalam dua dari delapan sampel pasien ex vivo . Hal ini sejalan dengan studi klinis pada OC sensitif platinum berulang, di mana kombinasi Paclitaxel, Carboplatin, dan Vorinostat menunjukkan tingkat respons objektif 60%, kelangsungan hidup keseluruhan medial yang panjang, dan tolerabilitas yang baik [ [ 70 ]]. Selain itu, meskipun hanya sel OVCAR8 yang menunjukkan peningkatan kematian sel kanker terhadap Birinapant dalam kultur bersama, sinergi Birinapant dan Carboplatin diamati dalam tiga dari delapan sampel pasien ex vivo yang diuji . Hasil kami sesuai dengan penelitian terbaru oleh Singh et al, di mana penulis menggunakan kombinasi obat yang sama pada lini sel OC, sel pasien, dan xenograft [ [ 71 ] ]. Sementara penilaian sinergi obat tetap menjadi parameter penting untuk mengevaluasi efek pengobatan kombinasi, sinergi tidak penting untuk manfaat klinis, karena efek aditif yang diamati dapat meningkatkan respons pengobatan [ [ 72 , 73 ] ]. Semua pasien yang bahannya digunakan dalam penelitian ini memiliki penyakit HGSOC pada stadium III; ada variabilitas yang cukup besar pada kadar CA-125. CA-125 digunakan sebagai biomarker untuk OC [ [ 74 ] ] dengan kadar CA-125 pra-perawatan yang tinggi dikaitkan dengan tingkat kelangsungan hidup yang buruk [ [ 75 ] ]. Temuan kami menunjukkan bahwa kadar CA-125 dapat berfungsi sebagai biomarker untuk mengidentifikasi subkelompok pasien yang lebih mungkin mendapat manfaat dari kombinasi Birinapant/Vorinostat dan Carboplatin. Selain itu, sampel dengan kadar CA-125 yang tinggi menunjukkan proporsi sel mirip EMT yang lebih besar, yang mungkin berkontribusi terhadap pembunuhan sel yang diamati dengan kombinasi obat. Khususnya, penelitian sebelumnya telah menghubungkan inhibitor HDAC dengan penekanan metastasis melalui penghambatan EMT pada kanker kolorektal [ [ 76 ] ], yang menunjukkan kemungkinan mekanisme yang mendasari respons pengobatan yang diamati. Namun, penelitian lebih lanjut diperlukan untuk memahami peran TME dalam respons obat dan untuk memvalidasi CA-125 sebagai biomarker potensial untuk kelompok pasien yang akan mendapat manfaat dari pengobatan kombinasi dengan Birinapant/Vorinostat.
Kesimpulan
Singkatnya, penelitian kami menyoroti peran penting fibroblas dalam TME, yang mengubah proliferasi, morfologi, dan sekresi sitokin sel kanker. Meskipun sekresi sitokin sendiri tidak dapat sepenuhnya menjelaskan perubahan yang diamati dalam kultur bersama, hal itu menambah pemahaman kita tentang jaringan komunikasi sel yang kompleks. Yang terpenting, pemeriksaan obat kami mengungkap beberapa obat dan golongan obat yang khasiatnya dipengaruhi oleh kondisi kultur bersama, yang menunjukkan dampak substansial fibroblas pada resistensi sel kanker terhadap pengobatan. Yang terpenting, kami juga menemukan obat yang menargetkan fenotipe sel kanker baru yang diinduksi oleh fibroblas. Secara khusus, kami telah mengidentifikasi Vorinostat atau Birinapant dalam kombinasi dengan Carboplatin sebagai terapi masa depan yang menjanjikan untuk meningkatkan hasil pasien OC.

