
ABSTRAK
Di Peru, 33.113 orang didiagnosis menderita tuberkulosis (TB) pada tahun 2023. Meskipun pengobatan TB umumnya efektif, 3,4% hingga 13% kasus dikaitkan dengan reaksi obat yang merugikan yang signifikan, dengan cedera hati akibat obat (DILI) menjadi yang paling umum. Data terbatas tersedia tentang faktor risiko genetik untuk DILI di Amerika Latin; bahkan lebih sedikit yang diketahui tentang faktor-faktor ini pada populasi asli Peru. Studi ini bertujuan untuk menentukan prevalensi genotipe metabolisme obat TB pada populasi ini. Analisis cross-sectional dilakukan dengan menggunakan data genetik dari 254 peserta dari Peruvian Genome Project (PGP) yang mewakili tiga subpopulasi: Coast, Andes, dan Amazon. Dua puluh tiga gen yang terkait dengan pengobatan TB, termasuk isoniazid, rifampin, etambutol, dan pirazinamid, seperti yang diidentifikasi dalam basis data PharmGKB, dianalisis. Perbedaan signifikan diamati dalam frekuensi genotipe di antara subpopulasi untuk gen AGBL4, NAT2, GSTP1, SLCO1B1, NOS , dan CYP2B6 . Populasi Amazon menunjukkan risiko DILI yang lebih tinggi karena meningkatnya prevalensi alel hepatotoksik pada AGBL4, GSTP1 , dan SLCO1B1 . Sebaliknya, alel dalam gen NOS menunjukkan risiko hepatotoksisitas yang lebih rendah pada populasi Andes. Namun, genotipe berisiko tinggi yang diidentifikasi dalam populasi asli Peru dalam penelitian ini menunjukkan pola prevalensi yang berbeda dibandingkan dengan yang dilaporkan dalam Proyek 1000 Genom. Temuan ini dapat menginformasikan pengembangan strategi terapi yang dipersonalisasi untuk meningkatkan hasil pengobatan TB di antara subpopulasi Peru yang beragam.
Singkatan
Bahasa Indonesia: AGBL4
Protein pengikat ATP/GTP seperti 4
CYP2B6
sitokrom P450 keluarga 2 subfamili B anggota 6
DILI
cedera hati akibat obat
GSTP1
glutation S-transferase Pi 1
INH
isoniazid
TBC MDR
tuberkulosis yang resistan terhadap banyak obat
Bahasa Indonesia: NAT2
N -asetiltransferase 2
Tidak ada
sintase oksida nitrat
PGP
Proyek Genom Peru
SLCO1B1
pengangkut anion organik pembawa zat terlarut anggota keluarga 1B1
TBC
tuberkulosis
SIAPA
Organisasi Kesehatan Dunia
1 Latar Belakang
Tuberkulosis (TB) adalah penyakit menular yang disebabkan oleh Mycobacterium tuberculosis dan termasuk dalam 10 penyebab kematian teratas di seluruh dunia [ 1 ]. TB menyerang siapa saja di segala usia, tetapi dampaknya lebih besar pada populasi usia kerja [ 2 ]. Pada tahun 2022, TB menyebabkan sekitar 1,3 juta kematian di seluruh dunia. Penyakit ini terutama menyerang populasi berpenghasilan rendah, meskipun dapat menyerang individu di semua tingkat sosial ekonomi. Di Peru, 33.113 orang didiagnosis menderita TB pada tahun 2023 [ 1 ].
Di Peru, pengobatan lini pertama memiliki tingkat keberhasilan 87,2%, menurut Organisasi Kesehatan Dunia (WHO) pada tahun 2016 [ 1 ]. Meskipun pengobatan TB efektif, 3,4%–13% dikaitkan dengan reaksi obat yang merugikan yang signifikan, dengan cedera hati akibat obat (DILI) dianggap yang paling dominan [ 1 ]. DILI adalah reaksi merugikan yang signifikan yang terkait dengan pengobatan anti-tuberkulosis, yang menyebabkan penundaan dalam terapi dan meningkatkan kemungkinan resistensi obat. Di hati manusia, isoniazid (INH) pertama-tama diasetilasi oleh N -asetiltransferase 2 (NAT2) menjadi asetilhidrazina, kemudian dioksidasi menjadi zat antara yang beracun oleh sitokrom P450 famili 2 subfamili E anggota 1 (CYP2E1) [ 3 ]. Senyawa beracun yang dihasilkan didetoksifikasi melalui asetilasi oleh NAT2 dan reaksi konjugasi yang dikatalisis oleh enzim Glutathione S-Transferase Pi 1 (GST). Beberapa faktor risiko DILI telah diidentifikasi, termasuk koinfeksi dengan HIV, hepatitis B atau C, usia lanjut, dan jenis kelamin perempuan [ 4 , 5 ].
Selain itu, variasi genetik dapat memengaruhi metabolisme obat, yang menyebabkan perbedaan dalam konsentrasi antibiotik dalam darah. Misalnya, individu dengan sifat genetik yang terkait dengan peningkatan metabolisme dapat memproses antibiotik terlalu cepat, mengurangi efektivitasnya, sementara pemetabolisme lambat mungkin memiliki paparan obat yang berkepanjangan, meningkatkan risiko toksisitas [ 6 , 7 ]. Gen seperti NAT2, CYP2E1 telah dievaluasi dalam populasi yang berbeda di seluruh dunia, termasuk orang Amerika, Afrika, Eropa, dan Asia [ 8 – 10 ]. Sebuah studi multinasional yang mencakup individu dari Peru melaporkan bahwa genotipe NAT2*4 , * 1 , * 12 , * 13 , * 18 dikaitkan dengan pemetabolisme menengah dan cepat. Namun, studi ini tidak memberikan bukti yang cukup untuk mengoptimalkan konsentrasi obat dan mengurangi efek samping isoniazid pada populasi Peru yang didiagnosis dengan tuberkulosis [ 11 ].
Studi tentang keragaman genetik dalam populasi penting karena mereka mengidentifikasi frekuensi polimorfisme untuk setiap populasi. Dasar farmakogenomik adalah bahwa sementara pemilihan obat standar dan pedoman dosis berlaku di seluruh populasi, distribusi fenotipe metabolisme (misalnya, metabolisme menengah [IM], metabolisme buruk [PM]) bervariasi. Misalnya, variasi genetik dalam NAT 2 memengaruhi metabolisme isoniazid, obat lini pertama untuk tuberkulosis. Populasi dengan prevalensi asetilator lambat yang lebih tinggi (metabolisator lambat NAT2) dapat mengalami peningkatan toksisitas obat, sedangkan asetilator cepat mungkin memiliki kemanjuran terapi yang berkurang. Analisis keturunan genetik populasi mestizo Peru, yang berasal dari beberapa komunitas penduduk asli Amerika, telah mengungkapkan profil genetik yang berbeda [ 12 ]. Perbedaan-perbedaan ini menyoroti keterbatasan ekstrapolasi data farmakogenomik dari populasi lain. Misalnya, variasi pada alel NAT2 , yang mempengaruhi metabolisme isoniazid dalam pengobatan tuberkulosis, menunjukkan frekuensi yang berbeda pada populasi Peru dibandingkan dengan populasi lain, yang mempengaruhi respons obat dan risiko efek samping [ 11 ].
Dengan demikian, pada tahun 2018, laporan teknis oleh para ahli WHO menggarisbawahi peran penting dalam menentukan fenotipe metabolisme selama pemberian obat. Misalnya, untuk pemberian isoniazid, pada anak-anak dan orang dewasa, dosisnya ditetapkan sebagai 10–15 mg/kg/hari dalam rejimen tuberkulosis resistan multiobat (MDR-TB) (dosis yang biasa adalah 4–6 mg/kg/hari). Namun, laporan tersebut mencatat bahwa di Asia Utara, di mana sebagian besar penduduk memiliki fenotipe metabolisme cepat, dosis 15 mg/kg mungkin lebih efektif [ 13 ].
Beberapa penelitian telah melaporkan bahwa variasi farmakogenetik pada NAT2 mempengaruhi farmakokinetik dan berkontribusi terhadap perbedaan toksisitas setelah pengobatan isoniazid [ 14 – 16 ]. Sebuah penelitian sebelumnya menyimpulkan bahwa pasien dengan metabolisme cepat harus menerima 50% lebih banyak dari dosis standar, sementara pasien dengan genotipe lambat harus menerima setengah dari dosis standar [ 17 ]. Azuma et al. melaporkan bahwa 78% dari metabolisme lambat mengalami hepatotoksisitas karena diobati dengan dosis standar INH, sementara tidak ada dari mereka yang menerima dosis yang dimodifikasi melaporkan kerusakan hati [ 6 ]. Menurut hal di atas, manfaat dari pengobatan yang dimodifikasi dalam mengurangi DILI menurut metabolisme INH telah ditunjukkan [ 18 ].
Studi ini menyoroti kebutuhan yang belum terpenuhi untuk mengidentifikasi individu yang berisiko genetik untuk DILI, yang memungkinkan pengembangan rejimen terapi yang dipersonalisasi yang mengurangi risiko ini. Dengan menargetkan genotipe berisiko tinggi, pengobatan alternatif dapat ditawarkan, mengurangi beban DILI dan meningkatkan kepatuhan dan hasil pengobatan pada populasi yang terkena dampak. Meskipun mekanisme utama yang terlibat dalam pengembangan hepatotoksisitas diketahui, bidang ini belum dieksplorasi secara signifikan di Peru, khususnya pada populasi keturunan asli. Studi ini bertujuan untuk memperkirakan prevalensi genotipe yang melakukan metabolisme pada pasien selama pengobatan tuberkulosis pada populasi asli Peru.
2 Pasien dan Metode
2.1 Populasi dan Partisipan yang Diteliti
Penelitian ini adalah analisis sekunder dari data dari studi cross-sectional yang lebih luas yang dilakukan oleh NIH Peru. Studi primer bertujuan untuk menyelidiki keragaman genetik pada populasi dari Peru, melaporkan polimorfisme nukleotida tunggal (SNP) yang relevan secara klinis di antara kelompok Amerika Latin [ 12 ]. Studi sekunder ini menyelidiki keragaman genetik dan variasi farmakogenetik pada populasi asli Peru. Dengan memanfaatkan kumpulan data genetik yang ada, studi ini bertujuan untuk mengidentifikasi profil metabolik spesifik populasi yang memengaruhi respons obat TB, sehingga menginformasikan strategi pengobatan yang lebih efektif dan personal. Sebanyak 254 sampel dianalisis. Kriteria inklusi terdiri dari individu dari PGP dengan lebih dari 95% keturunan asli berdasarkan hasil analisis bioinformatika (Pantai, Andes, Amazon), dan persetujuan untuk pengujian genetik. Kriteria eksklusi mencakup individu dengan data genetik yang tidak lengkap.
2.2 Persetujuan
Penelitian ini disetujui oleh Komite Etika dalam Penelitian di Institut Kesehatan Nasional Peru (otorisasi OI-003-11 dan OI-087-13) dan dilakukan sesuai dengan prinsip-prinsip Deklarasi Helsinki. Persetujuan tertulis yang diberikan telah diperoleh dari semua partisipan.
2.3 Data Genetik dan Kontrol Kualitas
Sampel darah tepi (4 mL) dikumpulkan dari peserta, dan DNA diekstraksi menggunakan QIAamp DNA Blood Mini Kit (Qiagen, CA, AS). Sampel DNA digenotipe menggunakan array Illumina Omni 2,5 M dalam tiga kelompok di fasilitas NIH Peru.
Satu kelompok, yang terdiri dari 50 individu, digenotipe menggunakan GRch38. Kelompok ini diangkat ke GRch37 menggunakan alat lift-over UCSC ( https://genome.ucsc.edu/cgi-bin/hgLiftOver ) sebelum digabungkan dengan kelompok GRch37 lainnya. Setelah penggabungan, kami menghilangkan SNP dan individu dengan lebih dari 5% genotipe yang hilang menggunakan PLINK [ 19 ]. Varian dengan genotipe AT/CG atau yang berada di luar keseimbangan Hardy–Weinberg (HWE) ( p < 10e −5 ) dikecualikan. Individu terkait (kerabat tingkat pertama) dihilangkan (king-cutoff 0,177) menggunakan PLINK. Data array diimputasikan terhadap panel imputasi TOPMed ( https://imputation.biodatacatalyst.nhlbi.nih.gov/#! ). Singkatnya, server imputasi TOPMed melakukan pentahapan data kueri menggunakan Eagle2 dan imputasi menggunakan minimac4. 2.4 Analisis Campuran Kami menggunakan ADMIXTURE [ 20 ] untuk mengeksplorasi proporsi leluhur di seluruh genom. Dalam analisis ini, K menunjukkan jumlah populasi leluhur yang diasumsikan dalam model. Kami menguji nilai K yang berkisar dari 4 hingga 8 dalam subset individu yang mencakup semua sampel (campuran dan penduduk asli Amerika), subkelompok populasi cakupan tinggi 1000 Genomes Project (1KGP) dengan individu yang tidak terkait (TSI, IBS, CEU, PEL, CLM, MXL, PUR, LWK, MSL, YRI, GWD, JPT, CHB, dan CHS), dan penduduk asli Amerika dari Human Genome Diversity Project (HGDP) (populasi Kolombia, Pima, dan Maya). Subset ini mencakup varian nukleotida tunggal yang tidak terkait dan frekuensi alel minor (MAF) > 5%. Kami melakukan sepuluh kali pengujian per nilai K dan memetakan pengujian dengan log-likelihood tertinggi.
Kami melakukan silsilah lokal dengan menjalankan RFMIXver2 [ 21 – 23 ] dengan panel referensi dari populasi Eropa, Afrika, Asia Timur, dan penduduk asli Amerika. Individu dengan > 95% silsilah penduduk asli Amerika diklasifikasikan ke dalam kelompok Andes, Pesisir, atau Amazon berdasarkan lokasi rekrutmen. Kami memilih orang Eropa ( n = 404 individu; populasi meliputi CEU, GBR, IBS, dan TSI), Afrika ( n = 405 individu; populasi meliputi YRI, ESN, GWD, dan LWK), dan Asia Timur ( n = 411 individu; populasi meliputi CHB, CHS, JPT, dan KHV) dari populasi 1KGP. Referensi penduduk asli Amerika meliputi 187 individu dari PGP dengan lebih dari 99% NAT (silsilah penduduk asli Amerika) berdasarkan hasil ADMIXTURE K4. Kami menjalankan RFMIX menggunakan dua langkah maksimisasi ekspektasi.
2.5 Pengukuran dan Analisis
Bahasa Indonesia: Untuk analisis ini, kami hanya menyertakan individu dengan > 95% keturunan NAT, menghasilkan 254 partisipan non-campuran. Individu diklasifikasikan ke dalam subpopulasi asli Pantai, Andes, atau Amazon tergantung pada lokasi situs rekrutmen mereka. Kami mengeksplorasi hubungan antara subpopulasi asli dan 23 penanda genetik yang terkait dengan pengobatan TB yang diidentifikasi dalam basis data PharmGKB ( https://www.pharmgkb.org/ ) (Tabel S1 ). Genotipe risiko tinggi didefinisikan sebagai varian genetik atau kombinasi varian yang terkait dengan peningkatan kemungkinan reaksi obat yang merugikan, khususnya DILI, dalam konteks pengobatan TB. Genotipe ini diidentifikasi berdasarkan penelitian farmakogenetik sebelumnya dan basis data, seperti PharmGKB, dan dievaluasi untuk prevalensi dan hubungannya dengan hepatotoksisitas. Genotipe yang tidak terkait dengan peningkatan risiko DILI atau terkait dengan profil metabolik protektif dikategorikan sebagai risiko rendah. Analisis statistik, termasuk uji chi-square dan model regresi, menentukan perbedaan signifikan dalam frekuensi genotipe berisiko tinggi ini di seluruh subpopulasi yang diteliti. Untuk memperhitungkan beberapa pengujian, koreksi Bonferroni diterapkan, dengan menyesuaikan ambang signifikansi dengan jumlah pengujian independen yang dilakukan. Signifikansi statistik ditetapkan pada p < 0,05 menggunakan Stata 15 (StataCorp, College Station, TX, AS).
3 Hasil
Sebanyak 27 SNP yang terkait dengan metabolisme obat TB dianalisis, seperti yang dilaporkan dalam basis data PharmGKB (Tabel S1 ). SNP ini mencakup gen-gen farmakogenetik utama seperti NAT2, CYP2E1, GSTP1 , dan Solute carrier organic anion transporter family member 1B1 ( SLCO1B1 ), yang memainkan peran penting dalam metabolisme obat dan risiko hepatotoksisitas selama pengobatan TB ( https://www.pharmgkb.org/ ). Di antara ini, enam gen (ATP/GTP binding protein-like 4 [ AGBL4 ], NAT2, GSTP1, SLCO1B1, Nitric oxide synthase [ NOS ], dan Cytochrome P450 family 2 subfamily B member 6 [ CYP2B6 ]) menunjukkan perbedaan frekuensi yang signifikan di seluruh populasi yang diteliti, sehingga memerlukan investigasi lebih lanjut (Tabel 1 dan 2 ), SNP tambahan tanpa perbedaan signifikan dilaporkan dalam Tabel S2 dan S3 , yang memberikan gambaran yang lebih luas mengenai variabilitas genetik yang terkait dengan metabolisme obat TB pada populasi asli Peru.
TABEL 1. Frekuensi genotipe gen metabolisme obat anti-TB dengan perbedaan signifikan secara statistik di antara populasi asli Peru.
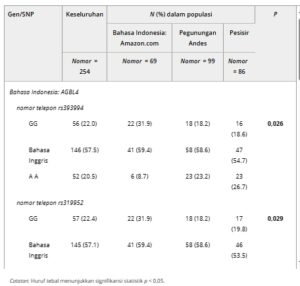
TABEL 2. Hubungan antara subpopulasi asli dan genotipe berisiko tinggi dengan perbedaan yang signifikan secara statistik.
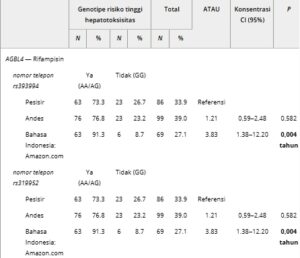
Untuk AGBL4 , SNP rs393994, rs319952 , dan rs320003 menunjukkan variasi yang signifikan. Genotipe heterozigot (AG) adalah yang paling sering ditemukan di semua subpopulasi. Namun, genotipe AA, yang terkait dengan risiko hepatotoksisitas, secara signifikan lebih sering ditemukan pada populasi Andes dan Pesisir dibandingkan dengan populasi Amazon. Meskipun demikian, populasi Amazon menunjukkan prevalensi risiko hepatotoksisitas yang lebih tinggi secara keseluruhan (OR = 3,83, p = 0,004).
Genotipe NAT2 mengidentifikasi keberadaan SNP rs4646244, rs1799929, rs1799930, rs1799931 , dan rs1495741 . Perbedaan yang signifikan secara statistik diamati untuk rs1799929 dan rs1799931 . Genotipe homozigot (AA) untuk rs1799931 lebih sering terjadi pada populasi Andes (50,5%) dan Pesisir (51,2%) dibandingkan dengan populasi Amazon (40,6%). Sementara itu, genotipe TT untuk rs1799929 paling banyak terjadi pada populasi Amazon (78,3%), diikuti oleh populasi Andes (67,7%) dan Pesisir (55,8%).
Untuk GSTP1 , SNP rs1695 menunjukkan variasi yang signifikan. Genotipe AA homozigot secara signifikan lebih jarang ditemukan pada populasi Amazon (36,2%) dibandingkan dengan populasi Andes (57,6%) dan Pesisir (59,3%). Genotipe AG heterozigot lebih umum ditemukan pada kelompok Amazon (44,9%). Genotipe hepatotoksik secara signifikan lebih sering ditemukan pada populasi Amazon dibandingkan dengan Pesisir (OR = 3,76, p = 0,012).
Analisis SLCO1B1 mengungkapkan perbedaan signifikan untuk rs4149032 . Genotipe TT homozigot paling sering ditemukan pada populasi Amazon (76,8%), diikuti oleh populasi Pesisir (46,5%) dan Andes (28,3%). Prevalensi genotipe CC hepatotoksik secara signifikan lebih tinggi pada kelompok Amazon (OR = 3,81, p = 0,012) dan lebih rendah pada kelompok Andes (OR = 0,45, p = 0,010).
Untuk NOS , rs11080344 merupakan SNP utama, yang menunjukkan perbedaan yang signifikan. Genotipe TT homozigot paling sering ditemukan pada populasi Pesisir (59,3%), diikuti oleh populasi Amazon (56,5%) dan Andes (42,4%). Genotipe TC heterozigot, yang dikaitkan dengan risiko hepatotoksisitas yang lebih rendah, lebih sering ditemukan pada populasi Andes (44,4%), yang memiliki risiko hepatotoksisitas yang jauh lebih rendah dibandingkan dengan Pesisir (OR = 0,51, p = 0,022).
Terakhir, genotipe CYP2B6 mengidentifikasi rs3745274 sebagai SNP utama yang diinginkan. Genotipe TG heterozigot adalah yang paling sering ditemukan di semua populasi. Namun, genotipe TT, yang telah dikaitkan dengan peningkatan risiko hepatotoksisitas, secara signifikan lebih tinggi pada populasi Amazon (42,0%) dibandingkan dengan populasi Andes (19,2%) dan Pesisir (22,1%) ( p = 0,012).
Populasi Amazon menunjukkan risiko lebih tinggi untuk mengembangkan DILI karena alel hepatotoksik pada gen AGBL4, GSTP1, SLCO1B1 , dan NOS . Sebaliknya, populasi Andes menunjukkan profil genetik yang terkait dengan risiko hepatotoksisitas yang lebih rendah. Analisis RFMIX v2 mengidentifikasi proporsi leluhur yang berbeda di antara kelompok yang dipelajari. Populasi Andes menunjukkan leluhur Penduduk Asli Amerika yang lebih tinggi, sementara kelompok Pesisir memiliki campuran Eropa yang lebih besar. Perbedaan leluhur ini tercermin dalam variasi farmakogenetik, khususnya pada NAT2 dan GSTP1 . Temuan ini menyoroti variabilitas genetik yang mendasari metabolisme obat TB dan pentingnya menyesuaikan perawatan dengan subpopulasi tertentu.
4 Diskusi
Dalam studi ini, kami mengidentifikasi perbedaan dalam prevalensi beberapa varian genetik yang memengaruhi metabolisme obat TB di seluruh populasi asli Peru non-campuran yang berbeda secara geografis. Populasi Amazon menunjukkan prevalensi alel hepatotoksik yang lebih tinggi pada gen AGBL4, GSTP1 , dan SLCO1B1 . Varian seperti rs393994 di AGBL4 dikaitkan dengan peningkatan frekuensi genotipe berisiko tinggi (OR = 3,83, p = 0,004). Temuan serupa telah dilaporkan dalam studi lain, yang menghubungkan varian ini dengan proses deglutamylasi seluler yang terganggu, yang dapat memperburuk toksisitas hati saat terpapar obat seperti rifampin [ 24 ]. Sebaliknya, populasi Andes menunjukkan prevalensi alel terkait DILI yang lebih rendah pada gen NOS , khususnya rs11080344. Varian ini telah dikaitkan dengan penurunan produksi oksida nitrat, yang dapat mengurangi stres oksidatif dan hepatotoksisitas [ 25 ].
Beberapa penelitian sebelumnya telah mengeksplorasi peran polimorfisme genetik dalam metabolisme obat, khususnya yang berhubungan dengan NAT2 dan dampaknya pada metabolisme isoniazid. Gen NAT2 telah dipelajari secara luas pada populasi yang berbeda, dengan variabilitas yang signifikan diamati di antara kelompok etnis. Penelitian pada populasi Asia Timur, misalnya, telah menunjukkan prevalensi alel asetilator cepat yang lebih tinggi, sedangkan populasi Pribumi Amerika Selatan cenderung menunjukkan frekuensi asetilator lambat yang lebih tinggi, meningkatkan risiko DILI [ 8 , 11 ]. Demikian pula, penelitian genetik pada populasi Afrika dan Eropa telah melaporkan pola asetilasi yang beragam yang memengaruhi hasil pengobatan TB [ 15 , 16 ].
Sementara penelitian sebelumnya telah mengidentifikasi hubungan antara varian farmakogenetik dan respons obat anti-TB pada populasi global dan mestizo, penelitian kami memberikan wawasan baru yang khusus untuk subpopulasi asli Peru yang tidak bercampur. Ini adalah penelitian pertama yang meneliti dan membandingkan distribusi genotipe berisiko tinggi di seluruh kelompok asli Amazon, Andes, dan Pesisir menggunakan data genomik dari individu dengan > 95% keturunan asli Amerika. Kami melaporkan perbedaan spesifik populasi yang sebelumnya tidak terdokumentasi dalam farmakogen utama seperti NAT2, GSTP1, SLCO1B1, NOS, AGBL4 , dan CYP2B6 .
Gen NAT2 memainkan peran penting dalam metabolisme isoniazid. Varian seperti rs1799931 yang terkait dengan fenotipe asetilasi lambat lebih umum terjadi pada populasi Amazon. Asetilator lambat memiliki risiko DILI yang lebih tinggi karena akumulasi metabolit toksik [ 26 ]. Temuan dari penelitian kami sejalan dengan penelitian sebelumnya yang menunjukkan frekuensi alel asetilator lambat yang lebih tinggi, seperti rs1799931-AA, di antara populasi Pribumi Amerika Selatan [ 27 , 28 ]. Kehadiran alel NAT25, NAT26 , dan NAT27 secara konsisten telah dikaitkan dengan metabolisme lambat di banyak populasi, termasuk orang Peru [ 29 ]. Penelitian pada populasi mestizo Amerika Latin telah menunjukkan profil metabolik yang berbeda dibandingkan dengan kelompok Pribumi, yang memperkuat pentingnya penelitian farmakogenomik spesifik populasi [ 30 ]. Selain itu, pada pasien TB di Peru, NAT25B dan NAT27B dikaitkan dengan risiko DILI yang lebih tinggi pada ras mestizo, sedangkan NAT25G dan NAT213A bersifat protektif pada populasi asli, menunjukkan peran evolusi dalam adaptasi metabolisme obat [ 31 ].
Gen GSTP1 , yang bertanggung jawab untuk detoksifikasi dan regulasi stres oksidatif, juga menunjukkan perbedaan spesifik populasi. Genotipe rs1695 AA, yang lebih umum pada populasi Amazon, telah dikaitkan dengan aktivitas glutathione S-transferase yang berkurang dan peningkatan risiko kerusakan oksidatif, yang menguatkan temuan dari penelitian sebelumnya [ 32 – 35 ]. Demikian pula, polimorfisme pada gen SLCO1B1 , khususnya rs4149032 , secara signifikan dikaitkan dengan DILI pada populasi Amazon (OR = 3,81, p = 0,012). Gen ini memainkan peran penting dalam transportasi rifampisin di hati, dan variannya, seperti rs4149032, telah dikaitkan dengan konsentrasi plasma rifampisin yang berubah dan peningkatan risiko hepatotoksisitas [ 36 – 38 ].
Menariknya, tidak ada perbedaan signifikan yang diamati pada gen CYP2B6 di ketiga subpopulasi. Sementara CYP2B6 telah terlibat dalam metabolisme obat-obatan seperti efavirenz, variabilitasnya yang terbatas dalam penelitian ini menunjukkan bahwa faktor genetik lain mungkin memainkan peran yang lebih penting dalam memengaruhi risiko DILI di antara populasi ini [ 39 – 41 ]. Penelitian sebelumnya telah menyoroti dampak polimorfisme CYP2E1 pada metabolisme obat, terutama pada populasi dengan beban TB yang tinggi. Tang et al. [ 10 ] menemukan bahwa individu yang membawa alel CYP2E11D memiliki aktivitas enzim yang berubah secara signifikan, yang memengaruhi metabolisme isoniazid dan risiko hepatotoksisitas. Temuan serupa telah dilaporkan pada populasi Amerika Selatan dan Asia, yang menunjukkan potensi dasar genetik untuk variabilitas antar individu dalam respons obat.
Temuan- temuan ini memperkuat peran penting keragaman genetik dalam memengaruhi hasil pengobatan. Diferensiasi genetik yang diamati antara populasi Andes dan Amazon konsisten dengan penelitian sebelumnya yang menunjukkan bahwa isolasi geografis dan budaya telah membentuk profil genetik yang berbeda di Amerika Selatan [ 42-45 ] . Keturunan genetik memainkan peran utama dalam farmakogenomik populasi [ 46 ]. Dalam penelitian sebelumnya, kami mengidentifikasi adanya reaksi yang merugikan selama pengobatan anti-tuberkulosis pada populasi Peru. Kami melaporkan bahwa 30% dari populasi Peru dikaitkan dengan metabolisme isoniazid yang lambat [ 29 ]. Kami juga mengidentifikasi haplotipe dengan asosiasi yang berbeda dengan DILI, berdasarkan populasi mestizo atau penduduk asli Peru. Misalnya, kami menemukan bukti NAT2*5B dan NAT2*7B dikaitkan dengan risiko DILI pada mestizo, sementara tidak ada asosiasi seperti itu yang diamati pada penduduk asli. Selain itu, haplotipe NAT2*5G dan NAT2*13A hanya berasosiasi negatif dengan DILI pada penduduk asli Peru yang diteliti [ 30 ]. Studi lain mengungkapkan bahwa diferensiasi lingkungan dan genetik antara populasi Andes dan Amazon telah memungkinkan seleksi alam dan kekuatan evolusi lainnya untuk bertindak selama ribuan tahun, membentuk perbedaan dalam frekuensi varian genetik, termasuk gen yang terkait dengan respons imun ( CD45 dan DUOX2 ), dengan fungsi tiroid ( DUOX2 ), kardiovaskular ( HAND2-AS1 ) dan hematologi ( TMPRSS6 ) 4, serta gen yang terkait dengan respons obat [ 31 ].
Temuan kami menunjukkan bahwa ada perbedaan dalam gen AGBL4, NAT2, GSTP1, SLCO1B1, NOS , dan CYP2B6 antara populasi asli di Peru yang berkorelasi dengan laporan klinis tentang toksisitas dan kegagalan pengobatan pada populasi Peru [ 47-49 ] . Perbedaan ini dapat memiliki implikasi untuk risiko hepatotoksisitas yang terkait dengan penggunaan obat antituberkulosis [ 50 , 51 ]. Studi ini memiliki beberapa kekuatan, termasuk fokusnya pada populasi asli Peru yang kurang terwakili, memberikan wawasan penting tentang variabilitas genetik yang memengaruhi metabolisme obat TB. Analisis komprehensif dari 23 gen menggunakan teknik genotipe tingkat lanjut memastikan kualitas data yang tinggi sambil menyertakan subpopulasi yang beragam (Pantai, Andes, Amazon) dan menawarkan perspektif komparatif yang berharga. Temuan yang relevan secara klinis, seperti prevalensi alel hepatotoksik, memiliki implikasi praktis untuk strategi pengobatan TB yang dipersonalisasi.
Namun, penelitian ini juga memiliki keterbatasan, seperti ukuran sampel yang relatif kecil yang dapat membatasi generalisasi, pengecualian populasi campuran, dan ketergantungan pada desain cross-sectional, yang membatasi kemampuan untuk menilai dampak jangka panjang. Memahami variasi genetik ini sangat penting untuk merancang rejimen pengobatan TB yang efektif. Perbedaan yang diamati dalam penelitian ini sejalan dengan temuan sebelumnya bahwa populasi Pribumi Amerika Selatan menunjukkan profil farmakogenetik yang berbeda dibandingkan dengan populasi mestizo, Eropa, Afrika, dan Asia. Temuan ini selanjutnya mendukung perlunya menggabungkan farmakogenomik ke dalam pedoman pengobatan TB untuk mengurangi efek samping dan meningkatkan hasil terapi [ 18 , 34 ].
Meskipun penelitian kami mengidentifikasi perbedaan signifikan dalam frekuensi alel di antara subpopulasi asli Peru, penelitian klinis diperlukan untuk memvalidasi dampaknya terhadap metabolisme obat dan hasil pengobatan. Validasi fungsional melalui analisis farmakokinetik akan menentukan apakah variasi ini memengaruhi kemanjuran pengobatan tuberkulosis dan reaksi obat yang merugikan. Hanya melalui konfirmasi klinis, temuan ini dapat berkontribusi pada pengembangan pedoman farmakogenetik. Hasil kami memberikan dasar untuk penelitian di masa mendatang tetapi memerlukan penyelidikan lebih lanjut dalam pengaturan klinis.
5 Kesimpulan
Meskipun hasil studi kami memberikan wawasan berharga mengenai frekuensi genotipe metabolisme untuk obat anti-TB di Peru, khususnya di antara penduduk asli, pemahaman yang lebih mendalam mengenai faktor-faktor yang terkait dengan genotipe ini diperlukan. Studi longitudinal yang mencakup sampel besar telah mengungkapkan bahwa polimorfisme genetik memainkan peran penting dalam metabolisme obat. Meskipun memiliki keterbatasan sebagai studi sekunder, temuan kami menunjukkan bahwa subpopulasi asli Peru menunjukkan profil metabolisme yang berbeda yang terkait dengan varian pada gen AGBL4, NAT2, GSTP1, SLCO1B1, NOS , dan CYP2B6 .

