
ABSTRAK
Tujuan
Studi longitudinal yang membahas nilai prediktif konektivitas jaringan otak dalam halusinasi PD masih kurang. Studi ini menyelidiki apakah penanda konektivitas fungsional dapat memprediksi halusinasi PD secara independen dari penanda klinis.
Metode
Studi ini menggunakan data dari Parkinson’s Progression Marker Initiative, sebuah studi multisenter longitudinal yang bertujuan untuk mengidentifikasi biomarker perkembangan PD. Seratus tiga pasien PD yang baru didiagnosis (usia rata-rata 63,10 ± 9,70 tahun, 65 laki-laki) menjalani penilaian klinis dan pemindaian MRI fungsional pada awal. Analisis komponen independen digunakan untuk mengeksplorasi perbedaan konektivitas fungsional intra-jaringan dan antar-jaringan antara pasien PD yang mengalami halusinasi dan mereka yang tidak mengalaminya selama tindak lanjut 2 tahun.
Hasil
Dua puluh pasien mengalami halusinasi selama tindak lanjut. Pada awal, konektivitas yang menurun secara signifikan dalam jaringan perhatian dorsal ( t = -6,65 ~ -4,90, p < 0,05, FWE terkoreksi) dan peningkatan konektivitas dalam jaringan mode default ( t = 6,16 ~ 7,78, p < 0,05, FWE terkoreksi) terdeteksi pada pasien PD yang mengalami halusinasi dibandingkan dengan mereka yang tidak mengalaminya. Selain itu, pasien PD dengan halusinasi menunjukkan konektivitas fungsional yang menurun secara signifikan antara jaringan perhatian dorsal dan jaringan visual pada awal ( t = -3,31, p = 0,02, FWE terkoreksi). Analisis regresi biner mengungkapkan bahwa prediktor signifikan halusinasi PD meliputi keberadaan EDS (OR = 6,928, p = 0,022), keberadaan disfungsi otonom (OR = 6,531, p = 0,012), FC dalam DMN (OR = 5,587, p = 0,006), FC dalam DAN (OR = 0,217, p = 0,041), dan FC antara DAN dan VIS (OR = 0,004, p = 0,019) pada awal. Kesimpulan Temuan ini memberikan bukti bahwa konektivitas jaringan otak yang terganggu dikaitkan dengan risiko halusinasi yang lebih besar di masa mendatang pada PD. Hal ini dapat membantu dalam identifikasi dini pasien PD yang berisiko mengalami halusinasi dan memberikan dasar bagi pengembangan terapi baru. 1 Pendahuluan Halusinasi, termasuk halusinasi ringan, halusinasi visual yang terbentuk, dan delusi, merupakan gejala nonmotorik yang sering terjadi pada penyakit Parkinson (PD) [ 1 ]. Halusinasi dan peningkatan keparahan gangguan kognitif yang terkait dengannya dikaitkan dengan kecacatan yang lebih besar, penurunan kualitas hidup, dan peningkatan mortalitas pada PD [ 2 – 4 ]. Untuk memfasilitasi identifikasi dini dan memandu intervensi halusinasi PD di masa mendatang, ada kebutuhan mendesak untuk memahami korelasi saraf yang mendasari gejala-gejala ini dan untuk mengembangkan biomarker untuk mengidentifikasi pasien yang berisiko lebih besar [ 5 , 6 ]. Beberapa studi pencitraan fungsional telah mengimplikasikan abnormalitas di dalam dan antara jaringan otak dalam patogenesis halusinasi PD. Studi pencitraan resonansi magnetik fungsional (fMRI) awal menunjukkan penurunan aktivasi dalam jaringan visual (VIS) pada PD dengan halusinasi [ 7 , 8 ]. Selanjutnya, hipotesis disfungsi jaringan perhatian diajukan dan divalidasi oleh Shine et al. yang menyatakan pasien dengan halusinasi PD mengalami inaktivasi jaringan perhatian dorsal (DAN) dan peningkatan aktivitas bersamaan dalam jaringan mode default (DMN) [ 9 – 12 ]. Lebih jauh, halusinasi PD juga telah dikaitkan dengan penurunan konektivitas antara DAN dan jaringan perhatian ventral (VAN) serta peningkatan konektivitas antara DMN dan VIS [ 11 , 13 – 15 ]. Meskipun studi-studi ini memperdalam pengetahuan kita tentang dasar neurobiologis halusinasi PD, sifat cross-sectional mereka menghalangi kita untuk menyelidiki nilai prediktif penanda konektivitas fungsional (FC) dalam konversi halusinasi PD. Dalam studi longitudinal ini, pertama-tama kami menyelidiki apakah perubahan FC mendahului timbulnya halusinasi pada PD; kemudian kami menilai apakah penanda FC dapat dikombinasikan dengan penanda klinis untuk meningkatkan prognosis halusinasi pada PD. 2 Metode 2.1 Peserta Bahasa Indonesia: Dalam studi longitudinal ini, kami menyelidiki prediktor klinis dan neuroimaging dari halusinasi pada tahap awal PD menggunakan data dari Parkinson’s Progression Markers Initiative (PPMI), yang memulai rekrutmen awal pada tahun 2010 dan memperluas rekrutmen pada tahun 2020. Rincian tentang desain dan protokol studi tersedia di situs web PPMI ( http://www.ppmi-info.org ). Studi ini disetujui oleh dewan peninjau kelembagaan di setiap lokasi yang berpartisipasi, dan semua peserta memberikan persetujuan tertulis sebelum dimasukkan. Data yang digunakan dalam studi ini diperoleh dari situs web PPMI pada tanggal 27 April 2024. Dalam studi ini, kami awalnya menyertakan 108 pasien PD yang bebas dari halusinasi, memiliki data fMRI di awal, dan menyelesaikan tindak lanjut selama 2 tahun. Namun, lima pasien dikeluarkan karena gerakan kepala yang berlebihan selama akuisisi fMRI (untuk detailnya, lihat prapemrosesan data fMRI), sehingga menghasilkan 103 peserta dalam analisis akhir. 2.2 Penilaian Klinis Kehadiran halusinasi PD dinilai menggunakan item Halusinasi dan Psikosis dari Movement Disorders Society–Unified Parkinson’s Disease Rating Scale (MDS-UPDRS) Bagian I. Pasien diklasifikasikan sebagai PD dengan halusinasi (P-H+) jika mereka mendapat skor satu atau lebih pada satu atau lebih penilaian selama tindak lanjut 2 tahun, yang lain dianggap sebagai PD tanpa halusinasi (PD-H−). Gejala motorik dan stadium penyakit PD dievaluasi menggunakan MDS-UPDRS Bagian III dan sistem stadium Hoehn dan Yahr (H&Y), masing-masing. Skala Kantuk Epworth (ESS) digunakan untuk menyelidiki keberadaan kantuk di siang hari yang berlebihan (EDS), dengan nilai batas 10 atau lebih yang menunjukkan EDS. Peserta menyelesaikan Skala Depresi Geriatri (GDS) yang terdiri dari 15 item untuk mengevaluasi gejala depresi, pasien PD dengan skor 5 atau lebih dianggap mengalami depresi. Kuesioner untuk Gangguan Impulsif-Kompulsif pada Penyakit Parkinson (QUIP) diberikan kepada peserta untuk menyelidiki perilaku pengendalian impuls (ICB); respons positif untuk setiap pertanyaan dalam QUIP menunjukkan diagnosis ICB. Gangguan perilaku tidur gerakan mata cepat (RBD) diselidiki melalui Kuesioner Skrining RBD (RBDSQ), dan skor ≥ 5 menunjukkan kemungkinan klinis RBD. Fungsi otonom dinilai dengan kuesioner Scales for Outcomes In Parkinson’s Disease–Autonomic (SCOPA-AUT); pasien PD dikategorikan memiliki disfungsi otonom jika mereka memiliki skor SCOPA-AUT ≥ 12. Untuk menilai kognisi global peserta, Penilaian Kognitif Montreal (MoCA) dilakukan. Pasien PD yang mendapat skor 25 atau kurang pada MoCA diklasifikasikan sebagai PD–gangguan kognitif ringan (PD-MCI). 2.3 Akuisisi Data Pencitraan Urutan PPMI yang diimpor digunakan untuk menjamin konsistensi data pencitraan selama akuisisi data. Gambar fMRI dan gambar berbobot T1 yang sesuai diperoleh dengan pemindai Siemens 3-T di berbagai lokasi yang berpartisipasi dalam PPMI. Parameter fMRI adalah sebagai berikut: waktu pengulangan (TR) = 2400 ms, waktu gema (TE) = 25 ms, sudut flip (FA) = 80°, ukuran voxel = 3,3 × 3,3 × 3,3 mm 3 . Gambar T1 dikumpulkan menggunakan parameter berikut: TR = 2300 ms, TE = 2,98 ms, FA = 9°, ukuran voxel = 1 × 1 × 1 mm 3 . Peserta diinstruksikan untuk beristirahat dengan tenang dengan mata terbuka, tidak memikirkan hal tertentu, dan tidak tertidur selama akuisisi data. 2.4 Praproses Data fMRI Data fMRI diproses terlebih dahulu menggunakan Resting-State fMRI Data Analysis Toolbox plus (RESTplus; http://www.restfmri.net/forum/REST ). 10 volume pertama dari setiap data fMRI dihilangkan untuk memungkinkan sinyal mencapai keseimbangan. Gambar yang tersisa kemudian menjalani pengaturan waktu irisan dan penyelarasan ulang untuk mengoreksi penundaan waktu antara irisan dan gerakan kepala, masing-masing. Empat PD-H− dan satu PD-H+ dikeluarkan dari analisis lebih lanjut karena gerakan kepala yang berlebihan (translasi > 2 mm di bidang apa pun atau rotasi > 2° ke arah mana pun). Meskipun tidak ada perbedaan signifikan dalam perpindahan bingkai rata-rata (FD) antara kedua kelompok, nilai FD disertakan sebagai kovariat dalam analisis pencitraan lebih lanjut. Gambar fMRI kemudian didaftarkan bersama dengan data struktural, dinormalisasi secara spasial ke ruang Montreal Neurological Institute (MNI), dan diambil sampelnya kembali menjadi voksel kubik 3 mm. Selanjutnya, gambar yang dinormalisasi dihaluskan menggunakan kernel Gaussian dengan lebar penuh 6 mm pada setengah maksimum (FWHM). Akhirnya, beberapa kovariat gangguan, termasuk 6 parameter gerakan kepala, sinyal materi putih, dan sinyal cairan serebrospinal, diregresikan.
2.5 Identifikasi Jaringan Fungsional yang Menarik
Dalam studi ini, kami mendefinisikan DMN, executive control network (ECN), DAN, VAN, dan VIS sebagai jaringan fungsional yang diminati karena mereka ditunjukkan sebagai jaringan terkait halusinasi PD oleh studi cross-sectional [ 7 – 15 ]. Untuk menguraikan data fMRI menjadi jaringan fungsional, analisis komponen independen kelompok spasial (ICA) dilakukan dengan menggunakan Group ICA of fMRI Toolbox (GIFT v4.0a; http://mialab.mrn.org/software/gift/ ). Jaringan fungsional yang diidentifikasi oleh group ICA secara fungsional homogen dan mungkin lebih baik dalam menangkap perbedaan individual dari batas fungsional nyata di otak daripada yang didefinisikan oleh atlas otak anatomi [ 16 , 17 ]. Dalam analisis group ICA, dua langkah reduksi data dilakukan untuk mengurangi kompleksitas komputasi. Pertama, data spesifik subjek direduksi menjadi 120 komponen utama dengan variabilitas maksimal menggunakan analisis komponen utama. Kedua, data yang direduksi subjek digabungkan dan didekomposisi menjadi 100 komponen independen kelompok (IC) menggunakan algoritma maksimisasi ekspektasi. Langkah ini diulang 20 kali dalam ICASSO untuk memastikan stabilitas dan keandalan estimasi [ 17 , 18 ]. Akhirnya, kami memperoleh peta spasial dan rentang waktu khusus subjek dengan menerapkan algoritma rekonstruksi balik ICA kelompok pada IC kelompok [ 19 , 20 ].
Kami pertama kali mengidentifikasi IC sebagai bermakna jika mereka menunjukkan aktivasi puncak dalam materi abu-abu, menunjukkan tumpang tindih spasial dengan daerah otak yang diketahui, dan memiliki rangkaian waktu yang didominasi oleh fluktuasi frekuensi rendah dan rentang dinamis tinggi. Kami kemudian memilih peta IC dari jaringan fungsional yang diinginkan dari IC yang bermakna berdasarkan penyaringan visual dan nilai korelasi spasial antara IC yang bermakna dan templat. Untuk menghilangkan sumber kebisingan yang tersisa, langkah-langkah pascaproses berikut diterapkan pada rangkaian waktu IC yang dipilih: (1) detrending linier, kuadrat, dan kubik; (2) mengabaikan outlier yang terdeteksi; (3) penyaringan low-pass dengan cutoff frekuensi tinggi 0,15 Hz; dan (4) regresi berganda dari parameter gerakan [ 17 – 20 ].
2.6 Analisis Konektivitas Fungsional Intra-Jaringan
Analisis FC intra-jaringan dilakukan menggunakan Statistical Parametric Mapping 12 (SPM12; http://www.fil.ion.ucl.ac.uk/spm/software/spm12/ ). Kami pertama-tama menggunakan uji -t satu sampel kelompok tunggal untuk memetakan distribusi seluruh otak dari jaringan fungsional yang diminati dalam kelompok PD-H− dan PD-H+ secara terpisah. Ambang statistik ditetapkan pada p < 0,05, mengoreksi beberapa perbandingan menggunakan kesalahan berdasarkan keluarga (FWE). Masker inklusif dibuat dengan menggabungkan kluster signifikan dari uji – t satu sampel dari setiap kelompok. Kemudian, perbandingan kelompok berdasarkan voxel dari FC dalam setiap jaringan dilakukan menggunakan uji – t dua sampel yang dibatasi pada masker inklusif. Usia, jenis kelamin, dan gerakan kepala dimasukkan sebagai kovariat dalam analisis. Koreksi beberapa perbandingan dilakukan pada tingkat voxel menggunakan FWE; p < 0,05 dianggap signifikan secara statistik. Skor z ICA individual untuk kedua kelompok diekstraksi dari wilayah yang diidentifikasi dalam analisis di atas dan digunakan untuk analisis regresi lebih lanjut.
2.7 Analisis Konektivitas Fungsional Antar Jaringan
Untuk menyelidiki perbedaan antarkelompok dalam FC antarjaringan, rangkaian waktu dari setiap jaringan fungsional yang diminati pertama kali diekstraksi. Kemudian, FC antarjaringan diestimasikan dengan menghitung koefisien korelasi Pearson untuk rangkaian waktu di setiap pasangan dari lima jaringan fungsional yang diminati. Koefisien diubah menjadi z -skor melalui transformasi Fisher r ke z . Akhirnya, perbandingan antarkelompok dilakukan dengan menggunakan uji t dua sampel , dengan usia, jenis kelamin, dan gerakan kepala sebagai kovariat. Ambang signifikansi ditetapkan pada p < 0,05, dikoreksi FWE.
2.8 Analisis Morfometri Berbasis Voxel
Analisis morfometri berbasis voksel (VBM) dilakukan menggunakan Computational Anatomy Toolbox 12 (CAT12, http://www.neuro.uni-jena.de/cat/ ) yang diterapkan dalam SPM12. Pertama, gambar berbobot T1 disegmentasi menjadi materi abu-abu, materi putih, dan cairan serebrospinal setelah reorientasi. Kemudian, gambar yang disegmentasi dinormalisasi ke ruang standar Montreal Neurological Institute (MNI) menggunakan algoritma Diffeomorphic Anatomic Registration Through Exponentiated Lie algebra (DARTEL). Akhirnya, gambar materi abu-abu yang dinormalisasi dihaluskan menggunakan kernel Gaussian isotropik dengan lebar penuh 8 mm pada setengah maksimum (FWHM). Inspeksi visual dan fungsi “periksa homogenitas sampel” yang diterapkan dalam CAT12 digunakan untuk memeriksa segmentasi keseluruhan dan akurasi registrasi. Tidak ada peserta yang dikeluarkan dari analisis karena kegagalan segmentasi atau kualitas gambar yang tidak memadai. Perbedaan kelompok dalam volume materi abu-abu diperiksa dengan menggunakan uji t dua sampel yang diterapkan di SPM12, dengan usia, jenis kelamin, dan volume intrakranial total sebagai kovariat. Hasilnya dikoreksi untuk beberapa perbandingan menggunakan FWE; p < 0,05 dianggap signifikan secara statistik.
2.9 Analisis Statistik
Analisis statistik untuk data demografi dan klinis dilakukan menggunakan IBM SPSS Statistics 22 ( https://www.ibm.com/products/spss-statistics ) dan GraphPad Prism 6.0 ( https://www.graphpad.com/scientific-software/prism ). Normalitas distribusi data dinilai menggunakan uji Shapiro–Wilk. Variabel kontinu yang terdistribusi normal dibandingkan antar kelompok menggunakan uji t Student , sedangkan variabel kontinu yang miring dianalisis dengan uji Mann–Whitney U. Perbedaan antar kelompok dalam variabel kategoris dievaluasi dengan uji chi-kuadrat. Hasil dengan p < 0,05 dianggap signifikan secara statistik.
Kami melakukan analisis regresi logistik biner univariat untuk menyelidiki hubungan antara perkembangan halusinasi dan variabel klinis dasar serta penanda FC. Setiap penanda klinis dengan perbedaan antarkelompok yang signifikan dimodelkan sebagai variabel independen secara terpisah dan label kelompok sebagai variabel dependen, sambil mengendalikan usia dan jenis kelamin. Analisis regresi univariat serupa dilakukan untuk memeriksa apakah setiap metrik FC dasar yang menunjukkan perbedaan antarkelompok yang signifikan berfungsi sebagai prediktor halusinasi, dengan usia, jenis kelamin, dan gerakan kepala sebagai kovariat. Variabel dengan signifikansi statistik dalam analisis univariat dimasukkan dalam analisis regresi berganda lebih lanjut.
Beberapa model regresi logistik biner multivariat kemudian dikembangkan dengan halusinasi pada tindak lanjut 2 tahun sebagai variabel dependen: model penanda klinis saja, model penanda FC saja, dan model penanda FC gabungan klinis. Model penanda klinis saja dikoreksi untuk usia dan jenis kelamin, sedangkan dua model lainnya disesuaikan untuk usia, jenis kelamin, dan gerakan kepala. Kami menghapus variabel menggunakan metode seleksi balik hingga semua variabel signifikan pada p < 0,05 dalam model. Selain itu, analisis karakteristik operasi penerima (ROC) dilakukan dengan menggunakan perangkat lunak MedCal ( https://www.medcalc.org/ ). Diskriminasi model diukur dengan menggunakan area di bawah kurva (AUC); kemampuan prediktif dibandingkan di antara model menggunakan metode Delong.
3 Hasil
3.1 Perbandingan Demografi dan Karakteristik Klinis pada Awal Penelitian
Sebanyak 20 pasien PD mengalami halusinasi selama periode tindak lanjut 2 tahun. Dari 20 pasien dengan PD-H+ tersebut, 15 mengalami halusinasi ringan, empat melaporkan halusinasi yang terbentuk dengan baik dengan pemahaman, dan satu pasien mengalami halusinasi yang terbentuk tanpa pemahaman.
Seperti yang ditunjukkan pada Tabel 1 , pasien dengan PD-H− dan PD-H+ tidak berbeda secara signifikan dalam hal usia, jenis kelamin, stadium Hoehn-Yahr, atau skor MDS-UPDRS-III. Dibandingkan dengan kelompok PD-H−, kelompok PD-H+ memiliki skor RBDSQ dan SCOPA-AUT yang secara signifikan lebih tinggi pada awal. Selain itu, PD-H+ memiliki prevalensi EDS dan ICB yang secara signifikan lebih tinggi daripada PD-H−. Tidak ditemukan perbedaan signifikan antar kelompok pada gejala awal lainnya, termasuk depresi atau MCI.
TABEL 1. Karakteristik demografi dan klinis dasar PD-H− dan PD-H+.
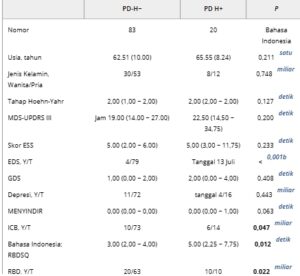
Catatan: Data dinyatakan sebagai mean (SD), median (IQR) atau angka. Nilai yang dicetak tebal menunjukkan perbedaan yang signifikan ( p < 0,05).
Singkatan: EDS, rasa kantuk berlebihan di siang hari; ESS, Skala Kantuk Epworth; F, perempuan; GDS, Skala Depresi Geriatri; ICB, perilaku pengendalian impuls; M, laki-laki; MCI, gangguan kognitif ringan; MDS-UPDRS III, Movement Disorders Society–Unified Parkinson’s Disease Rating Scale Part III; MoCA, Penilaian Kognitif Montreal; N, tidak; NA, tidak berlaku; PD-H−, penyakit Parkinson tanpa halusinasi; PD-H+, penyakit Parkinson dengan halusinasi; QUIP, Kuesioner untuk Gangguan Impulsif–Kompulsif pada Penyakit Parkinson; RBD, gangguan perilaku tidur REM; RBDSQ, kuesioner skrining RBD; SCOPA-AUT, Skala untuk Hasil pada Penyakit Parkinson-Otonom; Y, ya.
Uji t Siswa untuk dua kelompok .
Uji b χ 2 untuk dua kelompok.
c Uji Mann–Whitney untuk dua kelompok.
3.2 Jaringan Konektivitas Intrinsik
Berdasarkan informasi anatomi dan sifat fungsional yang diduga, 36 IC yang bermakna dipilih dan dikelompokkan ke dalam lima jaringan fungsional yang diinginkan: DMN (IC 6, 16, 21, 42, 64, 70, 71, 72, 82, 99), ECN (IC 13, 19, 51, 75, 84, 92, 93), DAN (IC 38, 52, 83), VAN (IC 40, 77, 96), dan VIS (IC 5, 8, 15, 24, 31, 35, 41, 50, 56, 58, 78, 81, 100). Gambar 1 menunjukkan peta spasial IC yang dipilih yang dikelompokkan berdasarkan jaringan fungsional. Label komponen dan koordinat puncak IC dirinci dalam Tabel S1 .
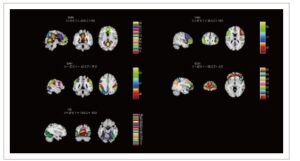
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Peta spasial dari 36 komponen independen bermakna yang diidentifikasi oleh analisis komponen independen. Komponen independen ini diurutkan menjadi lima jaringan fungsional yang menarik: DAN, jaringan perhatian dorsal; DMN, jaringan mode default; ECN, jaringan kontrol eksekutif; VAN, jaringan perhatian ventral; VIS, jaringan visual.
3.3 Perubahan Konektivitas Fungsional Intra-Jaringan
Dibandingkan dengan PD-H−, PD-H+ menunjukkan penurunan FC dasar yang signifikan di girus supramarginal kiri dan lobulus parietal superior kiri dalam DAN ( t = -6,65 ~ -4,90, p < 0,05, FWE dikoreksi) (Gambar 2A dan Tabel 2 ). Selain itu, PD-H+ memiliki FC dasar yang signifikan lebih tinggi di precuneus kanan dan girus cingulate posterior kanan dalam DMN ( t = 6,16 ~ 7,78, p < 0,05, FWE dikoreksi) (Gambar 2B dan Tabel 2 ). Tidak ada perbedaan antar kelompok yang signifikan yang terdeteksi dalam FC dalam ECN, VAN, atau VIS.

GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Perbedaan kelompok dalam konektivitas fungsional intra-jaringan dan antar-jaringan antara PD-H− dan PD-H+ pada awal. (A) Dibandingkan dengan PD-H−, PD-H+ memiliki konektivitas fungsional yang menurun secara signifikan dalam DAN ( p < 0,05, FWE terkoreksi). (B) PD-H+ menunjukkan konektivitas fungsional yang meningkat secara signifikan dalam DMN dibandingkan dengan PD-H− ( p < 0,05, FWE terkoreksi). (C) PD-H+ menunjukkan konektivitas fungsional yang meningkat secara signifikan antara DAN dan VIS ( p = 0,02, FWE terkoreksi). Kelompok dengan perbedaan antar-kelompok yang signifikan ditumpangkan pada templat. PD-H−, PD tanpa halusinasi; PD-H+, PD dengan halusinasi; DAN, jaringan perhatian dorsal; DMN, jaringan mode default; VIS, jaringan visual.
TABEL 2. Wilayah otak yang menunjukkan perbedaan konektivitas fungsional intra-jaringan yang signifikan antara PD-H− dan PD-H+.
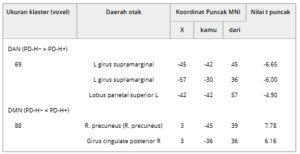
Catatan: Ambang batas statistik ditetapkan pada p < 0,05, yang mengoreksi beberapa perbandingan dengan kesalahan berdasarkan keluarga (FWE).
Singkatan: DAN, jaringan perhatian dorsal; DMN, jaringan mode default; MNI, Institut Neurologi Montreal; PD-H−, penyakit Parkinson tanpa halusinasi visual; PD-H+, penyakit Parkinson dengan halusinasi visual; x, y, z, koordinat lokasi puncak utama dalam ruang MNI.
3.4 Perubahan Konektivitas Fungsional Antar Jaringan
Dibandingkan dengan PD-H−, PD-H+ menunjukkan penurunan FC dasar yang signifikan antara DAN dan VIS ( t = −3,31, p = 0,02, FWE terkoreksi) (Gambar 2C ). Tidak ditemukan perbedaan signifikan dalam FC antar-jaringan lainnya antara kelompok PD-H− dan PD-H+ pada awal. Analisis VBM tidak menemukan perbedaan signifikan dalam volume materi abu-abu antara pasien dengan PD-H− dan PD-H+ ( p < 0,05, FWE terkoreksi).
3.5 Prediksi Halusinasi Berdasarkan Penanda Konektivitas Klinis dan Fungsional Dasar
Analisis regresi logistik biner multivariat, termasuk penanda klinis, menunjukkan bahwa keberadaan EDS (rasio peluang [OR] = 9,559, p = 0,003) dan disfungsi otonom (OR = 4,792, p = 0,009) merupakan prediktor signifikan halusinasi pada PD selama periode tindak lanjut 2 tahun (Tabel 3 ). Model penanda FC saja menemukan bahwa FC dalam DMN pada awal (OR = 4,550, p = 0,006) dikaitkan dengan peningkatan risiko yang signifikan untuk mengembangkan halusinasi, sementara FC awal dalam DAN (OR = 0,137, p = 0,008) dan FC awal antara DAN dan VIS (OR = 0,016, p = 0,030) dikaitkan dengan penurunan risiko yang signifikan untuk mengalami halusinasi. Dengan menggabungkan penanda klinis dan FC, analisis regresi multivariat mengonfirmasikan prediktor signifikan halusinasi termasuk keberadaan EDS (OR = 6,928, p = 0,022), keberadaan disfungsi otonom (OR = 6,531, p = 0,012), FC dalam DMN (OR = 5,587, p = 0,006), FC dalam DAN (OR = 0,217, p = 0,041), dan FC antara DAN dan VIS (OR = 0,004, p = 0,019) pada awal.
TABEL 3. Hasil analisis regresi logistik biner untuk prediktor potensial halusinasi PD.
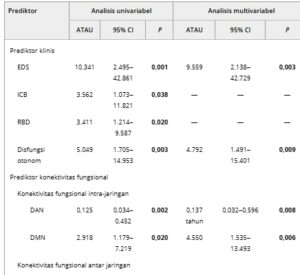
Catatan: Nilai yang dicetak tebal menunjukkan perbedaan yang signifikan ( p < 0,05).
Singkatan: CI, interval kepercayaan; DAN, jaringan perhatian dorsal; DMN, jaringan mode default; EDS, kantuk berlebihan di siang hari; ICB, perilaku pengendalian impuls; OR, rasio ganjil; RBD, gangguan perilaku tidur gerakan mata cepat; VIS, jaringan visual.
3.6 Nilai Prediktif Penanda Konektivitas Klinis dan Fungsional
Analisis ROC menunjukkan bahwa model prediktor klinis (AUC = 0,795, 95% CI = 0,705–0,869) dan model prediktor FC (AUC = 0,822, 95% CI = 0,734–0,890) memiliki akurasi tinggi dalam prediksi halusinasi pada PD. Model yang menggabungkan prediktor klinis dan FC secara signifikan meningkatkan kemampuan prediksi halusinasi pada PD dibandingkan dengan model prediktor klinis (AUC = 0,927, 95% CI = 0,859–0,969; metode Delong, p = 0,024) (Gambar 3 ).
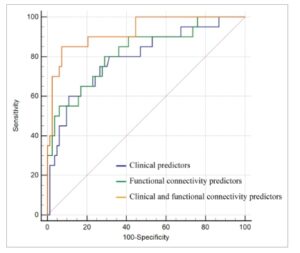
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
Kurva karakteristik pengoperasian penerima untuk prediksi halusinasi pada tindak lanjut 2 tahun pada PD yang baru didiagnosis. Dibandingkan dengan model prediktor klinis, model yang menggabungkan prediktor konektivitas klinis dan fungsional memiliki akurasi yang jauh lebih tinggi dalam membedakan PD-H− dan PD-H+ pada awal (metode Delong, p = 0,024).
4 Diskusi
Studi ini menunjukkan adanya FC abnormal di dalam dan di antara jaringan otak intrinsik pada awal penelitian pada pasien PD yang mengalami halusinasi selama tindak lanjut 2 tahun. Selain itu, timbulnya halusinasi secara klinis pada PD terkait dengan adanya disfungsi otonom dan EDS pada awal penelitian. Dibandingkan dengan prediktor klinis saja, model yang menggabungkan penanda klinis dan FC menghasilkan prediksi yang lebih akurat tentang halusinasi di masa mendatang pada PD.
DAN, yang terlibat dalam perhatian yang digerakkan oleh tujuan dan berkelanjutan, mengerahkan modulasi terkait perhatian top-down pada area visual striata dan ekstra-striata [ 21 ]. Dalam penelitian ini, kami menemukan FC dalam DAN menurun secara signifikan pada kelompok PD-H+ pada awal, berbeda dengan kelompok PD-H−. Lebih jauh lagi, FC dasar antara DAN dan VIS menurun secara signifikan pada pasien dengan PD-H+ dibandingkan dengan yang tidak. Temuan ini menunjukkan bahwa kontrol top-down yang cacat dari sistem pemrosesan visual sudah ada pada PD-H+ sebelum perkembangan halusinasi. Selama input visual yang ambigu, gangguan ini dapat mengakibatkan imajinasi yang tidak relevan menjadi fokus perhatian dan dengan demikian menyebabkan halusinasi [ 15 ].
DMN bertanggung jawab untuk introspeksi dan penggabungan informasi referensi-diri ke dalam kesadaran [ 22 ]. Berlawanan dengan DAN, DMN menunjukkan pola aktivasi yang berlawanan saat melakukan tugas kognitif yang menuntut perhatian [ 23 ]. Studi cross-sectional telah menunjukkan aktivasi DAN yang tidak efisien dan peningkatan aktivitas DMN secara bersamaan pada PD dengan halusinasi [ 10 , 11 ]. Selain itu, pasien PD dengan halusinasi menunjukkan peningkatan FC yang signifikan antara DMN dan VIS dibandingkan dengan yang tidak [ 11 , 14 ]. Overaction yang abnormal dari DMN dan peningkatan coupling DMN dengan VIS pada PD akan menimbulkan intrusi patologis DMN selama pemrosesan visual, sehingga menyebabkan mispersepsi visual dan halusinasi [ 5 , 24 ]. Konsisten dengan studi sebelumnya, kami menemukan peningkatan FC dasar yang signifikan dalam DMN pada PD-H+ dibandingkan dengan PD-H−. Akan tetapi, kami tidak mendeteksi adanya FC abnormal antara DMN dan VIS pada awal PD-H+. Dengan mempertimbangkan semua fakta yang disebutkan di atas, kami menduga peningkatan FC dalam DMN pada awal dapat menyebabkan pasien PD mengalami halusinasi; akan tetapi, halusinasi kemungkinan hanya terjadi jika DMN terlalu terkait dengan VIS.
Bahasa Indonesia: Sesuai dengan penelitian sebelumnya, kami menunjukkan EDS dan disfungsi otonom pada awal penelitian dikaitkan dengan risiko halusinasi yang lebih besar pada PD [ 25 ]. Tidak jelas bagaimana tepatnya EDS dan disfungsi otonom menyebabkan timbulnya halusinasi pada PD. Namun, dapat dipostulatkan bahwa halusinasi, disfungsi otonom, dan EDS pada PD mungkin didorong oleh disfungsi jaringan otak yang serupa. Misalnya, EDS pada pasien PD telah dikaitkan dengan peningkatan aktivasi dalam DMN [ 26 ]. Selain itu, tingkat keparahan disfungsi otonom pada PD berkorelasi negatif dengan FC dalam DAN [ 27 ], yang menyiratkan gangguan DAN dalam patogenesis disfungsi otonom. Dalam penelitian ini, kami tidak dapat mengulangi temuan sebelumnya tentang hubungan antara halusinasi PD dan faktor risiko awal lainnya, termasuk RBD dan depresi [ 6 , 28 , 29 ]. Perbedaan yang tampak antara penelitian mungkin disebabkan oleh perbedaan dalam hasil utama, waktu tindak lanjut, dan peserta.
Salah satu tujuan dari penelitian ini adalah untuk menilai nilai dari berbagai penanda dasar dalam memprediksi halusinasi PD. Penanda klinis dasar, khususnya EDS dan disfungsi otonom, memberikan nilai diskriminatif yang berguna untuk prediksi halusinasi PD. Dibandingkan dengan penanda klinis saja, model yang mempertimbangkan penanda klinis dan FC secara signifikan meningkatkan nilai prediktif, yang menunjukkan bahwa model gabungan ini lebih berguna untuk mengidentifikasi orang yang berisiko mengalami halusinasi pada PD yang baru didiagnosis. Kami percaya bahwa model risiko ini dapat memberikan informasi prognostik halusinasi kepada pasien PD dan pengasuh mereka, sehingga meningkatkan perawatan dan hasil pasien. Identifikasi penanda prediktif juga memberikan wawasan mekanistik potensial ke dalam halusinasi PD, dengan demikian mendorong pengembangan strategi pengobatan baru. Misalnya, stimulasi magnetik transkranial dari DAN dan DMN dapat dipertimbangkan di antara proyek penelitian pengobatan di masa mendatang.
Penelitian ini memiliki beberapa keterbatasan. Pertama-tama kami mengakui bahwa jumlah pasien dalam kelompok PD-H+ relatif kecil; penelitian di masa depan dengan ukuran sampel yang lebih besar diperlukan untuk lebih memperdalam pemahaman kita tentang mekanisme yang mendasari halusinasi PD. Kekhawatiran tambahan adalah bahwa pengobatan antiparkinson tidak dimasukkan sebagai kovariat dalam analisis, karena perannya dalam halusinasi PD masih kontroversial [ 1 ]. Sementara beberapa penelitian mengidentifikasi pengobatan antiparkinson sebagai faktor risiko halusinasi PD [ 30 , 31 ], penelitian lain gagal menunjukkan hubungan kausal langsung antara pengobatan antiparkinson dan halusinasi PD [ 32 , 33 ]. Dalam penelitian ini, tidak ada peserta yang mengonsumsi pengobatan dopaminergik pada awal, dan tidak ditemukan perbedaan signifikan dalam proporsi pasien yang mengonsumsi pengobatan antiparkinson, L-dopa, atau agonis dopamin pada setiap titik waktu tindak lanjut antara kedua kelompok (Tabel S2 ). Akhirnya, kami tidak melakukan analisis subkelompok pada pasien PD-H+. Halusinasi pada PD telah dideskripsikan sebagai jinak atau ganas. Dibandingkan dengan halusinasi jinak, halusinasi ganas lebih mungkin mengganggu wawasan, berlanjut pada PD, dan memengaruhi kualitas hidup pasien. Halusinasi juga telah diklasifikasikan sebagai dini, muncul dalam waktu 5 tahun sejak timbulnya PD, atau lanjut. Namun, klasifikasi ini telah diabaikan oleh bukti yang menunjukkan bahwa tingkat keparahan dan frekuensi halusinasi PD cenderung berkembang secara independen dari waktu kemunculannya [ 34 , 35 ].
5 Kesimpulan
Sebagai kesimpulan, kami menemukan bahwa perubahan jaringan otak intrinsik dapat memprediksi halusinasi di masa mendatang pada PD. Temuan ini mendukung potensi manfaat FC otak sebagai penanda untuk skrining pasien PD yang berisiko mengalami halusinasi dan menjelaskan peran FC yang terganggu dalam etiologi halusinasi PD.

