
Abstrak
Axatilimab, antibodi monoklonal humanisasi afinitas tinggi yang menargetkan reseptor faktor 1 perangsang koloni, disetujui untuk pengobatan penyakit graft-versus-host kronis (cGVHD). Di sini, kami menjelaskan hubungan paparan-respons untuk efikasi dan keamanan pada pasien dengan cGVHD yang menerima axatilimab. Hubungan paparan-efikasi dinilai pada pasien yang diobati dalam studi AGAVE-201 ( n = 239); hubungan paparan-keamanan dinilai pada pasien yang diobati dalam studi AGAVE-201 ( n = 239) dan fase 1/2 SNDX-6352-0503 ( n = 39). Untuk titik akhir biner atau waktu-ke-peristiwa, analisis regresi logistik atau Cox, masing-masing, dilakukan dengan menggunakan metrik paparan axatilimab yang berasal dari model farmakokinetik/farmakodinamik populasi yang dikembangkan sebelumnya. Respons keseluruhan dan peningkatan ≥ 7 poin dalam respons Skala Gejala Lee yang dimodifikasi dikaitkan dengan paparan axatilimab, dengan paparan axatilimab yang lebih rendah meningkatkan kemungkinan respons. Durasi respons tidak dikaitkan dengan paparan axatilimab. Sepuluh dari 11 titik akhir keamanan dikaitkan dengan paparan axatilimab, dengan paparan axatilimab yang lebih tinggi meningkatkan kemungkinan efek samping. Di antara 3 rejimen yang dievaluasi dalam AGAVE-201, rejimen 0,3 mg/kg sekali setiap 2 minggu (Q2W) memiliki probabilitas respons yang diprediksi tertinggi. Selain itu, kelompok dosis ini memiliki probabilitas kejadian kejadian yang diprediksi terendah di semua 10 titik akhir keamanan yang terkait dengan paparan di antara rejimen yang dievaluasi. Meskipun berat badan memengaruhi paparan axatilimab sebesar > 20%, efeknya pada titik akhir efikasi dan keamanan tetap minimal, dengan perbedaan maksimum ≤ 0,4% dan ≤ 4,4% antara kuartil ke-1 dan ke-4 berat badan, masing-masing. Secara keseluruhan, temuan ini mendukung profil manfaat-risiko axatilimab 0,3 mg/kg Q2W pada pasien dengan cGVHD.
Sorotan Studi
APA PENGETAHUAN TERKINI TENTANG TOPIK TERSEBUT?
Axatilimab, antibodi monoklonal yang menargetkan reseptor faktor perangsang koloni 1 (CSF-1R), baru-baru ini disetujui untuk penyakit graft-versus-host (cGVHD) kronis setelah ≥ 2 lini terapi sistemik sebelumnya. Model farmakokinetik/farmakodinamik populasi untuk axatilimab baru-baru ini telah dijelaskan.
PERTANYAAN APA YANG DIJAWAB OLEH STUDI INI?
Kami bertujuan untuk mengkarakterisasi hubungan paparan–kemanjuran dan paparan–keamanan untuk axatilimab di antara pasien dengan cGVHD.
APA YANG DITAMBAHKAN STUDI INI PADA PENGETAHUAN KITA?
Dalam analisis ini, paparan axatilimab yang lebih rendah dikaitkan dengan respons klinis yang lebih tinggi, dan paparan axatilimab yang lebih tinggi dikaitkan dengan frekuensi kejadian buruk yang lebih tinggi. Pada pasien dengan cGVHD, axatilimab 0,3 mg/kg setiap 2 minggu (Q2W) memiliki profil manfaat-risiko yang optimal. Prediksi berbasis model menunjukkan bahwa perubahan paparan axatilimab yang dimediasi oleh berat badan tidak memiliki efek signifikan pada titik akhir efikasi dan keamanan.
BAGAIMANA HAL INI DAPAT MENGUBAH FARMAKOLOGI KLINIS ATAU ILMU TRANSLASIONAL?
Analisis ini memberikan dukungan lebih lanjut untuk pemilihan dosis axatilimab 0,3 mg/kg Q2W pada pasien dengan cGVHD.
Penyakit graft-versus-host kronis (cGVHD) adalah komplikasi yang dimediasi imun dan berpotensi mengancam jiwa yang memengaruhi sekitar 50% pasien yang menerima transplantasi sel induk hematopoietik alogenik (allo-HSCT). 1 – 4 cGVHD merupakan penyebab utama kematian nonrelaps setelah allo-HSCT. 5 Selain itu, terdapat beban gejala yang cukup besar pada cGVHD (paling sering dinilai menggunakan Skala Gejala Lee yang dimodifikasi [mLSS]). 6 Penatalaksanaan cGVHD ditantang oleh kebutuhan untuk menyeimbangkan imunosupresi, toksisitas kumulatif, dan risiko infeksi dari kortikosteroid dan terapi imunosupresif lainnya 7 , 8 ; infeksi juga merupakan penyebab utama kematian nonrelaps setelah allo-HSCT. 5
Monosit dan makrofag yang bermukim di jaringan (termasuk monosit yang telah bermigrasi keluar dari aliran darah) berkontribusi terhadap peradangan dan fibrosis multiorgan yang merupakan ciri khas patogenesis cGVHD. 9 Monosit dan makrofag bergantung pada aktivasi faktor perangsang koloni 1 (CSF-1) atau interleukin-34 dari reseptor CSF-1 (CSF-1R) untuk kelangsungan hidup sel, migrasi, dan proliferasi. 10 Axatilimab adalah antibodi monoklonal imunoglobulin G4 (rantai ringan kappa) humanisasi anti–CSF-1R dengan afinitas tinggi. 11
Axatilimab awalnya dievaluasi untuk pengobatan cGVHD dalam studi fase 1/2 (SNDX-6352-0503 [NCT03604692]). 12 Pada fase 1, 17 pasien menerima axatilimab pada tingkat dosis 0,15 mg/kg sekali setiap 2 minggu (Q2W), 0,5 mg/kg Q2W, 1 mg/kg Q2W, 3 mg/kg Q2W, dan 3 mg/kg setiap 4 minggu (Q4W). 12 Pada fase 2, 23 pasien menerima tingkat dosis 1 mg/kg Q2W. 12 Respons klinis axatilimab disertai dengan pengurangan beban gejala cGVHD. 12 Tingkat respons keseluruhan (ORR) pada Siklus 7 Hari 1 adalah 67% (95% CI, 50%–81%) di antara semua pasien yang dapat dievaluasi dalam studi tersebut. 12
Berdasarkan hasil SNDX-6352-0503, efikasi dan keamanan axatilimab pada pasien dengan cGVHD dievaluasi lebih lanjut dalam studi pivotal fase 2 AGAVE-201 (NCT04710576). 13 ORR pada Siklus 7 Hari 1 adalah 74%, 67%, dan 50% dalam kelompok 0,3 mg/kg Q2W, 1 mg/kg Q2W, dan 3 mg/kg Q4W, masing-masing. 13 Pengurangan beban gejala cGVHD yang bermakna secara klinis (didefinisikan sebagai perbaikan ≥ 7 poin dalam mLSS 14 ) dalam 6 siklus pertama dilaporkan oleh 55%, 54%, dan 36% pasien dalam kelompok 0,3 mg/kg Q2W, 1 mg/kg Q2W, dan 3 mg/kg Q4W, masing-masing. 15 Kejadian yang tidak diharapkan (AE) sebagian besar adalah kejadian yang ringan dan dapat diatasi tanpa masalah keamanan yang tidak diharapkan. 13 Penghentian pengobatan karena kejadian yang tidak diharapkan yang muncul akibat pengobatan (TEAE) terjadi pada 6%, 22%, dan 18% pasien dengan regimen 0,3 mg/kg Q2W, 1 mg/kg Q2W, dan 3 mg/kg Q4W, masing-masing. 13
Model farmakokinetik/farmakodinamik (PK/PD) populasi sebelumnya dikembangkan berdasarkan data gabungan dari 4 studi klinis axatilimab. 16 Model struktural terdiri dari model PK axatilimab 2-kompartemen dengan model klirens dan turnover jenuh untuk CSF-1, sel monosit CD14+/CD16++ nonklasik (NCMC), aspartat aminotransferase (AST), dan kreatin fosfokinase (CPK). 16 Tiga kovariat dikaitkan dengan parameter PK dan dimasukkan dalam model akhir: berat badan pada volume distribusi, dan CSF-1 dasar dan antibodi antiobat (ADA) pada komponen linier klirens axatilimab. Kovariat berat badan dan CSF-1 disesuaikan dengan median populasi dan diperkenalkan melalui fungsi daya, sementara ADA dimasukkan sebagai kovariat kategoris yang bergantung waktu. Di antara 3 kovariat ini, berat badan adalah satu-satunya kovariat yang memengaruhi paparan kondisi mapan axatilimab sebesar > 20%. 16 Di sini, kami mengkarakterisasi hubungan paparan-respons axatilimab untuk kemanjuran dan keamanan untuk lebih mendukung pemilihan dosis axatilimab pada pasien dengan cGVHD.
METODE
Populasi studi dan titik akhir
Data untuk analisis ini diperoleh dari 2 studi klinis pada pasien dengan cGVHD, studi fase 1/2 (SNDX-6352-0503) 12 dan AGAVE-201, studi fase 2 penting pada pasien dengan cGVHD, yang keduanya dirangkum dalam Tabel S1 . Dalam SNDX-6352-0503, dosis axatilimab sebesar 0,15 mg/kg Q2W, 0,5 mg/kg Q2W, 1 mg/kg Q2W, 3 mg/kg Q2W, dan 3 mg/kg Q4W diberikan. Dalam AGAVE-201, 3 dosis axatilimab (0,3 mg/kg Q2W, 1 mg/kg Q2W, 3 mg/kg Q4W) dievaluasi. Durasi pengobatan rata-rata di seluruh dosis adalah 7,1 bulan dan 7,8 bulan pada SNDX-6352-0503 dan AGAVE-201.
Kumpulan data analisis pajanan-efikasi mencakup pasien yang dapat dievaluasi efikasinya dalam AGAVE-201 yang telah menerima ≥ 1 dosis axatilimab dan memiliki ≥ 1 konsentrasi plasma pascadosis yang dapat diukur. Titik akhir efikasi mencakup 2 titik akhir biner (respons keseluruhan dan peningkatan ≥ 7 poin dalam mLSS [ambang batas regulasi untuk perbaikan gejala cGVHD yang bermakna secara klinis]). Durasi respons (DOR), titik akhir waktu-ke-peristiwa, dievaluasi pada pasien yang mencapai respons keseluruhan dan didefinisikan sebagai interval dari tanggal respons awal hingga perkembangan organ pertama cGVHD dari titik nadir, dimulainya terapi anti-cGVHD baru, atau kematian karena penyebab apa pun, mana pun yang terjadi lebih dulu.
Kumpulan data analisis pajanan-keselamatan mencakup pasien yang dapat dievaluasi keamanannya dalam SNDX-6352-0503 dan AGAVE-201 yang telah menerima ≥ 1 dosis axatilimab dan memiliki ≥ 1 konsentrasi pascadosis yang dapat diukur. Titik akhir keamanan (semua biner) mencakup TEAE tingkat ≥ 3, TEAE yang menyebabkan modifikasi dosis (termasuk penghentian, interupsi dosis, dan pengurangan dosis), kejadian buruk yang menjadi perhatian khusus (AESI) tingkat ≥ 3, TEAE serius, TEAE terkait pengobatan, infeksi dengan etiologi yang tidak ditentukan (istilah AE yang dikelompokkan untuk infeksi yang bukan bakteri, virus, atau jamur), peningkatan amilase dan lipase (istilah AE yang dikelompokkan), peningkatan CPK (istilah AE yang dikelompokkan), peningkatan enzim hati (istilah AE yang dikelompokkan), edema periorbital (istilah AE yang dikelompokkan), dan reaksi terkait infus (istilah AE yang dikelompokkan termasuk reaksi hipersensitivitas). AE merupakan efek samping yang muncul akibat pengobatan tanpa memandang kausalitas. AESI mencakup reaksi terkait infus, infeksi, peningkatan enzim hati, peningkatan CPK, edema periorbital, dan peningkatan amilase dan lipase, yang ditentukan berdasarkan golongan obat dan mekanisme kerja axatilimab.
Metrik paparan PK
Metrik paparan PK dari axatilimab diestimasikan untuk masing-masing pasien berdasarkan estimasi Bayes empiris dari parameter PK, dengan mempertimbangkan nilai kovariat individual (yaitu, berat badan, CSF-1, dan ADA [kovariat invarian waktu, di mana ADA diberi nilai 1 jika positif pada titik waktu mana pun dan 0 jika tidak]), dan riwayat dosis spesifik pasien dari analisis PK/PD populasi gabungan. 16 Kovariat berat badan dan CSF-1 disesuaikan dengan median populasi dan diperkenalkan melalui fungsi daya. Sebanyak 6 metrik paparan axatilimab dan padanannya yang ditransformasikan secara logaritma dievaluasi dalam analisis respons paparan dari efikasi dan keamanan. Metrik paparan ini mencakup konsentrasi maksimum dosis tunggal (CMAXSD) dan area di bawah kurva (AUC) dari waktu 0 hingga tak terbatas setelah dosis tunggal (AUCSDINF). Siklus pengobatan 4 minggu pertama Cmax ( CMAX1 ) dan AUC (AUC1) dan siklus pengobatan 4 minggu kondisi mapan Cmax ( CMAXSS) dan AUC (AUCSS) digunakan untuk beberapa rejimen dosis. Dua parameter paparan tambahan, Cmax dan AUC pada saat kejadian pertama (TOFI; CMAXSDTOFI dan AUCSDTOFI, masing-masing), juga dibuat untuk analisis keamanan paparan. Karena sebagian besar pengukuran konsentrasi palung (yaitu, Cmin ) pada siklus pertama dan kondisi mapan berada di bawah batas kuantisasi, Cmin tidak dievaluasi sebagai metrik paparan dalam analisis respons paparan.
Parameter paparan yang terkait dengan dosis tunggal dan siklus pengobatan pertama diperoleh dari simulasi model PK/PD populasi menggunakan dosis nominal yang diberikan dan rejimen setiap pasien. Parameter paparan (CMAXSDTOFI dan AUCSDTOFI) pada hari kejadian keamanan pertama dibuat untuk setiap titik akhir keamanan dan masing-masing pasien menggunakan dosis tunggal segera sebelum TOFI. Untuk memperhitungkan perubahan dosis masing-masing pasien yang terjadi selama penelitian, parameter PK kondisi mapan disimulasikan menggunakan dosis rata-rata siklus untuk setiap titik akhir efikasi dan keamanan dan masing-masing pasien menggunakan persamaan berikut:

di mana n adalah jumlah kejadian pemberian dosis sebelum TOFI dan tn adalah waktu dosis ke -n .
Algoritme yang kompleks dikembangkan untuk memperoleh TOFI, yang kemudian diterapkan secara individual untuk setiap titik akhir dan pasien. Untuk DOR, TOFI disesuaikan dengan waktu berakhirnya respons. Untuk peningkatan ≥ 7 poin dalam mLSS, respons keseluruhan, dan semua hasil keamanan, TOFI disesuaikan dengan waktu respons pertama atau kejadian keamanan. Jika tidak ada kejadian yang terjadi, TOFI ditetapkan sebagai akhir pengobatan untuk keamanan dan ditetapkan sebagai akhir pengobatan, Siklus 7 Hari 1, atau dimulainya terapi anti-cGVHD baru, mana pun yang terjadi lebih dulu untuk kemanjuran.
Pengembangan model paparan-respons
Analisis paparan-respons, termasuk analisis data eksplorasi, pengembangan model, diagnostik, dan simulasi maju, diimplementasikan dalam perangkat lunak R (v4.2.1) dan mengikuti alur kerja pengembangan model umum ( Data S2 dan S3 ). 17 , 18
Pertama, plot eksploratori digunakan untuk menilai hubungan paparan-respons. Untuk titik akhir biner, data dibagi menurut kuartil paparan, dan probabilitas respons rata-rata diplotkan vs. paparan rata-rata dengan garis regresi logistik yang disesuaikan. Untuk variabel waktu-ke-peristiwa (DOR), kurva Kaplan–Meier diplot menurut kuartil bersama dengan uji log-rank. Setelah eksplorasi grafis, model regresi logistik linier dievaluasi untuk titik akhir biner, dan model regresi bahaya proporsional Cox digunakan untuk DOR.
Setelah metrik paparan dipilih ke dalam model, analisis kovariat dilakukan menurut proses penambahan maju dan eliminasi mundur bertahap standar. Ringkasan kovariat untuk populasi khasiat dan keamanan disajikan dalam Tabel S2 dan S3 , masing-masing. Kovariat diuji pada intersepsi hubungan paparan-respons (lihat Metode Tambahan untuk detailnya).
Simulasi berbasis model
Berdasarkan model respons paparan yang dikembangkan, respons dosis diproyeksikan untuk titik akhir biner dengan rejimen dosis nominal yang berbeda (0,3 mg/kg Q2W, 1 mg/kg Q2W, dan 3 mg/kg Q4W untuk efikasi; 0,15 mg/kg Q2W, 0,3 mg/kg Q2W, 0,5 mg/kg Q2W, 1 mg/kg Q2W, 3 mg/kg Q2W, dan 3 mg/kg Q4W untuk keamanan). Baik ketidakpastian maupun variabilitas dipertimbangkan dalam prediksi paparan berdasarkan matriks varians-kovarians yang diperoleh dari matriks informasi Fisher dan efek acak, masing-masing; setiap set simulasi per tingkat dosis berisi 100 populasi dengan masing-masing 500 peserta. Nilai kovariat diambil sampelnya secara acak dengan penggantian (pengambilan sampel bootstrap) dari populasi AGAVE-201 untuk prediksi efikasi dan dari kedua studi cGVHD untuk simulasi keamanan. Untuk menghitung median dan CI untuk probabilitas hasil kemanjuran dan keamanan, rangkaian kejadian yang sesuai dengan nilai paparan yang berbeda diambil sampelnya 1.000 kali dari distribusi Bernoulli, dan 95% CI dihitung sebagai persentil 2,5% dan 97,5% dari nilai simulasi.
Untuk mengevaluasi efek berat badan (kovariat yang diidentifikasi sebagai berpotensi signifikan secara klinis dalam analisis PK/PD populasi) pada kejadian efikasi dan keamanan, probabilitas terjadinya respons dan kejadian keamanan diproyeksikan untuk dosis nominal 0,3 mg/kg Q2W menggunakan kuartil distribusi berat badan yang diamati dari populasi untuk analisis pajanan-efikasi ( N = 239; median [referensi], 71,6 kg; kisaran, 18,1–151 kg) dan analisis pajanan-keamanan ( N = 278; median [referensi], 72,4 kg; kisaran, 18,1–151 kg), masing-masing. Untuk menghitung median dan CI untuk probabilitas hasil efikasi dan keamanan, rangkaian kejadian yang sesuai dengan nilai pajanan yang berbeda diambil sampelnya 1.000 kali dari distribusi Bernoulli, dan 95% CI dihitung sebagai persentil 2,5% dan 97,5% dari nilai simulasi.
Pernyataan etika
Semua penelitian dilakukan sesuai dengan pedoman Praktik Klinis yang Baik dan ketentuan Deklarasi Helsinki. Protokol penelitian disetujui oleh dewan peninjau institusional atau komite etik yang relevan di setiap pusat penelitian. Persetujuan tertulis diperoleh dari semua pasien (atau orang tua/wali sah mereka) sebelum pendaftaran.
HASIL
Analisis efikasi paparan
Di antara 241 pasien yang dapat dievaluasi khasiatnya dengan cGVHD dari studi AGAVE-201, 239 dimasukkan dalam analisis ini; 2 pasien yang tidak diobati dengan axatilimab dikeluarkan dari analisis. Di antara 239 pasien, 79, 81, dan 79 menerima dosis masing-masing 0,3 mg/kg Q2W, 1 mg/kg Q2W, dan 3 mg/kg Q4W. Ringkasan respons yang diamati untuk titik akhir khasiat biner ditunjukkan pada Tabel S4 .
Untuk 2 titik akhir efikasi biner (peningkatan keseluruhan dan ≥ 7 poin dalam mLSS) yang disertakan dalam analisis respons paparan ini, 7 metrik paparan signifikan secara statistik yang tumpang tindih (CMAXSD, LOGCMAXSD, CMAX1, LOGCMAX1, AUCSDINF, LOGAUCSDINF, dan AUC1) yang dikaitkan dengan dosis tunggal atau siklus pengobatan pertama diidentifikasi, dengan nilai kriteria informasi Akaike (AIC) dan nilai P yang sebanding . Karena AUCSDINF setara dengan area di bawah kurva dari waktu 0 hingga interval pemberian dosis (AUCτ) pada kondisi stabil, AUCSDINF dipilih sebagai metrik paparan yang akan digunakan dalam analisis respons paparan untuk respons keseluruhan dan peningkatan ≥ 7 poin dalam mLSS. Parameter model akhir ditunjukkan pada Tabel S5 . Respons keseluruhan dan peningkatan ≥ 7 poin dalam mLSS memiliki asosiasi negatif dengan AUCSDINF axatilimab ( Gambar 1 ). Peluang pasien untuk mencapai respons menyeluruh dan perbaikan ≥ 7 poin pada mLSS menurun masing-masing sebesar 7,6% dan 5,8%, untuk setiap peningkatan 50 μg/mL*d pada AUCSDINF. Meskipun tidak ada kovariat signifikan yang diidentifikasi untuk respons menyeluruh, peluang pasien untuk mencapai perbaikan ≥ 7 poin pada mLSS meningkat sebesar 2,15 kali lipat jika pasien memiliki cGVHD dengan > 4 organ yang terlibat pada awal ( Tabel 1 ), yang menunjukkan bahwa pasien dengan penyakit awal yang lebih luas dapat memperoleh manfaat yang lebih besar dari pengobatan axatilimab.

Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Analisis regresi logistik untuk titik akhir pajanan-efikasi: ( a ) respons keseluruhan dan ( b ) peningkatan ≥ 7 poin dalam mLSS, dan plot hutan untuk titik akhir pajanan-efikasi: ( c ) respons keseluruhan dan ( d ) peningkatan ≥ 7 poin dalam mLSS. AUCSDINF, area di bawah kurva setelah dosis tunggal dari waktu 0 hingga tak terhingga; mLSS, Skala Gejala Lee yang dimodifikasi; Q2W, sekali setiap 2 minggu; Q4W, sekali setiap 4 minggu. Untuk panel a dan b , titik merah menunjukkan status biner dari kejadian respons (ya = 1, tidak = 0). Angka yang ditampilkan adalah n / N untuk setiap kuartil pajanan. Titik hitam dengan batang vertikal adalah median dan CI untuk setiap kuartil pajanan. Garis hitam pekat dengan daerah yang diarsir menunjukkan kurva prediksi dan 95% CI. Berlian dengan batang horizontal menunjukkan persentil ke-5, ke-50, dan ke-95 dari pajanan untuk setiap dosis.
Tabel 1. Estimasi parameter dari model regresi logistik untuk hubungan paparan-efikasi
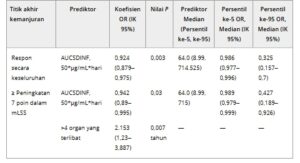
AUCSDINF, area di bawah kurva setelah dosis tunggal dari waktu 0 hingga tak terbatas; mLSS, Skala Gejala Lee yang dimodifikasi; OR, rasio peluang.
Respons keseluruhan yang diprediksi pada pasien dengan median AUCSDINF adalah 69%; respons keseluruhan yang diprediksi pada pasien dengan AUCSDINF pada persentil ke-5 dan ke-95 adalah 70,8% dan 44,4%, berturut-turut ( Gambar 1 ). Peningkatan ≥ 7 poin yang diprediksi dalam mLSS pada pasien dengan nilai median AUCSDINF adalah 45,4%; peningkatan ≥ 7 poin yang diprediksi dalam mLSS pada pasien dengan AUCSDINF pada persentil ke-5 dan ke-95 adalah 46,8% dan 27,7%, berturut-turut ( Gambar 1 ). Pemeriksaan prediktif visual dari model pajanan-efikasi akhir menunjukkan bahwa di semua kuartil AUCSDINF pajanan axatilimab, ada kesepakatan antara nilai yang diprediksi model dan nilai yang diamati, dengan nilai yang diamati tumpang tindih dengan interval prediksi 90% ( Gambar S1 ).
Paparan axatilimab bukan merupakan prediktor signifikan secara statistik untuk DOR di antara 153 pasien yang mencapai respons keseluruhan pada AGAVE-201. Plot Kaplan–Meier representatif yang menunjukkan DOR dikelompokkan berdasarkan kuartil AUCSS ditunjukkan pada Gambar S2 ( P = 0,85). Khususnya, 30 dari 153 pasien (19,6%) tetap berisiko lebih dari 6 bulan. Mengingat tidak ada hubungan paparan-respons yang signifikan secara statistik yang diamati antara semua metrik paparan yang dievaluasi dan DOR, tidak ada penilaian kovariat lebih lanjut yang dilakukan untuk titik akhir ini.
Analisis paparan keselamatan
Sebanyak 279 pasien dengan cGVHD dapat dievaluasi keamanannya melalui 2 studi; 278 pasien dimasukkan dalam analisis pajanan-keselamatan ini. Satu pasien dari studi SNDX-6352-0503 dikeluarkan karena sampel PK tidak ada. Secara keseluruhan, 79, 107, 85, 6, dan 2 pasien menerima dosis 0,3 mg/kg Q2W, 1 mg/kg Q2W, 3 mg/kg Q4W, 3 mg/kg Q2W, atau dosis yang lebih rendah (masing-masing 0,15 mg/kg Q2W, 0,5 mg/kg Q2W). Ringkasan kejadian yang diamati untuk titik akhir keamanan disediakan dalam Tabel S6 .
Dua metrik paparan yang signifikan secara statistik yang tumpang tindih, CMAXSS dan AUCSS, diidentifikasi untuk 10 dari 11 titik akhir keamanan biner yang diperiksa. AUCSS memiliki nilai P dan AIC terendah; dengan demikian, AUCSS dipilih sebagai metrik paparan yang akan digunakan untuk titik akhir keamanan biner ini. Semua 10 titik akhir keamanan memiliki asosiasi positif dengan AUCSS axatilimab ( Tabel S7 ). Plot regresi logistik untuk titik akhir keamanan ditunjukkan pada Gambar 2 dan Gambar S3 , dan plot hutan probabilitas kejadian keamanan ditunjukkan pada Gambar 3 dan Gambar S4 . Pemeriksaan prediktif visual mengonfirmasi bahwa ada kesesuaian yang baik antara data yang diamati dan simulasi respons keamanan dalam model akhir ( Gambar S5 ).

Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Analisis regresi logistik untuk titik akhir keamanan respons paparan yang representatif: ( a ) TEAE tingkat ≥ 3, ( b ) TEAE yang mengarah pada modifikasi dosis, ( c ) AESI tingkat ≥ 3, ( d ) TEAE terkait pengobatan. AE, efek samping; AESI, efek samping yang menjadi perhatian khusus; AUCSS, area di bawah kurva untuk siklus pengobatan 4 minggu dalam kondisi mapan; Q2W, sekali setiap 2 minggu; Q4W, sekali setiap 4 minggu; TEAE, efek samping yang muncul akibat pengobatan. Titik merah menunjukkan status biner kejadian AE (ya = 1, tidak = 0). Angka yang ditampilkan adalah n / N untuk setiap kuartil paparan. Titik hitam dengan garis vertikal adalah median dan CI untuk setiap kuartil paparan. Garis hitam pekat dengan daerah yang diarsir menunjukkan kurva prediksi dan 95% CI. Berlian dengan garis horizontal menunjukkan persentil ke-5, ke-50, dan ke-95 dari paparan untuk setiap dosis.
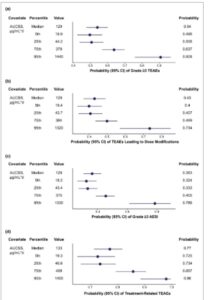
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Plot hutan untuk titik akhir keamanan respons paparan: ( a ) TEAE tingkat ≥ 3; ( b ) TEAE yang menyebabkan modifikasi dosis; ( c ) AESI tingkat ≥ 3; ( d ) TEAE terkait pengobatan. AESI, efek samping yang menjadi perhatian khusus; AUCSS, area di bawah kurva untuk siklus pengobatan 4 minggu yang stabil; TEAE, efek samping yang muncul akibat pengobatan.
Untuk semua titik akhir keamanan yang disertakan dalam model keamanan regresi logistik akhir, peningkatan 50 μg/mL*d dalam AUCSS meningkatkan kemungkinan kejadian TEAE; peningkatan terendah adalah untuk TEAE serius (2,8%), dan peningkatan tertinggi adalah untuk peningkatan CPK (23,8%; Tabel 2 ). Beberapa kovariat signifikan secara statistik diidentifikasi untuk titik akhir keamanan ini. Meskipun kemungkinan TEAE serius meningkat 2 kali lipat untuk pasien dengan skor kinerja Karnofsky/Lansky dasar ≤ 70% (yaitu, tidak dapat bekerja), peningkatan albumin plasma sebesar 1 g/L menurunkan kemungkinan TEAE serius sebesar 9,1%. Kemungkinan terjadinya kejadian peningkatan amilase dan lipase pada pasien meningkat sebesar 1,4% untuk setiap peningkatan 1 U/L pada lipase dasar. Peluang terjadinya reaksi terkait infus pada pasien menurun sebesar 1,7% dengan setiap peningkatan 1 U/L alanine aminotransaminase dasar. Peluang terjadinya peningkatan CPK pada pasien meningkat sebesar 1% dengan setiap peningkatan 1 U/L CPK dasar.
Tabel 2. Estimasi parameter dari model regresi logistik untuk hubungan paparan-keselamatan
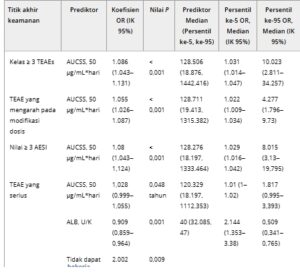
AESI, efek samping yang perlu mendapat perhatian khusus; ALB, albumin; ALT, alanine aminotransaminase; AUCSS, area di bawah kurva untuk siklus pengobatan 4 minggu yang stabil; CPK, kreatin fosfokinase; OR, rasio peluang; TEAE, efek samping yang muncul akibat pengobatan.
Ditetapkan sebagai skor kinerja dasar Karnofsky/Lansky ≤ 70%.
b Istilah efek samping yang dikelompokkan.
c Termasuk reaksi hipersensitivitas.
Infeksi dengan etiologi yang tidak ditentukan tidak memiliki hubungan yang signifikan secara statistik dengan paparan axatilimab ( Gambar S6 ); dengan demikian, tidak ada penilaian kovariat lebih lanjut yang dilakukan untuk titik akhir ini.
Prediksi berbasis model
Karena tanda koefisien β negatif dalam model regresi logistik di mana paparan axatilimab diidentifikasi sebagai prediktor signifikan respons efikasi ( β AUCSDINF sebesar -0,0016 [95% CI, -0,0026, -0,0005] dan -0,0012 [95% CI, -0,0023, -0,0001] untuk respons keseluruhan dan peningkatan ≥ 7 poin dalam respons mLSS, masing-masing), probabilitas respons yang diprediksi menurun seiring dengan peningkatan dosis axatilimab. Hasilnya, probabilitas respons tertinggi diamati dengan regimen 0,3 mg/kg Q2W ( Gambar 4 ), dengan median probabilitas respons keseluruhan sebesar 70,8% (95% CI, 65,9%–75,7%) dan median peningkatan ≥ 7 poin dalam probabilitas mLSS sebesar 53,2% (95% CI, 47,7%–58,4%), yang konsisten dengan nilai yang diamati untuk titik akhir ini (masing-masing 74,7% dan 54,4%). Perubahan maksimum dalam probabilitas antara 0,3 mg/kg Q2W dan 3 mg/kg Q4W untuk respons keseluruhan adalah -14,1%, dan -9,9% untuk peningkatan ≥ 7 poin dalam mLSS.
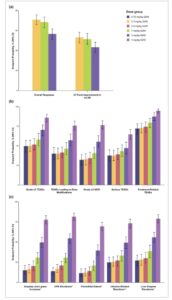
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Tingkat kejadian yang diprediksi model dari tingkat dosis yang dievaluasi untuk ( a ) titik akhir efikasi, ( b ) titik akhir TEAE umum, dan ( c ) titik akhir keamanan tambahan. AESI, kejadian buruk yang menjadi perhatian khusus; CPK, kreatin fosfokinase; mLSS, Skala Gejala Lee yang dimodifikasi; Q2W, sekali setiap 2 minggu; Q4W, sekali setiap 4 minggu; TEAE, kejadian buruk yang muncul akibat pengobatan. *Istilah kejadian buruk yang dikelompokkan. † Termasuk reaksi hipersensitivitas.
Sebaliknya, probabilitas semua kejadian keamanan yang paparan axatilimab (AUCSS) merupakan prediktor signifikan secara statistik meningkat dengan paparan axatilimab ( Gambar 4 ). Probabilitas kejadian yang diprediksi konsisten dengan nilai yang diamati untuk rejimen pengobatan 0,3 mg/kg Q2W, 1 mg/kg Q2W, dan 3 mg/kg Q4W. Peningkatan terbesar dalam probabilitas kejadian keamanan diamati untuk peningkatan CPK dengan probabilitas rata-rata 13,9% (95% CI, 9,1%–18,8%) dan 81,7% (95% CI, 77,2%–86,1%) untuk rejimen 0,15 mg/kg Q2W dan 3 mg/kg Q2W, masing-masing ( Gambar 4 ).
Untuk mengevaluasi efek berat badan pada efikasi dan keamanan, paparan obat pada pasien yang dapat dievaluasi efikasinya pada AGAVE-201 dan pasien yang dapat dievaluasi keamanannya pada SNDX-6352-0503 dan AGAVE-201 disimulasikan menggunakan parameter model PK individual pada dosis 0,3 mg/kg Q2W. Metrik paparan, AUCSDINF dan AUCSS —prediktor efikasi dan keamanan, masing-masing— meningkat seiring dengan berat badan ( Gambar S7 ). AUCSDINF median dalam populasi analisis paparan-efikasi meningkat dari 9,98 μg/mL*d pada kuartil berat badan pertama (median, 53,6 kg) menjadi 15,2 μg/mL*d pada kuartil keempat (median, 94,8 kg). Demikian pula, median AUCSS dalam populasi analisis pajanan-keselamatan meningkat dari 18,3 μg/mL*d pada kuartil pertama (median, 53,8 kg) menjadi 29,8 μg/mL*d pada kuartil keempat (median, 97,6 kg). Nilai median AUCSDINF dan AUCSS untuk setiap kuartil berat badan digunakan untuk memprediksi probabilitas respons dan terjadinya peristiwa keamanan, masing-masing. Perbedaan pajanan antara kuartil pertama dan kuartil keempat berat badan mengakibatkan perubahan relatif minimal baik dalam efikasi (< 0,4% untuk keseluruhan dan peningkatan ≥ 7 poin dalam probabilitas respons mLSS) dan keamanan (< 4,4% untuk semua titik akhir keamanan; Gambar 5 ).

Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Tingkat kejadian yang diprediksi model untuk 0,3 mg/kg dikelompokkan berdasarkan kuartil berat badan untuk ( a ) titik akhir efikasi biner dan ( b ) titik akhir keamanan. AESI, kejadian buruk yang menjadi perhatian khusus; AUCSDINF, area di bawah kurva setelah dosis tunggal dari waktu 0 hingga tak terhingga; AUCSS, area di bawah kurva untuk siklus pengobatan 4 minggu kondisi mapan; CPK, kreatin fosfokinase; mLSS, Skala Gejala Lee yang dimodifikasi; Q, kuartil; TEAE, kejadian buruk yang muncul akibat pengobatan. *Median (rentang) berat badan Q1, Q2, Q3, dan Q4 untuk titik akhir efikasi masing-masing adalah 53,6 (18,1–60,3), 67 (60,8–71,6), 76,2 (71,9–84), dan 94,8 (84,1–151) kg. † Berat badan rata-rata (kisaran) Q1, Q2, Q3, dan Q4 untuk titik akhir keamanan masing-masing adalah 53,8 (18,1–62), 67,9 (62,2–72,3), 79,2 (72,5–85,7), dan 97,6 (85,8–151) kg. ‡ Istilah efek samping dikelompokkan. § Termasuk reaksi hipersensitivitas.
DISKUSI
Axatilimab, antibodi monoklonal yang menghambat pengikatan ligan ke CSF-1R dan menurunkan regulasi perkembangan dan diferensiasi makrofag yang berasal dari monosit patogenik, merupakan agen imunoterapi yang menjanjikan untuk cGVHD. Tujuan dari analisis ini adalah untuk mengkarakterisasi hubungan paparan-efikasi dan paparan-keamanan antara beberapa titik akhir efikasi dan keamanan yang telah dipilih sebelumnya serta paparan axatilimab, dan untuk mendekonvolusikan variabilitas yang mendasarinya melalui pencarian kovariat.
Analisis pajanan-keselamatan didasarkan pada data dari studi fase 1/2 SNDX-6352-0503 dan fase 2 AGAVE-201, yang mencakup 278 pasien dengan cGVHD, sedangkan pemodelan pajanan-efikasi dilakukan dengan menggunakan data hanya dari AGAVE-201 (239 pasien). Untuk memperhitungkan penyesuaian dosis dalam studi dan PK nonlinier axatilimab dengan eliminasi tiga fase, model PK/PD populasi semimekanistik yang dikembangkan sebelumnya dengan pembersihan axatilimab yang dimediasi target digunakan untuk menghasilkan metrik pajanan, termasuk AUC dan Cmax . 16 Selain itu , metrik ini dieksplorasi dalam 3 skenario: pada kondisi stabil, pada siklus pengobatan 4 minggu pertama, dan setelah dosis tunggal. Untuk 2 opsi terakhir, dosis nominal dan rejimen digunakan. Selain itu, metrik pajanan AUC dan Cmax terkait dosis tunggal dengan dosis sebelum TOFI diuji untuk analisis pajanan-keselamatan. Dasar pemikiran untuk menggunakan dosis tunggal dan siklus pertama untuk menghasilkan paparan adalah bahwa metrik ini kurang rentan terhadap efek pengganggu dari disposisi obat yang dimediasi target dan ADA pada pembersihan di awal pengobatan dibandingkan dengan rekan kondisi mapan mereka. Untuk memperhitungkan heterogenitas antarpasien dalam dosis axatilimab karena modifikasi dosis, paparan kondisi mapan dihasilkan menggunakan dosis siklus rata-rata individu yang dihitung untuk setiap titik akhir sebagai dosis rata-rata harian dari Hari 1 hingga TOFI dikalikan dengan jumlah hari dalam siklus pengobatan 2 minggu atau 4 minggu (untuk rejimen Q2W dan Q4W, masing-masing) dalam periode ini. Jika tidak ada kejadian yang terjadi, batas waktu adalah awal Siklus 7 atau akhir pengobatan untuk analisis efikasi dan keamanan, masing-masing. Akhirnya, setiap metrik paparan axatilimab dievaluasi dalam bentuk yang tidak ditransformasikan dan ditransformasikan-log. Secara total, 12 dan 16 jenis parameter PK axatilimab diturunkan dan digunakan dalam analisis berbasis model mengenai kemanjuran dan keamanan, masing-masing, untuk memastikan luasnya kemungkinan asosiasi dalam analisis.
Prediktor tunggal berbasis paparan optimal dipilih untuk setiap kelas hasil, secara terpisah untuk analisis efikasi dan keamanan, yang bertindak sebagai model dasar untuk pencarian kovariat bertahap berikutnya. Untuk metrik efikasi, konsentrasi puncak axatilimab atau AUC, baik pada siklus pengobatan pertama atau setelah dosis tunggal, dipertimbangkan. Mengingat bahwa PK axatilimab yang digerakkan oleh target kompleks juga rentan terhadap efek ADA, AUC dipilih daripada Cmax sebagai metrik yang lebih mencerminkan sifat profil PK axatilimab pada tingkat pasien. Probabilitas kejadian keamanan terutama dikaitkan dengan parameter PK kondisi stabil.
Berdasarkan hasil pemodelan regresi logistik, hubungan yang signifikan secara statistik diamati antara paparan axatilimab dan titik akhir efikasi, termasuk respons keseluruhan dan peningkatan ≥ 7 poin dalam respons mLSS. Koefisien untuk paparan axatilimab negatif untuk respons keseluruhan dan peningkatan ≥ 7 poin dalam respons mLSS, yang menunjukkan penurunan efek farmakologis diamati dengan peningkatan konsentrasi obat. Konsisten dengan temuan ini, probabilitas rata-rata respons diprediksi menurun sebesar 14,1% dan 9,9% untuk respons keseluruhan dan peningkatan ≥ 7 poin dalam hasil mLSS, masing-masing, antara tingkat dosis 0,3 mg/kg Q2W dan 3 mg/kg Q4W. Hubungan negatif antara beberapa metrik paparan axatilimab dan kejadian respons keseluruhan atau peningkatan ≥ 7 poin mLSS mungkin disebabkan oleh beberapa faktor. Semua metrik paparan yang diidentifikasi sebagai prediktor signifikan secara statistik dari efikasi axatilimab dikaitkan dengan dosis tunggal atau siklus pengobatan pertama. Parameter ini menunjukkan paparan naif yang dicapai dengan dosis nominal, yang rentan terhadap penyesuaian dosis, penghentian dosis, dan ADA, terutama untuk dosis yang lebih tinggi. Metrik PK keadaan stabil sebagian memperhitungkan faktor-faktor ini; namun, metrik tersebut tidak berkorelasi dengan efikasi axatilimab. Lebih sedikit pasien dalam kelompok dosis 0,3 mg/kg Q2W (6%) yang menghentikan pengobatan karena AE dibandingkan dengan mereka yang berada dalam kelompok dosis 1 mg/kg Q2W atau 3 mg/kg Q4W (masing-masing 22% dan 18%). 13 Akibatnya, pasien dalam kelompok dosis 0,3 mg/kg Q2W memiliki median durasi pengobatan terpanjang (9 siklus) dibandingkan dengan mereka yang berada dalam kelompok dosis 1 mg/kg Q2W (8 siklus) dan 3 mg/kg Q4W (6 siklus). 13 Akibatnya, proporsi pasien yang menerima 0,3 mg/kg Q2W lebih besar, dibandingkan dengan mereka yang menerima 1 mg/kg Q2W dan 3 mg/kg Q4W, mencapai Siklus 7 Hari 1, di mana efikasi dinilai. Dengan demikian, dapat dihipotesiskan bahwa hubungan paparan-efikasi mencapai titik puncaknya dengan rejimen dosis 0,3 mg/kg Q2W, dan peningkatan dosis lebih lanjut tidak memberikan peningkatan substansial dalam manfaat pengobatan, dan hubungan negatif antara paparan dan efikasi dapat dikaitkan dengan masalah tolerabilitas pada tingkat dosis yang lebih tinggi. Dosis yang lebih tinggi atau lebih rendah dari 0,3 mg/kg Q2W, paling banter, akan memberikan efikasi yang serupa dengan 0,3 mg/kg Q2W.
Respons keseluruhan tidak dikaitkan dengan kovariat lainnya. Untuk probabilitas perbaikan ≥ 7 poin pada mLSS, prediktor tambahan (jumlah organ yang terlibat pada awal) diidentifikasi. Terapi axatilimab meningkatkan peluang mencapai perbaikan ≥ 7 poin pada mLSS sebanyak 2,15 kali untuk pasien dengan > 4 organ yang terlibat pada awal, yang menunjukkan perbaikan sistemik terjadi dengan pengobatan axatilimab. Di antara 64% pasien dalam populasi studi AGAVE-201 yang mencapai respons keseluruhan, DOR tidak terpengaruh oleh perbedaan paparan axatilimab.
Selain TEAE tingkat ≥ 3, TEAE serius, TEAE yang terkait dengan modifikasi dosis (penghentian/interupsi/pengurangan), dan TEAE terkait pengobatan, peningkatan enzim amilase, lipase, CPK, dan hati juga diamati pada SNDX-6352-0503 dan AGAVE-201. Untuk titik akhir keamanan ini, paparan axatilimab kondisi stabil (AUCSS) diidentifikasi sebagai prediktor yang signifikan secara statistik. Untuk 10 dari 11 hasil keamanan yang dievaluasi,
Koefisien berdasarkan paparan positif dengan peningkatan peluang kejadian berkisar dari 2,8% untuk TEAE serius hingga 23,5% untuk peningkatan CPK per 50 μg/mL*d AUC. Terjadinya infeksi dengan etiologi yang tidak ditentukan tidak dipengaruhi oleh perbedaan paparan axatilimab. Lima kovariat yang relevan secara klinis ditemukan terkait dengan 4 dari 10 titik akhir keamanan yang paparan axatilimab merupakan prediktor signifikan. Tingkat kejadian peningkatan CPK berkorelasi positif dengan kadar dasar CPK. OR yang sesuai untuk peningkatan CPK pada persentil ke-95 dari CPK dasar (224 U/L) adalah 5,19 relatif terhadap pasien dengan kadar CPK referensi 64 U/L. Tingkat kejadian peningkatan lipase dan amilase berkorelasi positif dengan kadar lipase dasar. Pada persentil ke-95 (108 U/L) untuk lipase, OR untuk peningkatan lipase dan amilase adalah 2,8 kali lipat lebih tinggi dibandingkan dengan pasien dengan kadar lipase acuan 33 U/L. Albumin awal yang rendah dan penurunan status fungsional (didefinisikan sebagai skor kinerja Karnofsky/Lansky awal ≤ 70%) terbukti meningkatkan risiko TEAE yang serius. Pada persentil ke-95 (47 g/L) untuk albumin, OR untuk TEAE yang serius adalah 0,51 dibandingkan dengan pasien dengan kadar albumin acuan 40 g/L. Penurunan status fungsional pada awal berhubungan dengan peningkatan tingkat kejadian TEAE yang serius (OR, 2,0).
Untuk menyelidiki lebih lanjut temuan sebelumnya bahwa berat badan awal memengaruhi paparan axatilimab sebesar > 20%, 16 median probabilitas respons untuk efikasi dan insidensi untuk keamanan dengan kuartil distribusi berat badan yang diamati dalam populasi cGVHD diprediksi untuk hasil efikasi dan keamanan menggunakan model akhir dengan rejimen 0,3 mg/kg Q2W. Dibandingkan dengan paparan median yang diprediksi untuk pasien dalam kuartil pertama distribusi berat badan, AUCSDINF dan AUCSS meningkat masing-masing sebesar 1,52 kali lipat dan 1,63 kali lipat. Namun, perbedaan relatif dalam rata-rata probabilitas respons antara persentil berat badan dibatasi hingga 0,4% untuk respons keseluruhan dan peningkatan ≥ 7 poin dalam mLSS. Di antara 10 titik akhir keamanan yang terkait dengan paparan axatilimab, efek yang paling menonjol diamati dengan peningkatan CPK yang dikelompokkan, yang menunjukkan peningkatan sebesar 4,4% dalam kemungkinan respons (dari 0,113 pada kuartil berat badan pertama menjadi 0,118 pada kuartil keempat). Meskipun berat badan pada 0,3 mg/kg memiliki efek yang relatif kuat pada paparan dalam analisis PK/PD populasi, 16 berat badan pada 0,3 mg/kg memiliki efek minor pada kemungkinan kejadian efikasi dan keamanan, sehingga tidak dianggap sebagai kovariat yang bermakna secara klinis. Oleh karena itu, dosis berdasarkan berat badan (mg/kg) sesuai untuk rentang berat badan (18,1–151 kg) pasien dalam studi AGAVE-201.
Berdasarkan model efikasi paparan yang dikembangkan dan simulasi ke depan, 0,3 mg/kg Q2W memberikan probabilitas respons tertinggi di antara 3 rejimen dosis yang diuji dalam studi AGAVE-201. Pada 0,3 mg/kg Q2W, probabilitas respons rata-rata adalah 70,8% untuk respons keseluruhan dan 53,2% untuk peningkatan ≥ 7 poin dalam mLSS, yang konsisten dengan nilai yang diamati (masing-masing 74,7% dan 54,4%). Kelompok dosis 0,3 mg/kg juga memiliki probabilitas kejadian kejadian terendah yang diprediksi untuk semua 10 titik akhir keamanan di antara 3 rejimen dosis yang dievaluasi dalam AGAVE-201. Pada 0,3 mg/kg Q2W, 6,3% pasien memiliki TEAE yang menyebabkan pengurangan dosis, 38,0% memiliki TEAE yang menyebabkan interupsi dosis, dan 6,3% memiliki TEAE yang menyebabkan penghentian. Hasil ini menunjukkan bahwa profil keamanan axatilimab yang diberikan pada dosis 0,3 mg/kg Q2W dapat diterima dengan toksisitas yang dapat dikelola. Selain itu, karena probabilitas kejadian keamanan yang diprediksi untuk dosis 0,3 mg/kg Q2W serupa dengan dosis 0,15 mg/kg Q2W di semua titik akhir keamanan yang dievaluasi, dosis yang lebih rendah tidak diharapkan memberikan peningkatan keamanan yang signifikan.
Singkatnya, dalam rentang dosis yang diuji dalam studi AGAVE-201 yang sangat penting, efikasi menurun seiring dengan peningkatan paparan axatilimab, sementara tren yang berlawanan diamati untuk titik akhir keamanan. Di antara 3 rejimen dosis yang dievaluasi dalam AGAVE-201, 0,3 mg/kg Q2W menunjukkan profil efikasi dan keamanan yang paling baik. Dosis yang lebih tinggi atau lebih rendah dari 0,3 mg/kg Q2W tidak mungkin memberikan profil efikasi atau keamanan yang lebih baik. Meskipun berat badan diidentifikasi sebagai kovariat yang signifikan untuk paparan axatilimab, efeknya pada efikasi dan keamanan minimal dan oleh karena itu tidak dianggap bermakna secara klinis.
Kesimpulannya, 0,3 mg/kg Q2W mencapai profil manfaat-risiko yang optimal dan merupakan regimen dosis yang direkomendasikan untuk mengobati pasien dengan cGVHD

